推荐高考(押题)化学一轮复习 可逆反应与化学平衡建立学案(含解析)
- 格式:doc
- 大小:224.69 KB
- 文档页数:5

第2节 化学平衡状态和平衡移动(对应学生用书第135页)[考纲知识整合]1.可逆反应示例:向含有2 mol 的SO 2的容器中通入过量氧气发生2SO 2(g)+O 2(g)催化剂加热2SO 3(g) ΔH=-Q kJ·mol -1(Q >0),充分反应后生成SO 3的物质的量________2 mol(填“<”“>”或“=”,下同),SO 2的物质的量________0 mol ,转化率________100%,反应放出的热量________Q kJ 。
【提示】 < > < < 2.化学平衡状态 (1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态。
(2)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:以上过程可用如图表示:若开始加入生成物,从逆反应建立平衡,则vt图为。
(3)特征(4)化学平衡状态的一般判定方法[应用体验]判断正误 (正确的打“√”,错误的打“×”)。
(1)2H2O 电解点燃2H2↑+O2↑为可逆反应。
( )(2)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,生成2 mol NH3。
( )(3)在化学平衡的建立过程中v正一定大于v逆。
( )(4)对于NO 2(g)+SO23(g)+NO(g) 反应,当每消耗1 mol SO3的同时生成1 mol NO2时,说明反应达到平衡状态。
( )(5)对于A(g)+)+D(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志。
( )(6)化学平衡建立过程中,反应物浓度减小而生成物浓度增大,当二者相等时,反应达到平衡状态。
( )【答案】(1)×(2)×(3)×(4)×(5)×(6)×[高考命题点突破]命题点1 极端转化法确定可逆反应某状态的量1.在密闭容器中进行反应:X 2(g)+Y2,已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )【导学号:95160201】A.Z为0.3 mol·L-1B.Y2为0.4 mol·L-1C.X2为0.2 mol·L-1D.Z为0.4 mol·L-1A[假设反应正向进行到底:X2(g)+Y2起始浓度/(mol·L-1) 0.1 0.3 0.2改变浓度/(mol·L-1) 0.1 0.1 0.2终态浓度/(mol·L-1) 0 0.2 0.4假设反应逆向进行到底:X2(g)+Y2起始浓度/(mol·L-1) 0.1 0.3 0.2改变浓度/(mol·L-1) 0.1 0.1 0.2终态浓度/(mol·L-1) 0.2 0.4 0平衡体系中各物质的浓度范围为0<X2<0.2 mol·L-1,0.2 mol·L-1<Y2<0.4 mol·L-1,0<Z<0.4 mol·L-1。

高考化学一轮复习:第二节化学平衡状态及其移动最新考纲:1.了解化学反应的可逆性。
2.了解化学平衡建立的过程,掌握化学平衡的概念。
3.理解外界条件浓度、温度、压强、催化剂等对化学平衡的影响,认识并能用相关理论解释其一般规律。
4.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
核心素养:1.变化观念与平衡思想:知道化学变化需要一定的条件,并遵循一定规律:认识化学变化有一定限度,是可以调控的。
能多角度、动态地分析化学反应,运用化学反应原理解决实际问题。
2.证据推理与模型认知:建立观点、结论和证据之间的逻辑关系:知道可以通过分析、推理等方法认识化学平衡的特征及其影响因素,建立模型。
通过运用模型解释化学现象,揭示现象的本质和规律。
知识点一可逆反应和化学平衡状态1.化学平衡研究的对象——可逆反应2.极端假设法确定各物质浓度范围假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。
假设反应正向进行到底:X2(g)+Y2(g)2Z(g)起始浓度(mol·L-1) 0.1 0.3 0.2改变浓度(mol·L-1) 0.1 0.1 0.2终态浓度(mol·L-1) 0 0.2 0.4假设反应逆向进行到底:X 2(g)+Y 2(g)2Z(g)起始浓度(mol·L -1) 0.1 0.3 0.2 改变浓度(mol·L -1) 0.1 0.1 0.2 终态浓度(mol·L -1) 0.2 0.4 0平衡体系中各物质的浓度范围为X 2∈(0,0.2),Y 2∈(0.2,0.4),Z∈(0,0.4)。
3.化学平衡状态 (1)概念一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物的浓度和生成物的浓度不再改变,我们称为“化学平衡状态”,简称化学平衡。
(2)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积密闭容器中。

第2讲化学平衡状态考纲要求1.了解化学反应的可逆性。
2.了解化学平衡建立的过程。
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律。
4.了解平衡状态的标志。
基础知识梳理知识点一化学平衡状态1.可逆反应2.化学平衡状态——化学反应的限度(1)建立过程(以N2+3H22NH3为例)向密闭容器中充入一定量的N2和H2,使其反应。
①反应刚开始时,反应物浓度最大,正反应速率最大;生成物浓度为0,逆反应速率为0。
②反应进行中,反应物浓度逐渐减小,正反应速率逐渐减小,生成物浓度逐渐增大,逆反应速率逐渐增大。
③达到平衡时,正反应速率与逆反应速率相等,此时反应物、生成物的浓度均保持不变。
建立过程的v-t为:(2)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有反应物和生成物的浓度保持不变的状态。
(3)平衡状态的特征知识点二外界条件对化学平衡的影响1.外界条件的影响2.平衡移动方向与反应速率的关系 (1)v (正)>v (逆),平衡向正反应方向移动。
(2)v (正)=v (逆),平衡不移动。
(3)v (正)<v (逆),平衡向逆反应方向移动。
3.勒夏特列原理——平衡移动原理如果改变影响平衡的条件之一(如浓度、压强或温度),平衡就向着能够减弱这种改变的方向移动。
基础知识验收1.易误诊断(正确的打“√”,错误的打“×”)。
(1)2H 2+O 2=====点燃 2H 2O 和2H 2O=====电解2H 2↑+O 2↑是可逆反应( )(2)化学反应进行的限度只与化学反应本身有关,与外界条件无关( ) (3)当某反应达到限度时,反应物和生成物的浓度一定相等( )(4)在相同温度下,在相同容积的密闭容器中分别充入1 mol N 2、3 mol H 2和2 mol NH 3,当反应达平衡时,两平衡状态相同( )(5)只要v (正)增大,平衡一定正向移动( )(6)不论恒温恒容,还是恒温恒压容器,加入稀有气体,平衡皆发生移动( ) (7)起始加入原料的物质的量相等,则各种原料的转化率一定相等( ) (8)通过改变一个条件使某反应向正反应方向移动,转化率一定增大( )(9)若平衡发生移动,则v正和v逆一定改变,同理v正、v逆改变,平衡一定移动()(10)对于气体参与的可逆反应,改变体系内的压强,平衡不一定移动()2.对于可逆反应M+2N Q达到平衡时,下列叙述中正确的是______。
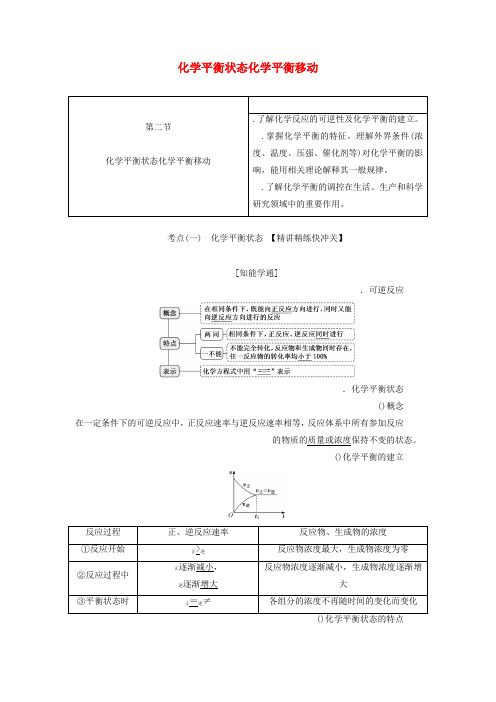
化学平衡状态化学平衡移动考点(一) 化学平衡状态 【精讲精练快冲关】[知能学通].可逆反应.化学平衡状态()概念在一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应保持不变的状态。
质量或浓度的物质的()化学平衡的建立[题点练通].(·武汉质检),经足够长的时间后,下列有关说法中正确的是( ).只存在于中.只存在于和中.某个二氧化硫分子的相对分子质量可能为.三氧化硫的相对分子质量均为解析:选由于+为可逆反应,故存在于、、中,故、项错误;的相对分子质量可能为或或,项正确;的相对分子质量可能为或或,项错误。
.在密闭容器中进行反应:()+()(),已知、、的起始浓度分别为·-、·-、·-,在一定条件下,当反应达到平衡时,各物质的浓度可能是( ).为·-.为·-.为·-.为·-解析:选若完全转化为,则、、的浓度分别是·-、·-、·-;若完全转化为、,则、、的浓度分别是·-、·-、·-;反应为可逆反应,反应物不能完全转化,所以<()< ·-·-<()< ·-<()< ·-。
极端假设法确定各物质浓度范围假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围(以第题为例)。
()假设反应正向进行到底:()+()()起始浓度(·-)转化浓度(·-)终态浓度(·-)()假设反应逆向进行到底:()+()()起始浓度(·-)转化浓度(·-)终态浓度(·-) 故:平衡体系中各物质的浓度范围为∈(),∈(,),∈()。
.下列示意图正确且能说明反应达到平衡状态的是( ).②④.①②.①④.③④解析:选因反应容器保持恒压,所以容器容积随反应进行而不断变化,结合ρ气=可知,气体密度不再变化,说明容器容积不再变化,即气体的物质的量不再变化,反应达到平衡状态,①符合题意;无论是否平衡,反应的Δ都不变,②不符合题意;反应开始时,加入,随着反应的进行,的浓度逐渐变小,故正()逐渐变小,直至达到平衡,③不符合题意;的转化率不再变化,说明的浓度不再变化,反应达到平衡状态,④符合题意。

化学平衡常数、转化率及反应方向的判断李仕才授课主题化学平衡常数、转化率及反应方向的判断教学目的能够写出化学平衡常数的表达式;可以计算出物质的平衡转化率;重、难点判断反应是否达到平衡状态;反应物平衡转化率的变化判断;焓变、熵变及化学反应方向的关系本节知识点讲解1.化学平衡常数(1)定义在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),K=(C)(D) (A)(B)p qm nc cc c⋅⋅。
(3)应用①判断反应进行的限度K值大,说明反应进行的程度大,反应物的转化率高。
K值小,说明反应进行的程度小,反应物的转化率低。
K <10−510−5~105>105反应程度很难进行反应可逆反应可接近完全②判断反应是否达到平衡状态化学反应a A(g)+b B(g)c C(g)+d D(g)在任意状态时,浓度商均为Q c=(C)(D) (A)(B)c da bc cc c⋅⋅。
Q c>K时,反应向逆反应方向进行;Q c=K时,反应处于平衡状态;Q c<K时,反应向正反应方向进行。
③利用平衡常数判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
2.转化率对于一般的化学反应:a A+b B c C+d D,达到平衡时反应物A的转化率为α(A)=A AA的初始浓度-的平衡浓度的初始浓度×100%=0(A)(A)(A)c cc×100%[c0(A)为起始时A的浓度,c(A)为平衡时A的浓度]反应物平衡转化率的变化判断判断反应物转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。
反应类型条件的改变反应物转化率的变化有多种反应物的可逆反应m A(g)+n B(g)p C(g)+q D(g ) 恒容时只增加反应物A的用量反应物A的转化率减小,反应物B的转化率增大同等倍数地增大(或减小)反应物A、B的量恒温恒压条件下反应物转化率不变恒温恒容条件下m+n>p+q反应物A和B的转化率均增大m+n<p+q反应物A和B的转化率均减小m+n=p+q反应物A和B的转化率均不变只有一种反应物的可逆反应m A(g)n B(g)+p C(g) 增加反应物A的用量恒温恒压条件下反应物转化率不变恒温恒容条件下m>n+p反应物A的转化率增大m<n+p反应物A的转化率减小m=n+p反应物A和B的转化率不变典例1 在一定条件下,已达平衡的可逆反应:2A(g)+B(g)2C(g),下列说法中正确的是A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=() ()()22CA Bcc c⋅B.改变条件后,该反应的平衡常数K一定不变C.如果改变压强并加入催化剂,平衡常数会随之变化D.若平衡时增加A和B的浓度,则平衡常数会减小巩固练习1.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)2NO(g)+Cl2(g)2ClNO(g) K2ΔH2<0(Ⅱ)(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。

1 化学平衡状态 化学平衡的移动 明考纲 1.了解化学平衡的建立过程。 2.理解外界条件(T、p、c及催化剂)对化学平衡的影响,认识其一般规律。 3.了解化学平衡的调控在生活生产中的重要作用。 析考情 本节内容是高考的重点与热点,主要考点有两个:一是化学平衡状态的判断,这个考点有所“降温”;二是化学平衡移动原理,它往往以化学图象为载体,结合化学反应速率的变化、化学平衡常数,一起进行考查,同时考查观察图表、数据处理、分析问题的能力。
考点 可逆反应和化学平衡状态 1.化学平衡研究的对象——可逆反应 (1)定义 在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。例如:
N2+3H2高温高压催化剂2NH3 2SO2+O2催化剂△2SO2 (2)特点 ①二同:a.相同条件下;b.正逆反应同时进行。 ②一小:反应物与生成物同时存在,任一组分的转化率都小于(填“大于”或“小于”)100%。 (3)表示 在方程式中用“”表示。 2.化学平衡的建立
以CO(g) + H2O(g)高温CO2(g) + H2(g) 反应为例。 在一定条件下,将0.1 mol CO和0.1 mol H2O(g)通入1 L密闭容器中,开始反应: (1)反应刚开始时:反应物的浓度最大,正反应速率最大。 生成物的浓度为0,逆反应速率为0。 (2)反应进行中: 反应物的浓度逐渐减小,正反应速率逐渐减小。 生成物的浓度逐渐增大,逆反应速率逐渐增大。 (3)肯定最终有一时刻,正反应速率与逆反应速率相等,此时,反应物的浓度不再改变,生成物的浓度也不再改变。 正反应速率和逆反应速率随时间的变化关系如图所示: 2
3.化学平衡状态的定义 在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。 4.化学平衡状态特征
易错警示 (1)可逆反应不等同于可逆过程。可逆过程包括物理变化和化学变化,而可逆反应属于化学变化。 (2)化学反应的平衡状态可以从正反应方向建立,也可以从逆反应方向建立,或者同时从正、逆方向建立。 (3)化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等。
1
可逆反应与化学平衡建立
李仕才
夯实基础知识
1.可逆反应
(1)定义
在同一条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点
①二同:a.相同条件下;b.正、逆反应同时进行。
②一小:反应物与生成物同时存在;任一组分的转化率都小于(填“大于”或“小于”)100%。
(3)表示
在方程式中用“”表示。
2.化学平衡状态
(1)概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的
质量或浓度保持不变的状态。
(2)化学平衡的建立
(3)平衡特点
3.判断化学平衡状态的两种方法
(1)动态标志:v正=v逆≠0
①同种物质:同一物质的生成速率等于消耗速率。
②不同物质:必须标明是“异向”的反应速率关系。如aA+bcC+dD,v正(A)v逆(B)=ab时,
反应达到平衡状态。
2
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度不变。
②各物质的百分含量(物质的量分数、质量分数等)不变。
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量为“不变量”,
则不能作为平衡标志。
错误!错误!错误!错误!错误!错误!错误!错误!
正误判断
(1)2H2O2H2↑+O2↑为可逆反应(×)
(2)二次电池的充、放电为可逆反应(×)
(3)对反应A(g)+B(g)C(g)+D(g),压强不随时间而变,说明反应已达平衡状态(×)
(4)对于NO2(g)+SO2(g)SO3(g)+NO(g)反应,当每消耗1 mol SO3的同时生成1 mol NO
2
时,说明反应达到平衡状态(×)
(5)化学平衡状态指的是反应静止了,不再发生反应了(×)
(6)对于A(g)+B(g)2C(g)+D(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件
下,均不能作为达到化学平衡状态的标志(×)
(7)恒温恒容下进行的可逆反应:2SO2(g)+O2(g)2SO3(g),当SO3的生成速率与SO2的
消耗速率相等时,反应达到平衡状态(×)
(8)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,当该容器内颜色
保持不变时能说明该反应已达到平衡状态(√)
深度思考
1.向含有2 mol SO2的容器中通入过量氧气发生2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol
-1
(Q>0),充分反应后生成SO3的物质的量______2 mol(填“<”“>”或“=”,下同),SO2的
物质的量______0 mol,转化率______100%,反应放出的热量________ Q kJ。
答案 < > < <
2.一定温度下,反应N2O4(g)2NO2(g)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭
容器中,下列示意图正确且能说明反应达到平衡状态的是________。
答案 ①④
解析 ΔH是恒量,不能作为判断平衡状态的标志;该反应是充入1 mol N2O4,正反应速率应
是逐渐减少直至不变,③曲线趋势不正确。
3
典型题目组
题组一 极端假设,界定范围,突破判断
1.在密闭容器中进行反应:X2(g)+Y2,已知X2、Y2、Z的起始浓度分别为0.1
mol·
L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能
是( )
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
答案 A
2.(2018·长沙一中月考)一定条件下,对于可逆反应X(g)+,若X、Y、Z
的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L
-1、0.08 mol·L-1
,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol·L-1
答案 D
归纳总结
极端假设法确定各物质浓度范围
上述题目1可根据极端假设法判断,假设反应正向或逆向进行到底,求出各物质浓度的最大值
和最小值,从而确定它们的浓度范围。
假设反应正向进行到底:X2(g)+Y2(g)2Z(g)
起始浓度(mol·L-1) 0.1 0.3 0.2
改变浓度(mol·L-1) 0.1 0.1 0.2
终态浓度(mol·L-1) 0 0.2 0.4
假设反应逆向进行到底:X2(g)+Y2(g)2Z(g)
起始浓度(mol·L-1) 0.1 0.3 0.2
改变浓度(mol·L-1) 0.1 0.1 0.2
终态浓度(mol·L-1) 0.2 0.4 0
平衡体系中各物质的浓度范围为X2∈(0,0.2),Y2∈(0.2,0.4),Z∈(0,0.4)。
题组二 化学平衡状态的判断
3.(2017·石家庄高三模拟)对于CO2+3H23OH+H2O,下列说法能判断该反应达到平
衡状态的是( )
A.v(CO2)=13v(H2)
4
B.3v逆(H2)=v正(H2O)
C.v正(H2)=3v逆(CO2)
D.断裂3 mol H—H键的同时,形成2 mol O—H键
答案 C
4.在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气
体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,
⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
(1)能说明2SO2(g)+O2(g)2SO3(g)达到平衡状态的是________。
(2)能说明I2(g)+H2达到平衡状态的是________。
(3)能说明2NO22O4(g)达到平衡状态的是________________________。
(4)能说明C(s)+CO2达到平衡状态的是________。
(5)能说明NH2COONH4NH3(g)+CO2(g)达到平衡状态的是________。
(6)能说明5CO(g)+I2O55CO2(g)+I2(s)达到平衡状态的是________。
答案 (1)①③④⑦ (2)⑤⑦ (3)①③④⑤⑦ (4)①②③④⑦ (5)①②③ (6)②④⑦
5.若上述题目中的(1)~(4)改成一定温度下的恒压密闭容器,结果又如何?
答案 (1)②③④⑦ (2)⑤⑦ (3)②③④⑤⑦ (4)②③④⑦
总结归纳
规避“2”个易失分点
(1)化学平衡状态判断“三关注”
关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,
还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2)不能作为“标志”的四种情况
①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下的体积不变的反应,体系的压强或总物质的量不再随时间而变化,如
2(g)+I2
(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如
2(g)+I2
(g)。
④全是气体参加的反应,恒容条件下体系的密度保持不变。
5