2021-2022学年高二人教版化学选修四练习:4.3.1电解原理 Word版含答案
- 格式:docx
- 大小:187.85 KB
- 文档页数:3
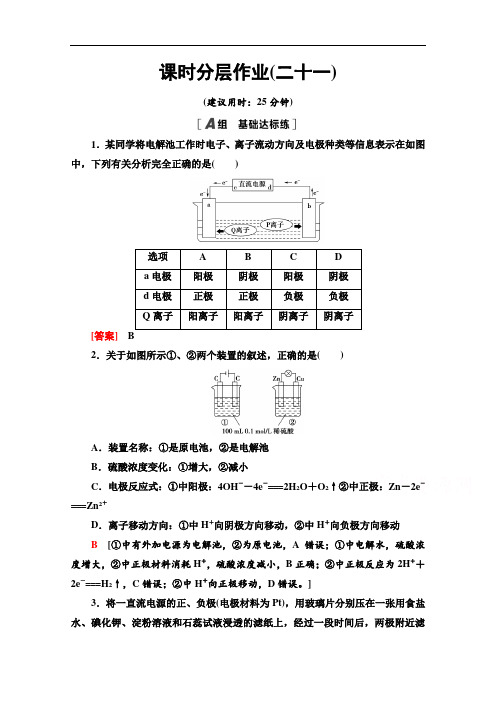
课时分层作业(二十一)(建议用时:25分钟)1.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是()选项 A B C Da电极阳极阴极阳极阴极d电极正极正极负极负极Q离子阳离子阳离子阴离子阴离子[答案]2.关于如图所示①、②两个装置的叙述,正确的是()A.装置名称:①是原电池,②是电解池B.硫酸浓度变化:①增大,②减小C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑②中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动B[①中有外加电源为电解池,②为原电池,A错误;①中电解水,硫酸浓度增大,②中正极材料消耗H+,硫酸浓度减小,B正确;②中正极反应为2H++2e-===H2↑,C错误;②中H+向正极移动,D错误。
]3.将一直流电源的正、负极(电极材料为Pt),用玻璃片分别压在一张用食盐水、碘化钾、淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是()选项 A B C D阳极蓝白红蓝阴极白蓝蓝蓝D[阳极上I-2+放电后,使溶液中的c(H +)<c(OH-),呈碱性,使石蕊显蓝色,故D项正确。
]4.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。
下列说法正确的是()A.X极是电源负极,Y极是电源正极B.a极上的电极反应是2Cl--2e-===Cl2↑C.电解过程中CuSO4溶液的pH逐渐增大D.Pt极上有6.4 g Cu析出时,b极上产生2.24 L(标准状况下)气体B[b极附近溶液显红色,所以b极上的电极反应为2H++2e-===H2↑,a 极上的电极反应为2Cl--2e-===Cl2↑,则Y为电源负极,X为电源正极,Pt为电解阳极,Cu为阴极,a为阳极,b为阴极,A项错误,B项正确;2CuSO4+2H2O=====2Cu+O2↑+2H2SO4,电解过程中CuSO4溶液的pH逐渐变小,C项错误;Pt极上发生氧化反应,不会有Cu析出,D项错误。

高中化学学习材料唐玲出品4-3-1 电解原理1.关于原电池、电解池的电极名称,下列说法错误的是( ) A.原电池中失去电子的一极为负极B.电解池中与直流电源负极相连的一极为阴极C.原电池中相对活泼的一极为正极D.电解池中发生氧化反应的一极为阳极2.电解池中,阳极的电极材料一定( ) A.发生氧化反应B.与电源正极相连C.是铂电极D.得电子3.有关甲、乙、丙、丁四个图示的叙述正确的是( )A .甲中负极反应式为2H ++2e -===H 2↑ B .乙中阳极反应式为Ag ++e -===Ag C .丙中H +向碳棒方向移动D .丁中电解开始时阳极产生黄绿色气体4.用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO 4和NaCl 的混合溶液,可能发生的反应( ) ①2Cu 2++2H 2O=====电解2Cu +4H ++O 2↑②Cu 2++2Cl -=====电解Cu +Cl 2↑③2Cl -+2H +=====电解H 2↑+Cl 2↑④2H 2O=====电解2H 2↑+O 2↑A .①②③B .①②④C .②③④D .②④5. 如图中,两电极上发生的电极反应为:a 极:Cu 2++2e -===Cu ;b 极:Fe -2e -===Fe 2+。
下列说法不正确的是 ( )A .装置中电解质溶液一定含有Cu 2+B .该装置一定是化学能转化为电能C .a 、b 可能是同种电极材料D .a 极上一定发生还原反应6. 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的( )A.锌片是负极B.两个铜片上都发生氧化反应C.石墨是阴极D.两个番茄都形成原电池7.一种充电电池放电时的电极反应为H2+2OH--2e-===2H2O;NiO(OH)+H2O+e-===Ni(OH)2+OH-。
当为电池充电时,与外电源正极连接的电极上发生的反应是( ) A.H2O的还原B.NiO(OH)的还原C.H2的氧化D.Ni(OH)2的氧化8.用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中正确的有( )①该溶液的pH可能增大;②该溶液的pH可能减小;③该溶液的pH可能不变;④该溶液的浓度可能增大;⑤该溶液的浓度可能不变;⑥该溶液的浓度可能减小A.①②③B.①②③④C.①②③④⑤D.全部9.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )A.HCl、CuCl2、Ba(OH)2B.NaOH、CuSO4、H2SO4C.NaOH、H2SO4、Ba(OH)2D.NaBr、H2SO4、Ba(OH)210.下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。

【红对勾】2021高中化学4-3-1电解原理45分钟作业新人教版选修4一、选择题(每题4分,每题有1-2个正确选项)1.用惰性电极实现电解,以下说法正确的选项是( )A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1解析:电解稀H2SO4,实质上是电解水,硫酸的物质的量不变,但溶液体积减小,浓度增大,故溶液pH减小,A不正确。
电解稀NaOH溶液,阳极消耗OH-,阴极消耗H+,实质也是电解水,NaOH溶液浓度增大,故溶液的pH增大,B不正确。
电解Na2SO4溶液时,在阳极发生反映:4OH--4e-===2H2O+O2↑,在阴极发生反映:2H++2e-===H2↑,由于两电极通过电量相等,故析出H2与O2的物质的量之比为2∶1,C不正确。
电解CuCl2溶液时,阴极反映为Cu2++2e-===Cu,阳极反映为2Cl--2e-===Cl2↑,两极通过电量相等时,Cu和Cl2的物质的量之比为1∶1,D正确。
答案:D2.以下关于实验现象的描述不正确的选项是( )A.把铜片和铁片紧靠在一路浸入稀硫酸中,铜片表面显现气泡B.用锌片作阳极,铁片作阴极,电解氯化锌溶液,铁片表面显现一层锌C.把铜片插入三氯化铁溶液中,在铜片表面显现一层铁D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加速解析:铜片和铁片紧靠并浸入稀H2SO4溶液中,铜片上的H+取得由铁片传递过来的电子:2H++2e-===H2↑,因此可观看到铜片表面显现气泡。
用锌板作阳极、铁片作阴极电解ZnCl2溶液,实为电镀,两极发生的反映如下:阳极反映:Zn-2e-===Zn2+,阴极反映:Zn2++2e-===Zn,阴极上析出锌。
铜片插入FeCl3溶液发生的反映是Cu+2Fe3+===Cu2++2Fe2+,并无单质铁的析出。
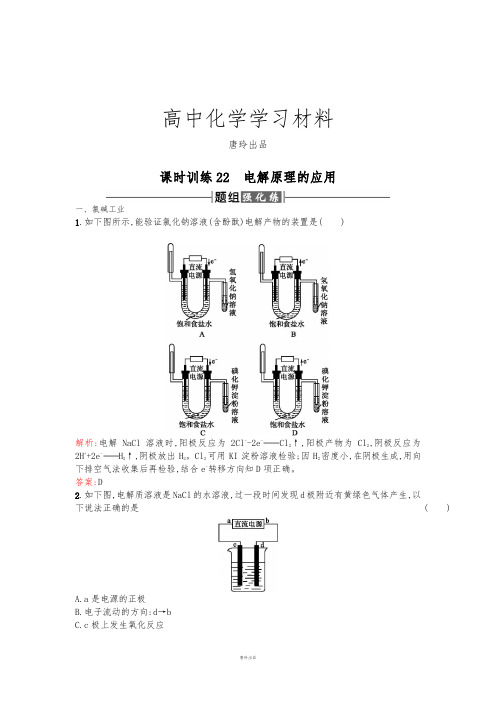
高中化学学习材料唐玲出品课时训练22电解原理的应用一、氯碱工业1.如下图所示,能验证氯化钠溶液(含酚酞)电解产物的装置是( )解析:电解NaCl溶液时,阳极反应为2Cl--2e-Cl2↑,阳极产物为Cl2,阴极反应为2H++2e-H2↑,阴极放出H2。
Cl2可用KI淀粉溶液检验;因H2密度小,在阴极生成,用向下排空气法收集后再检验,结合e-转移方向知D项正确。
答案:D2.如下图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,以下说法正确的是( )A.a是电源的正极B.电子流动的方向:d→bC.c极上发生氧化反应D.如果将c、d两电极互换,则c极上也会生成黄绿色气体解析:d极附近有黄绿色气体产生,应该是Cl-放电,说明d极是阳极,所以b是正极,A项错误;电子流向是a→c,d→b,所以B项正确;c极上发生还原反应,C项错误;如果c是活性电极,互换后,c极上不产生黄绿色气体,D项错误。
答案:B3.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。
通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )A.a为正极,b为负极;NaClO和NaClB.a为负极,b为正极;NaClO和NaClC.a为阳极,b为阴极;HClO和NaClD.a为阴极,b为阳极;HClO和NaCl解析:有关反应有2NaCl+2H2O2NaOH+H2↑+Cl2↑,Cl2+2NaOH NaCl+NaClO+H2O,因阳极生成Cl2,阴极生成NaOH,为使二者充分作用,Cl2应在下端产生,从而推知电源b为正极,a为负极,消毒液的主要成分是NaCl、NaClO。
答案:B二、电镀原理4.在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是( )A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌作阴极,镀件作阳极,溶液中含有亚铁离子解析:本题考查的是电镀的原理。

04课后测评提实能基础中档稍难电解原理的应用1、2、3 6、9、10综合提升4、5、7 8、11、121.关于电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极四周的溶液中滴入KI溶液,溶液呈黄色C.若在阴极四周的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性解析:用石墨作电极电解饱和氯化钠溶液,发生的反应是2NaCl+2H2O=====电解2NaOH+H2↑+Cl2↑,故电解一段时间后电解液呈碱性。
电解时,阳极发生氧化反应:2Cl--2e-===Cl2↑,在阳极四周的溶液中滴入KI溶液时,发生反应2I-+Cl2===2Cl-+I2,故溶液呈黄色;阴极发生还原反应:2H++2e-===H2↑,因而阴极四周的溶液呈碱性,滴入酚酞试液变红。
答案:B2.有关下列装置图的叙述正确的是()A.若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜B.若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极C.若X为锌,则无论K接M还是N,铁都能被爱护D.若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银解析:本题主要考查了电化学学问,意在考查考生的分析推断力量。
电解精炼铜时应使用纯铜作阴极,A项错误;常温下铁遇浓硝酸钝化,所以铜作负极,B 项错误;若X为锌,K接M,形成原电池,铁被爱护,K接N,形成电解法,这是外接电源的阴极爱护法,C项正确;若X为银,Y为FeCl3,K接N,阳极Ag 失电子生成Ag+,阴极Fe3+得电子生成Fe2+,D项错误。
答案:C3.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为2Cu+H2O=====电解Cu2O+H2↑。
下列说法正确的是()A.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成解析:石墨作阴极,阴极上是溶液中的H+反应,电极反应为2H++2e-===H2↑,A选项正确;由电解总反应可知,Cu参与了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-===Cu2O+H2O,当有0.1 mol电子转移时,有0.05 mol Cu2O生成,D选项错误。

高中化学学习材料唐玲出品第四章 第三节 第一课时一、选择题(每小题有1个或2个选项符合题意)1.下列关于电解槽的叙述中不正确的是 ( )A .与电源正极相连的是电解槽的阴极B .与电源负极相连的是电解槽的阴极C .在电解槽的阳极发生氧化反应D .电子从电源的负极沿导线流入电解槽的阴极【答案】 A2.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )A .原电池正极和电解池阳极所发生的反应B .原电池正极和电解池阴极所发生的反应C .原电池负极和电解池阳极所发生的反应D .原电池负极和电解池阴极所发生的反应【解析】 原电池的负极和电解池的阳极发生的是氧化反应;原电池的正极和电解池的阴极发生的是还原反应。
【答案】 BC3.如下图所示的两个实验装置中,溶液的体积均为200 mL ,开始时电解质溶液的浓度均为0.1 mol ·L -1,工作一段时间后,测得两端导线中均通过0.02 mol 电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )A .产生气体的体积:①>②B .电极上析出物质的质量:②>①C .溶液的pH 变化:①增大,②减小D .电极反应式①中阳极:4OH --4e -=2H 2O +O 2↑;②中阴极:2H ++2e -=H 2↑【解析】 A 选项中因①中只有阳极上发生:4OH --4e -=2H 2O +O 2↑而放出气体,②中只有阴极上发生:2H ++2e -=H 2↑而放出气体,通过等量的电子时,产生的气体体积为②>①,A 不正确;B 选项中①中在阴极上发生Cu 2++2e -=Cu ,在阳极上发生:4OH --4e -=2H 2O+O 2↑,析出Cu 和O 2,而在②中只在阴极上析出H 2,故电极上析出物质的质量①>②;C选项中①中电解CuSO 4溶液时,生成了H 2SO 4(2CuSO 4+2H 2O=====电解2Cu +2H 2SO 4+O 2↑)使溶液酸性增强,pH 减小;②中反应消耗了H 2SO 4,使c (H +)减小,pH 增大;只有选项D 正确。
姓名,年级:时间:第三节电解池第1课时电解原理学习目标核心素养1.了解电解、电解池的概念,会描述电解池的工作原理。
2.能够正确书写电解池的电极反应式和总反应式.3.理解并掌握电解规律和电解产物的判断方法。
1。
宏观辨识与微观探析:从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、氧化反应及还原反应的发生、电流的形成过程和原理。
2.证据推理与模型认知:建立对电解池过程的系统分析思路的认识模型,提高对电解池本质的认识。
电解原理1.电解(1)概念:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
(2)特点。
①电解是最强有力的氧化还原手段,是不可逆(填“可逆"或“不可逆")的。
②从本质上看,电解质溶液的导电过程就是电解质溶液的电解过程。
2.电解池(1)概念:将电能转变为化学能的装置。
(2)构成条件:①两个电极,②电解质溶液或熔融电解质,③直流电源,④构成闭合回路。
(3)工作原理(以惰性电极电解氯化铜为例).①实验装置:②原理分析:探究点一电解池电极名称和电解产物的判断1.电极名称的判断(1)根据电源正、负极,离子移动方向、发生反应类型判断,具体如下:(2)依据电极产物——如果电极上析出Cl2或O2,它一定是阳极;如果电极上产生H2或析出金属,它一定是阴极。
(3)根据实验现象判断阴、阳极实际题目中往往不给出电解池的电源,而是给出一些实验现象,据此先判断出是何种离子放电,从而确定出电源的正负极和电解池的阴阳极,并进行有关问题的分析.①滴入酚酞试剂显红色的一极(说明H+放电显碱性)是阴极,接电源的负极,电极反应是2H++2e-===H2↑。
②滴入石蕊试剂显红色的一极(说明OH-放电显酸性)是阳极,接电源的正极,电极反应是4OH--4e-===2H2O+O2↑.③电极增重的一极(说明不活泼金属离子放电析出金属)是阴极,接电源的负极,如Cu2+放电时Cu2++2e-===Cu。
2A.a ,b ;NaCIO NaCIB.a ,b ;NaCIO NaCIC.a ,b ;HCIO NaCID.a,b;HCIONaCI电解2NaCI+2H 2O —2NaOH+H 2 +CI 2,Cb+2NaOHNaCI+NaCIO+H 2O, CI 2, NaOH,,CI 2b ,a ,NaCIO NaCI匚 B4.2HCI+2Ag2AgCI+H 2,5( )i . () A. B. KIC. C. , Cu 2CI --2e - Cl 22KCI+I 2, B 口 D2. +,Na 2H ++2e -H 21 ,A KI D ;Cu ( )A. B. C. D. C D |A 3. 石圈电管恤iu 直盐水Cu, ; (Cu +HCu-2e - Cu 2+, )2H ++2e H 2 , 5 5OH -,Na +Cu(C ) CI 2+2KI CCl 2高中化学解析|要使反应2HCI+2Ag 2AgCl+H 2 T 能进行,需通过电解装置来实现。
B 是原电池装置(Fe 作原 电池的负极,Ag 作原电池的正极),其总反应为Fe+2HCI —— FeC^+H ? 2既不是原电池 也不是电解 池;A 是电解池装置,但Ag 连接在电源的负极上,不会溶解,其实质是电解HCI(2HCI 主里出仔Cl 2»;C 是电解池装置,与电源正极连接的 Ag 失去电子(Ag-e - Ag +),产生的Ag +立即与溶液中的 CI -结合生电辭成AgCI 沉淀,溶液中的『在阴极上获得电子产生 H 2(2H ++2e -H2I),其总反应为2HCI+2Ag "2AgCI+H 2K 答案|C5•两个装置中,液体体积均为200 mL ,开始工作前电解质溶液的浓度均为测得有0.2 moI 电子通过,若忽略溶液体积的变化A. 产生气体体积①=②B. ①中阴极质量增加,②中正极质量减小C. 电极反应式:①中阳极:4OH --4e - 2H 2O+O 2T ②中负极:2H ++2e -=H 2fD. 溶液的pH 变化:①减小,②增大|解析|①发生电解反应,阳极反应为2H 2O-4e -4H ++O 2K 或4OH --4e -2H 2O+2O 2T ),阴极反应为2Cu ++4e " 2Cu;②中发生原电池反应,负极反应为Zn-2e " Zn 2+,正极反应为2H ++2e " H 2K 两 个电池中的CuSO 4和H 2SO 4的物质的量都是 0.1 mol,当通过0.2 mol 电子时两种物质正好完全反应:A. 石墨电极上产生氢气B. 铜电极发生还原反应C. 铜电极接直流电源的负极D. 当有0.1 mol 电子转移时,有0.1 mol Cu 2O 生成解析|石墨作阴极,阴极上是溶液中的 出0反应,电极反应为2H 2O+2e - 2OH "+H 2?,A 选项正确;由电解总反应可知,Cu 参加了反应,所以Cu 作电解池的阳极,发生氧化反应,B 选项错误;阳极与电源的正 极相连,C 选项错误;阳极反应为2Cu+2OH '-2e ' CU 2O+H 2O,当有0.1 mol 电子转移时,有0.05 molCU 2O 生成,D 选项错误。
第2课时 电解原理的应用A 组(巩固基础)1.某溶液中含有溶质NaCl 和H 2SO 4,它们的物质的量之比为3∶1。
用石墨作电极电解溶液时,依据电极产物,可明显分为三个阶段。
下列叙述不正确的是( )A.阴极只析出H 2B.阳极先析出Cl 2,后析出O 2C.电解最终阶段为电解水D.溶液pH 不断增大,最终为7解析:开头电解时,溶质中含有Na +、Cl -、H +、S O 42-,相当于电解HCl,析出H 2和Cl 2,随着电解的进行,H +先消耗完,此时溶质中剩有Na +、Cl -、S O 42-,再连续电解,照旧是Cl -失电子生成Cl 2,阴极为H 2O 中的H +得电子,生成H 2,这时溶质中含有Na +、Cl-、S O 42-、OH -,当Cl -消耗完时,电解的物质为H 2O,溶质中含有Na +、S O 42-、OH -,pH 明显大于7。
答案:DNaCl 溶液浸湿的pH 试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发觉a 电极与试纸接触处消灭一个双色同心圆,内圆为白色,外圆呈浅红色。
下列说法错误的是( ) A.b 电极是阴极B.a 电极与电源的正极相连C.电解过程中水是氧化剂D.b 电极四周溶液的pH 变小解析:a 电极与试纸接触处消灭一个双色同心圆,内圆为白色,外圆呈浅红色,说明a 极四周产生了Cl 2,Cl 2与H 2O 反应生成HCl 和HClO,HCl 使pH 试纸显红色,HClO 具有漂白性,能将红色漂白,所以a 极与电源的正极相连,即a 为阳极,电极反应式为2Cl --2e -Cl 2↑,b 为阴极,电极反应式为2H 2O-4e -H 2↑+2OH -,所以b 极四周的pH 增大。
答案:D3.下列描述中,不符合生产实际的是( ) A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极解析:电解熔融的氧化铝制取金属铝,用碳作阳极,假如用铁作阳极,则铁失电子而消耗,故A 不对。
第三节电解池第1课时电解原理A组1.下列说法错误的是()A.电解质的导电过程是化学变化,而金属的导电是物理变化B.电解质溶液导电的过程,就是电解质被电解的过程C.电解质在任何条件下均可以导电D.电解质溶液导电过程中肯定有新物质生成解析:电解质导电的过程就是被电解的过程,在电解过程中发生氧化还原反应,肯定有新物质生成,所以是化学变化。
金属导电是靠自由电子的定向移动,无新物质生成,是物理变化。
电解质要导电只有在电离的条件下,存在自由移动的离子时才能导电,所以C项错误。
答案:C2.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关推断正确的是()A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变解析:电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d 为阴极。
在电解过程中,因Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,会导致溶液中氯离子浓度降低。
答案:C3.同温、同压下,用惰性电极在U形管中电解下列物质的水溶液,消耗相同的电量,生成气体体积最大的是()A.饱和食盐水B.CuCl2溶液C.CuSO4溶液D.NaOH溶液解析:电解饱和食盐水,两极分别产生氢气和氯气,假设转移2 mol电子,生成氢气和氯气各1 mol,共2 mol;而电解CuCl2溶液产生的气体只有氯气,转移2 mol电子,生成氯气1 mol;电解CuSO4溶液,产生的气体只有氧气,转移2 mol电子,生成氧气0.5 mol;电解NaOH溶液,两极分别产生氢气和氧气,转移2 mol电子,生成氢气1 mol、氧气0.5 mol,共1.5 mol。
答案:A4.在如图所示的装置中,x、y分别是直流电源的两极,通电后发觉a极极板质量增加,b极极板处有无色无臭气体放出,符合这一状况的是()a极板b极板x电极z溶液A锌石墨负极CuSO4B石墨石墨负极NaOHC银铁正极AgNO3D铜石墨负极CuCl2解析:本题突破口是“a极极板质量增加”,据此推断a极肯定是阴极,则b极肯定是阳极。
A是惰性阳极电解CuSO4溶液,符合题意;B的实质是电解水,两极都产生气体,不符合题意;C的阳极是铁,是活性电极,不符合题意;D的阳极生成氯气,是有刺激性气味的气体,不符合题意。
答案:A5.用惰性电极实现电解,下列说法正确的是()A.电解稀硫酸,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1解析:电解稀硫酸,实质上是电解水,硫酸的物质的量不变,但溶液体积削减,浓度增大,故溶液pH减小。
电解稀NaOH溶液,阳极消耗OH-,阴极消耗H+,实质也是电解水,NaOH溶液浓度增大,故溶液的pH增大。
电解Na2SO4溶液时,在阳极发生反应:4OH--4e-2H2O+O2↑。
在阴极发生反应:2H++2e-H2↑,由于两电极通过电量相等,故放出H2与O2的物质的量之比为2∶1。
电解CuCl2溶液时,阴极反应为Cu2++2e-Cu,阳极反应为2Cl--2e-Cl2↑,两极通过电量相等时,Cu和Cl2的物质的量之比为1∶1。
答案:D6.用石墨作电极,电解1 mol·L-1下列物质的溶液,溶液的pH保持不变的是()A.HClB.NaOHC.Na2SO4D.NaCl解析:电解HCl溶液,阴极析出H2,阳极析出Cl2,溶液pH上升;电解NaOH溶液,相当于电解水,溶液pH上升;电解Na2SO4溶液,相当于电解水,溶液pH不变;电解NaCl溶液,阴极析出H2,阳极析出Cl2,溶液pH上升。
答案:C7.某同学欲完成2HCl+2Ag2AgCl+H2↑反应,设计了下列四个试验,你认为可行的试验是()解析:反应不能自发进行,应设计成电解池,金属银失电子作阳极,与电源的正极相连。
答案:C8.用惰性电极电解足量的Cu(NO3)2溶液,下列说法中不正确的是()A.阴极发生的电极反应为Cu2++2e-CuB.阳极发生的电极反应为4OH--4e-2H2O+O2↑C.若有6.4 g金属Cu析出,放出的O2为0.05 molD.恰好电解完时,加入肯定量的Cu(NO3)2溶液可恢复到原来的浓度解析:惰性电极电解足量的Cu(NO3)2溶液,阴极发生的电极反应为Cu2++2e-Cu,阳极发生的电极反应为4OH--4e-2H2O+O2↑,若有6.4 g金属Cu(即0.1 mol)析出,转移电子是0.2 mol,放出的O2为0.2 mol÷4=0.05 mol,恰好电解完时,应加入肯定量的CuO溶液可恢复到原来的浓度。
答案:D9.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是()A.HCl、CuCl2、Ba(OH)2B.NaOH、CuSO4、H2SO4C.NaOH、H2SO4、Ba(OH)2D.NaBr、H2SO4、Ba(OH)2解析:电解盐酸的方程式为2HCl Cl2↑+H2↑,A选项错;电解CuSO4溶液的方程式为2CuSO4+2H2O2Cu+2H2SO4+O2↑,B选项错;电解NaBr溶液的方程式为2NaBr+2H2O2NaOH+H2↑+Br2,D选项错。
答案:C10.在水中加等物质的量的Ag+、Pb2+、Na+、S、N、Cl-,该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为()A.35.5∶108B.16∶207C.8∶1D.108∶35.5解析:溶液中的六种离子,有四种发生反应生成沉淀:Ag++Cl -AgCl↓、Pb2++S PbSO4↓,最终溶液就成了NaNO3溶液;而电解NaNO3溶液,实质就是电解水,电解方程式为2H2O2H2↑+O2↑。
氧化产物和还原产物的质量之比为m(O2)∶m(H2)=(1 mol×32 g·mol-1)∶(2 mol×2 g·mol-1)=8∶1,即C项正确。
答案:C11.如图所示,甲是刚浸过NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发觉A、B间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的极,可发觉滤纸的B极边沿四周有色消灭。
解析:当通电一段时间后,A、B 间的紫红色圆点向A极移动了,由于紫红色是Mn的颜色,即Mn向A极移动,因阴离子向阳极移动,所以A为电解池的阳极(浸有NaCl溶液的石蕊试纸相当于电解池),则与A相连的是电池的正极,B为阴极。
答案:正蓝12.下图是一个电化学过程的示意图。
已知甲池的总反应式为2CH3OH+3O2+4KOH2K2CO3+6H2O(1)请回答图中甲、乙两池的名称。
甲池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:通入O2的电极的电极反应式为。
A(Fe)电极的电极反应式为。
(4)乙池中反应的化学方程式为。
解析:依据题意,甲池是一个燃料电池,则乙池为电解池,在甲池中CH3OH发生氧化反应,为原电池的负极,O2发生还原反应,为原电池的正极,A与CH3OH极相连,为电解池的阴极,B为阳极,电极反应式为甲池:负极:2CH3OH-12e-+16OH-2C+12H2O正极:3O2+12e-+6H2O12OH-乙池:阳极:4OH--4e-2H2O+O2↑阴极:4Ag++4e-4Ag总反应:4AgNO3+2H2O4Ag+O2↑+4HNO3。
答案:(1)原电池电解池(2)负极阳极(3)O2+4e-+2H2O4OH-4Ag++4e-4Ag(4)4AgNO3+2H2O4Ag+O2↑+4HNO3B组1.把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在肯定条件下通电一段时间后,则析出钾、镁、铝的质量之比为()A.1∶2∶3B.3∶2∶1C.6∶3∶1D.13∶4∶3解析:盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽,通电后阴极的电极反应式分别为K++e-K;Mg2++2e-Mg;Al3++3e-Al。
假如转移的电子为1 mol,则分别得到K、Mg、Al为1 mol、mol、mol,其质量分别为1 mol×39 g·mol-1=39 g、mol×24 g·mol-1=12 g、mol×27 g·mol-1=9 g;故K、Mg、Al的质量之比为39∶12∶9=13∶4∶3。
答案:D2.用惰性电极电解2 L 1.0 mol·L-1 CuSO4溶液,在电路中通过0.5 mol电子后,调换正负极连续电解,电路中又通过了1 mol电子,此时溶液中c(H+)(假设溶液体积不变)为()A.1.5 mol·L-1B.0.75 mol·L-1C.0.5 mol·L-1D.0.25 mol·L-1解析:调换正负极前后电极反应式如下:调换前:阳极4OH--4e-2H2O+O2↑,阴极2Cu2++4e-2Cu。
调换后:阳极2Cu-4e-2Cu2+(先),4OH--4e-2H2O+O2↑(后);阴极2Cu2++4e-2Cu。
故电路中转移的1.5 mol电子中,只有1 mol由OH-放电产生,即消耗的n(OH-)=1 mol,亦即溶液中积累的n(H+)=1 mol,则c(H+)=0.5 mol·L-1。
答案:C3.如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B 极,同时C、D产生气泡。
试回答:(1)p为极,A极发生了反应。
(2)C为极,试管里收集到的气体是;D为极,试管里收集到的气体是。
(3)C极的电极反应式是。
(4)当反应进行一段时间后,A、B电极四周溶液的pH(填“增大”“减小”或“不变”)。
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为。
解析:(1)接通电源,X沉积于B极,说明B为阴极,则A为阳极,故q为负极,p为正极,A上发生氧化反应。
(2)H2SO4电解池中,C为阳极,C试管内得O2,D为阴极,D试管内得H2。
(4)A极:X-2e-X2+,B极:X2++2e-X,两极四周pH不变。
(5)设X的摩尔质量为M g·mol-1,则X2++2e-X2 mol M g0.004 mol 0.128 g得M=64。
答案:(1)正氧化(2)阳氧气阴氢气(3)4OH--4e -O2↑+2H2O(4)不变(5)64 g·mol-14.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:阳离子Na +、K+、Cu2+阴离子S、OH-上图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。