材料科学基础考研讲义 第一章 固体结构
- 格式:pdf
- 大小:1.98 MB
- 文档页数:8



《材料科学基础》上半学期内容重点第一章固体材料的结构基础知识键合类型(离子健、共价健、金属健、分子健力、混合健)及其特点;键合的本质及其与材料性能的关系,重点说明离子晶体的结合能的概念;晶体的特性(5个);晶体的结构特征(空间格子构造)、晶体的分类;晶体的晶向和晶面指数(米勒指数)的确定和表示、十四种布拉维格子;第二章晶体结构与缺陷晶体化学基本原理:离子半径、球体最紧密堆积原理、配位数及配位多面体;典型金属晶体结构;离子晶体结构,鲍林规则(第一、第二);书上表2-3下的一段话;共价健晶体结构的特点;三个键的异同点(举例);晶体结构缺陷的定义及其分类,晶体结构缺陷与材料性能之间的关系(举例);第三章材料的相结构及相图相的定义相结构合金的概念:固溶体置换固溶体(1)晶体结构无限互溶的必要条件—晶体结构相同比较铁(体心立方,面心立方)与其它合金元素互溶情况(表3-1的说明)(2)原子尺寸:原子半径差及晶格畸变;(3)电负性定义:电负性与溶解度关系、元素的电负性及其规律;(4)原子价:电子浓度与溶解度关系、电子浓度与原子价关系;间隙固溶体(一)间隙固溶体定义(二)形成间隙固溶体的原子尺寸因素(三)间隙固溶体的点阵畸变性中间相中间相的定义中间相的基本类型:正常价化合物:正常价化合物、正常价化合物表示方法电子化合物:电子化合物、电子化合物种类原子尺寸因素有关的化合物:间隙相、间隙化合物二元系相图:杠杆规则的作用和应用;匀晶型二元系、共晶(析)型二元系的共晶(析)反应、包晶(析)型二元系的包晶(析)反应、有晶型转变的二元系相图的特征、异同点;三元相图:三元相图成分表示方法;了解三元相图中的直线法则、杠杆定律、重心定律的定义;第四章材料的相变相变的基本概念:相变定义、相变的分类(按结构和热力学以及相变方式分类);按结构分类:重构型相变和位移型相变的异同点;马氏体型相变:马氏体相变定义和类型、马氏体相变的晶体学特点,金属、陶瓷中常见的马氏体相变(举例)(可以用许教授提的一个非常好的问题――金属、陶瓷马氏体相变性能的不同――作为题目)有序-无序相变的定义玻璃态转变:玻璃态转变、玻璃态转变温度、玻璃态转变点及其黏度按热力学分类:一级相变定义、特点,属于一级相变的相变;二级相变定义、特点,属于二级相变的相变;按相变方式分类:形核长大型相变、连续型相变(spinodal相变)按原子迁动特征分类:扩散型相变、无扩散型相变第5章 金属材料的显微结构特征一、纯金属的凝固及结晶1、结晶的热力学条件结晶后系统自由能下降。






第一章固体结构1、结合键离子键:正负离子间的库仑力—键合很强,无方向性。
一次键共价键:核间库仑力—方向性,饱和性。
金属键:正离子与自由电子间库仑力—无方向性,无饱和性。
氢键:氢原子核与极性分子间的库仑引力—方向性,饱和性。
二次键结合键范德瓦尔斯键:原子瞬时电偶极矩的感应作用—无方向性。
确定键类型因素:电负性,电负差值。
离子键:硬度大,强度大,脆性大不同键的性能共价键:硬度大,强度大,脆性大金属键:塑韧性好,强韧性高,导电导热性好二次键:强硬度低考点1:键的概念【例题1-1-1】(1)金属键:_____ 。
(大连理工大学2011,北京工业大学2016,合工大2013,厦门大学2013)(2)化学键与金属键:_____。
(哈尔滨工程大学2016)(3)辨析金属键与共价键:_____。
(南京航空航天2013)解析:(1)金属正离子与自由电子之间的相互作用所构成的金属原子间的结合键称为金属键。
(2)化学键是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。
使离子相结合或原子相结合的作用力通称为化学键。
金属键同上。
(3)异:电子公用范围不同,金属键中电子属所有原子共用,共价键中属若干原子共用。
同:成键方式为电子共用。
【练习题1-1-2】(1)主要化学键:金刚石_____;镍_____;MgO_____;聚乙烯_____;SiO2_____(四川大学2016)(2)什么是金属键?金属为什么具有良好的导电性和导热性?(山东大学2014)(3)下列对金属键描述正确的是()。
(浙工大2013)A、无方向性和饱和性B、有方向性和饱和性C、有方向性无饱和性D、无方向性有饱和性【练习题1-1-3】简述共价键的特性,并说明多原子分子体系中以杂化轨道形成的共价键与材料晶体结构的关系。
(北京工业大学2013)【练习题1-1-4】(1)共价键的特点是以原子的形式_____,具有_____性和_____性。
(郑州大学2013)(2)氢键是何种类型的键?常见于何种物质、材料之中?对材料的性能会有什么影响?(北京工业大学2014)(3)高分子材料中的化学键有哪几种?(湖南大学2013)考点2:结合键【例题1-1-5】固体材料中有几种原子结合键,哪些为一次键,哪些为二次键?(南京航空航天2013)解析:材料的许多性能在很大程度上取决于原子结合键。
根据结合力的强弱可把结合键分为两大类。
一次键:结合力较强(依靠外壳层电子转移或共享而形成稳定的电子壳层),包括离子键、共价键和金属键。
二次键:结合力较弱(依靠原子之间的偶极吸引力结合而成),包括分子键和氢键。
【练习题1-1-6】(1)原子间的结合键共有几种?各自的特点如何?(中国海洋大学2014)(2)从结合键和晶体结构上比较金刚石、石墨、石墨烯、碳纳米管、富勒烯。
(清华大学2015)【练习题1-1-7】简述一次键和二次键的本质特点,并从结合键的角度讨论金属的力学特征。
(湖南大学2012)【练习题1-1-8】(1)试从结合键的角度分析金属材料的塑性或延展性优于无机非金属材料的原因。
(湖南大学2013,西北工业大学2013)(2)比较金属材料、陶瓷材料、高分子材料和复合材料在结合键上的差别。
(华南理工大学2016)考点3:键与性能的关系【例题1-1-9】简述无机材料(陶瓷材料)可能会形成何种价键,所形成的化学键对材料的性能有什么影响?(北京工业大学2012)解析:无机(陶瓷)主要形成离子键和共价键,离子键的键能很高,导致无机材料通常具有高熔点、高强度等力学性能。
【练习题1-1-10】晶体结合键与其性能有何关系?(南京航空航天2014)【练习题1-1-11】请从结合键特点对点对金刚石与铜致密度存在的差异进行分析。
(南京理工大学2015)【练习题1-1-12】请从结合键角度,谈谈工程材料的分类和特点。
(西安交通大学2013)【练习题1-1-13】从原子键和原子结构的角度,解释为什么金属具有良好的导电性、导热性、不透明和延展性以及正的温度电阻系数。
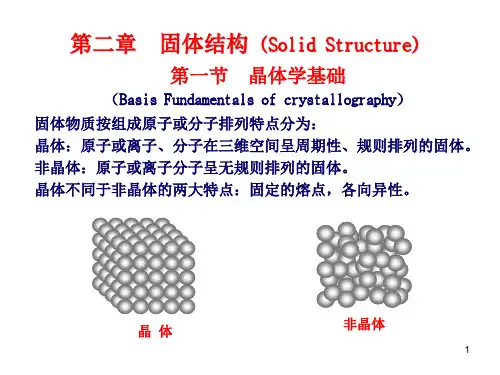
(华南理工大学2014)2、晶体与非晶体晶体:内部质点在三维空间按周期性排列的固体。
晶体与非晶体非晶体:内部质点在三维空间无规则排列的固体。
性能的主要区别:晶体非晶体熔点有无取向与性能单:多向异性各向同性多:各向同性考点1:晶体【例题1-2-1】(1)晶体是具有空间格子构造的固体()。
(南京工业大学2012)(2)晶体:_____(北京工业大学2012)(3)在宏观晶体中独立的宏观对称要素有8种()。
(南京工业大学2012)解析:(1)√ ;(2)指内部质点在三维空间按周期性排列的固体;(3)√分别是1 2 3 6 i m【练习题1-2-2】(1)晶体具有各向异性的原因_____。
(天津大学2012)(2)晶体的本质是_____。
(南京工业大学2014)(3)晶体中的旋转对称轴的轴次只能是()。
(中国科学技术大学2013)A、1、2、3、4、5、6B、1、2、3、4、6C、2、3、4、6、10【练习题1-2-3】(1)凡是能自发生长成几何多面体外形的固体必定是晶体()。
(南京工业大学2015)(2)单晶体材料在不同晶向上的物理、力学性能有比较明显的差异,称之为晶体的()。
(哈工大2013)A、各向异性B、伪各向异性C、各向同性D、伪等向性【练习题1-2-4】(1)关于晶体中间隙原子的说法,正确的是()。
(东南大学2013)A、晶体中间隙尺寸明显小于原子尺寸,所以平衡时晶体中不应该存在间隙原子B、间隙原子总是与空位成对出现C、间隙原子形成能较空位形成能大得多D、只有杂质原子才可能成为间隙原子(2)在宏观晶体中只存在有32种对称型()。
(南京工业大学2014)考点2:非晶体【例题1-2-5】非晶体_____。
(湖南大学2014,南京航空航天2012)解析:指组成固态物质的分子(原子、离子)不呈空间规则周期性排列的固体。
考点3:区别【例题1-2-6】从结构、性能等方面描述晶体与非晶体的区别。
(郑州大学2012,长安大学2015)解析:性能上:(1)晶体融化时有固定的熔点,非晶体融化时无固定的熔点,存在一个软化的温度范围。
(2)晶体有各向异性,非晶体为各向同性。
结构上:(1)晶体的原子长程有序在三维空间呈周期性重复排列,非晶体的原子呈无规则排列。
【练习题1-2-7】有序固溶体与无序固溶体的转变是指晶体与非晶体之间的转变()。
(清华大学2017)3、空间点阵与晶体结构空间点阵与晶体结构基本概念:晶体结构,空间点阵,晶胞,晶格,结构基元。
晶体结构:空间点阵+结构基元晶胞选取原则尽可能高的对称性尽可能多的直角尽可能小的体积布拉菲点阵:14种点阵分属7个晶系(立方,四方,菱方,六方,正交,单斜,三斜)晶体结构与空间点阵的区别考点1:晶体结构【例题1-3-1】(1)晶体结构的对称性决定于宏观晶体的外形()。
(南京工业大学2012)(2)化学组成不同的晶体其结构也一定不同()。
(北京工业大学2013)(3)晶体结构由_____和_____构成的。
(四川大学849 2016)解析:(1)×,晶体的对称性是由晶体的格子构造所决定。
(2)×,如NaCl、CaO化学组成不同,但是都为面心立方结构。
(3)空间点阵、结构基元。
【练习题1-3-2】(1)晶体结构与它的_____、_____和_____有关。
(南京工业大学2015)(2)分别指出两种合金A、B原子完全无序占位时的晶体结构,并说明原因。
(北京科技大学2015)【练习题1-3-3】简述晶体结构类型对其塑性变形能量和扩散特性的影响。
(南京航空航天2014)【练习题1-3-4】(1)已知Cu的点阵常数为0.3614nm,其原子量为63.5,求Cu的密度。
(南京理工大学2012)(2)假设一种金属具有体心立方晶体结构,其密度为1.24g/cm3,原子量为48.9g/mol,则该金属的原子半径为多少()。
(中国海洋大学2015)A、0.122nmB、1.22nmC、0.0997nmD、0.154nm【练习题1-3-5】金属的三种常见晶体结构中,______结构不能称为一种空间点阵。
(四川大学2011)考点2:空间点阵【例题1-3-6】(1)超点阵_____。
(北京科技大学2013)(2)空间点阵_____。
(北京科技大学2014)(3)空间点阵的特点是:(浙工大2015)A、阵点周围环境不同,在空间的位置一定。
B、阵点周围环境相同,在空间的位置一定。
C、阵点周围环境相同,在空间的位置无序。
解析:(1)具有一定比例的无序固溶体,从高温缓冷至某一临界温度以下时,溶质原子会从统计随机分布状态过渡到占有一定位置的规则排列状态,即发生有序化,形成有序固溶体,长程有序固溶体的X射线衍射图上会产生额外的附加线系,称为超结构线,因此也称为超点阵。
(2)晶体中原子或原子集团排列的周期性规律,可以用一些在空间有规律分布的几何点来表示。
这样的几何点的集合就构成空间点阵,每个几何点就叫点阵的结点。
(3)B。
【练习题1-3-7】(1)反映空间点阵的全部特征的单位六面体只有_____个,称为布拉菲点阵,这些点阵归为_____晶系。
(西安交通大学2013)(2)布拉菲点阵有_____种,分属_____个晶系。
(山东大学2013)(3)金属的3种常见晶体结构中,不能作为一种空间点阵的是哪种结构?为什么?(山东大学2016,西北工业大学2015)【练习题1-3-8】(1)含有4根3次轴的晶体,属于()。
(南京工业大学2012)A、立方晶系B、四方晶系C、六方晶系D、正交晶系(2)晶系有_____大类,空间点阵只有_____种,同一种空间点阵可以有_____种晶体结构。
(北京工业大学2015)【练习题1-3-9】(1)写出七种晶系的名称及点阵参数之间的关系_____。
(北京科技大学2012)(2)NaCl的晶体结构是否属于布拉菲点阵?为什么?如果不是,则其点阵为哪种类型?(湖南大学2012)(3)论述面心菱方点阵为何不是布拉维格子的一种。
(清华大学2012)(4)任何形式的晶体,其空间点阵都可以用十四种布拉菲点阵之一来表示。
例如底心四方点阵可以用_____来表示,面心四方点阵可以用_____来表示。
(哈尔滨工程大学2011)【练习题1-3-10】分别给出下列离子晶体的布拉菲点阵类型和下面晶胞中正、负离子的个数。
(下图中的点阵参数均为a=b=c,α=β=γ=90。
)。
(北京科技大学2011)CS Cl CsCl Zn S ZnSNa ClF Ca2Ca O3Ti【练习题1-3-11】分别画出下列离子晶体的布拉菲点阵(下图中的点阵参数均为a=b=c,。
2012)NaCl F Ca2Ca OTi。