依那西普注射液说明书
- 格式:pdf
- 大小:389.41 KB
- 文档页数:29
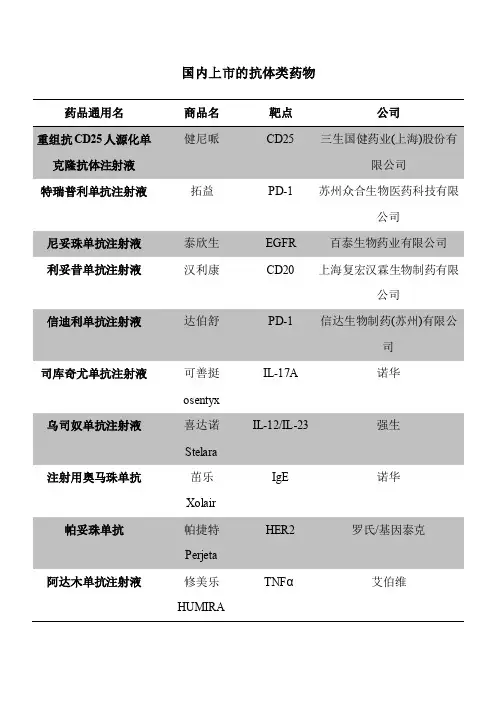
国内上市的抗体类药物药品通用名商品名靶点公司重组抗CD25人源化单克隆抗体注射液健尼哌CD25 三生国健药业(上海)股份有限公司特瑞普利单抗注射液拓益PD-1 苏州众合生物医药科技有限公司尼妥珠单抗注射液泰欣生EGFR 百泰生物药业有限公司利妥昔单抗注射液汉利康CD20 上海复宏汉霖生物制药有限公司信迪利单抗注射液达伯舒PD-1 信达生物制药(苏州)有限公司司库奇尤单抗注射液可善挺osentyxIL-17A 诺华乌司奴单抗注射液喜达诺StelaraIL-12/IL-23 强生注射用奥马珠单抗茁乐XolairIgE 诺华帕妥珠单抗帕捷特PerjetaHER2 罗氏/基因泰克阿达木单抗注射液修美乐HUMIRATNFα艾伯维艾美赛珠单抗注射液舒友立乐HEMLIBRAFIX/FX 罗氏阿柏西普眼内注射溶液艾力雅Eylea(VEGF 拜耳依库珠单抗注射液舒立瑞Soliris补体C5 Alexion Europe SAS依洛尤单抗注射液Evolocumab瑞百安PCSK9 安进帕博利珠单抗可瑞达KeytrudaPD-1 默沙东曲妥珠单抗赫赛汀HerceptinHER2 罗氏/基因泰克纳武利尤单抗欧狄沃OPDIVOPD-1 百时美施贵宝依达赛珠单抗注射液泰毕安PraxbindPraxbind 勃林格殷格翰依那西普注射液恩利EnbrelTNF 辉瑞利妥昔单抗美罗华MabTheraCD20 罗氏/基因泰克贝伐珠单抗安维汀AvastinVEGF-A 罗氏/基因泰克注射用英夫利西单抗类克TNF-α强生RemicadeIL-6R 罗氏托珠单抗注射液雅美罗ActemraCD25 诺华注射用巴利昔单抗舒莱SimulectVEGF 诺华雷珠单抗注射液诺适得LucentisTNF-α强生戈利木单抗注射液欣普尼SimponiEGFR 默克西妥昔单抗爱必妥Erbitux。

依替米星注射液说明书标题:依替米星注射液说明书一、药品名称依替米星注射液二、成分每毫升依替米星注射液含有依替米星5毫克。
三、性状本品为无色透明液体。
四、注意事项1. 依替米星注射液仅供医院内使用,由专业医务人员进行注射。
2. 注射前必须由医生评估患者的病情和用药历史,确保合适的使用剂量。
3. 对本品过敏者禁用,同时对亚胺类药物过敏者慎用。
4. 临床使用过程中如出现药物不良反应,请立即停用,并告知医生或药品生产商。
5. 孕妇、哺乳期妇女和儿童慎用。
五、药理作用依替米星为一种抗生素,通过抑制细胞壁合成酶的活性,破坏细菌的细胞壁,从而导致细菌死亡。
六、适应症本品适用于敏感菌引起的感染,包括但不限于肺炎、骨关节感染和泌尿道感染。
七、用法和用量1. 依替米星注射液应由医生根据患者的病情和体重确定剂量和使用频率。
2. 常用剂量为每日2次,每次5毫克/公斤体重,静脉滴注,每次不超过60分钟。
3. 疗程一般为7-14天,具体治疗时长应根据病情严重程度和临床判断进行调整。
八、不良反应1. 常见的不良反应包括恶心、呕吐、腹泻和皮疹等。
2. 严重的不良反应如过敏反应、肝功能损害等少见,如遇到此类情况,请立即停止使用并告知医生。
九、禁忌症1. 本品对依替米星过敏者禁用。
2. 对亚胺类抗生素过敏者慎用。
十、药物相互作用1. 与本品合并使用的其他药物可能产生相互作用,请在使用前告知医生您正在使用的其他药物,以便进行调整。
2. 本品与肌松药物同时使用可能增加肌松效应。
十一、贮藏1. 请将本品存放在阴凉干燥处,避免阳光直射和高温。
2. 请将本品置于儿童无法触及的地方。
十二、生产企业本品由XXX公司生产。
十三、有效期本品有效期为XX年XX月。
本说明书仅为依替米星注射液的简要说明,具体用药请遵循医生的指导。
如有任何疑问,请咨询医生或药品生产商。

【药品名称】通用名称:注射用泰它西普商品名称:泰爱英文名称:T elitacicept for Injection汉语拼音:Zhusheyong Taitaxipu【成份】活性成份:泰它西普(重组人B淋巴细胞刺激因子受体-抗体融合蛋白)辅料:盐酸组氨酸、盐酸精氨酸、甘露醇、蔗糖、氢氧化钠【性状】本品应为白色至淡黄色疏松体,复溶后为无色至淡黄色、澄明液体。
【适应症】本品与常规治疗联合,适用于在常规治疗基础上仍具有高疾病活动(例如:抗ds-DNA抗体阳性及低补体、SELENA-SLEDAI评分≥8)的活动性、自身抗体阳性的系统性红斑狼疮(SLE)成年患者。
该适应症是基于一项接受常规治疗仍具有高疾病活动的系统性红斑狼疮成年患者的Ⅱ期临床试验结果给予的附条件批准。
本适应症的完全批准将取决于确证性随机对照临床试验能否证实本品在该患者人群的临床获益。
【规格】80 mg/支。
【用法用量】本品需要在有诊断和治疗系统性红斑狼疮经验的医生指导下使用。
给药方法本品采用皮下注射给药。
注射部位为腹部。
本品为冻干粉,将本品每支(80 mg)用1 ml灭菌注射用水复溶,复溶溶液浓度为每ml含80 mg泰它西普。
复溶时应将灭菌注射用水的水流朝向药瓶的一侧,沿瓶壁缓慢加入,以尽量减少泡沫形成。
复溶期间,将药瓶置于室温条件下,缓慢旋转约60秒,静置至泡沫消退。
切勿摇晃。
待药物溶解后,再次轻轻旋转,药液将会完全混匀。
通常在加入灭菌注射用水后15分钟内完成复溶,但也可能长达30分钟。
复溶后药液为无色至淡黄色、澄明液体。
如观察到可见颗粒,应弃用。
药物溶解后溶液如有小空气泡,不影响使用,但在抽取至无菌注射器后应排除气泡。
本品从复溶到完成皮下注射的总时间不应超过4小时。
剂量本品推荐使用剂量为160 mg/次,每周给药一次。
本品给药期间,经临床医生充分评估患者使用本品的安全耐受性后决定是否需要下调剂量。
如需下调剂量可将每次给药剂量下调为80 mg/次。

依奇珠单抗注射液Ixekizumab详细说明书与重点一、药品概述依奇珠单抗注射液(Ixekizumab)是一种针对中重度斑块状银屑病和活动性银屑病关节炎的创新生物制剂。
本药品通过靶向抑制白介素17A(IL17A)的作用,有效缓解银屑病症状,提高患者生活质量。
二、成分及作用机制依奇珠单抗注射液主要成分为人源化单克隆抗体,能特异性结合IL17A,阻止其与受体结合,从而降低炎症反应。
IL17A是一种关键炎症因子,参与银屑病等疾病的发病过程。
三、适应症1. 中重度斑块状银屑病;2. 活动性银屑病关节炎。
四、用法用量依奇珠单抗注射液通过皮下注射给药。
具体用药方案如下:1. 成人患者(体重≥50kg):首次剂量为160mg,之后每两周注射一次80mg,或每月注射一次240mg;2. 成人患者(体重<50kg):首次剂量为80mg,之后每两周注射一次40mg,或每月注射一次160mg。
请在专业医生指导下进行用药,并根据病情调整剂量。
五、不良反应1. 常见不良反应:上呼吸道感染、注射部位反应、真菌感染等;2. 少见不良反应:关节痛、皮肤瘙痒、结膜炎等;3. 极少数患者可能出现过敏反应,如皮疹、呼吸困难等。
六、禁忌症1. 对本品活性成分或辅料过敏的患者;2. 患有严重感染的患者;3. 孕妇及哺乳期妇女。
请务必在医生指导下使用本药品,以确保用药安全。
七、注意事项1. 治疗期间,请密切关注身体状况,如出现感染症状,应及时告知医生。
2. 本药品可能会增加结核病的风险,请在用药前进行结核筛查。
3. 对于患有慢性或复发性感染、免疫抑制状态或免疫系统疾病的患者,使用本药品需谨慎。
4. 老年患者使用本药品时,无需调整剂量,但需注意身体状况的变化。
5. 驾驶或操作重型机械的患者在使用本药品后,若出现头晕、疲劳等不适,请避免进行这些活动。
八、药物相互作用1. 活疫苗:使用本药品期间,应避免接种活疫苗。
2. 免疫抑制剂或生物制剂:与其他免疫抑制剂或生物制剂同时使用可能会增加感染风险,请咨询医生。

核准日期:修改日期:依马利尤单抗注射液说明书本品为附条件批准上市,请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:依马利尤单抗注射液商品名称:伽蜜芬®/Gamifant®英文名称:Emapalumab Injection汉语拼音:Yimaliyou Dankang Zhusheye【成份】活性成份:依马利尤单抗依马利尤单抗是一种高亲和力全人源化IgG1 λ2型单克隆抗体,与可溶性和受体结合型的IFNγ结合,中和其生物活性。
辅料:L-组氨酸、L-组氨酸盐酸盐一水合物、氯化钠、聚山梨酯80。
【性状】澄清至微浊、无色至微黄色溶液。
【适应症】本品适用于难治性、复发性或进展性、或对常规疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)成人和儿童(新生儿及以上)患者。
本品基于境外数据获得附条件批准上市,治疗中国患者的有效性和安全性尚待上市后进一步确证。
【规格】10 mg(2 ml)/瓶。
【用法用量】安全性评估监测在开始本品治疗之前在开始本品治疗之前,通过结核菌素皮肤试验(PPD)或IFNγ释放试验进行潜伏结核感染检测,并评估患者罹患结核的危险因素。
对存在罹患结核风险或已知PPD试验结果呈阳性或IFNγ释放试验结果阳性的患者进行预防性抗结核治疗。
本品治疗期间每2周监测一次结核、腺病毒、EBV和CMV,并根据临床指征进行监测。
预防治疗及合并用药治疗前预防治疗在本品给药前,应进行带状疱疹、耶氏肺孢子虫和真菌感染预防性治疗。
治疗期间合并用药对于基线未接受地塞米松治疗的患者,在本品治疗的前一天开始给予地塞米松,日剂量至少5至10 mg/m2。
对于基线正在接受地塞米松治疗的患者,可以继续常规剂量治疗(日剂量至少为5 mg/m2)。
可以根据临床医师的评估对地塞米松进行逐渐减量(见【临床试验】)。
推荐剂量本品推荐起始剂量为1 mg/kg,静脉输注,每周2次(每3至4天一次),每次输注时间需大于1小时。
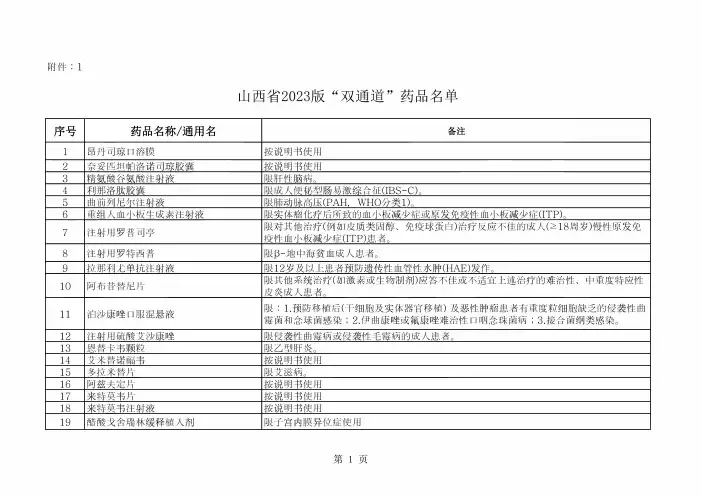
附件:1山西省2023版“双通道”药品名单序号药品名称/通用名备注1昂丹司琼口溶膜按说明书使用2奈妥匹坦帕洛诺司琼胶囊按说明书使用3精氨酸谷氨酸注射液限肝性脑病。
4利那洛肽胶囊限成人便秘型肠易激综合征(IBS-C)O5曲前列尼尔注射液限肺动脉高压(PAH,WHO分类1)。
6重组人血小板生成素注射液限实体瘤化疗后所致的血小板减少症或原发免疫性血小板减少症(ITP)O7注射用罗普司亭限对其他治疗(例如皮质类固醇、免疫球蛋白)治疗反应不佳的成人(218周岁)慢性原发免疫性血小板减少症(ITP)患者。
8注射用罗特西普限P-地中海贫血成人患者。
9拉那利尤单抗注射液限12岁及以上患者预防遗传性血管性水肿(HAE)发作。
10阿布昔替尼片限其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
11泊沙康哩口服混悬液限:1.预防移植后(干细胞及实体器官移植)及恶性肿瘤患者有重度粒细胞缺乏的侵袭性曲霉菌和念球菌感染;2.伊曲康哩或氟康哩难治性口咽念珠菌病;3.接合菌纲类感染。
12注射用硫酸艾沙康哩限侵袭性曲霉病或侵袭性毛霉病的成人患者。
13恩替卡韦颗粒限乙型肝炎。
14艾米替诺福韦按说明书使用15多拉米替片限艾滋病。
16阿兹夫定片按说明书使用17来特莫韦片按说明书使用18来特莫韦注射液按说明书使用19醋酸戈舍瑞林缓释植入剂限子宫内膜异位症使用20盐酸美金刚口溶膜按说明书使用21美泊利珠单抗注射液按说明书使用22环抱素滴眼液(in)限4岁及以上儿童和青少年的严重性春季角结膜炎。
23托伐普坦片按说明书使用24注射用多黏菌素E 甲磺酸钠按说明书使用25泊沙康哩肠溶片限13岁和13岁以上重度免疫缺陷患者。
26泊沙康哩注射液限18岁和18岁以上重度免疫缺陷患者。
27枸椽酸托法替布缓释片按说明书使用28普瑞巴林口服溶液按说明书使用29注射用两性霉素B 胆固醇硫酸酯复合物限患有深部真菌感染的患者;因肾损伤或药物毒性而不能使用有效剂量的两性霉素B 的患 者,或已经接受过两性霉素B 治疗无效的患者均可使用。

依替巴肽注射液(依非巴特注射液) Eptifibatide 英文名称: Eptifibatide Injection。
【成分】本品主要成份为本品主要成份为依替巴肽。
化学名称:N6-(氨基亚氨基甲基)-N2-(3-巯基丙酰基)-L-赖氨酰-甘氨酰-L-α-门冬氨酰-L-色氨酰-L-脯氨酰-L-半胱氨酸氨,环(1 6)-二硫化物。
分子式:C35H49N11O9S2,分子量:831.96。
【性状】本品为无色的澄明液体。
【适应症】用于急性冠状动脉综合征(不稳定型心绞痛/非ST段抬高性心肌梗死)患者,包括接受药物治疗的患者和进行经皮冠状动脉介入术(PCI)的患者,以降低死亡或新发生心肌梗死的联合终点发生率。
用于进行经皮冠状动脉介入术(PCI)的患者,包括进行冠状动脉内支架置入术的患者。
以降低死亡、新发生心肌梗死或需要紧急介入治疗的联合终点发生率。
【规格】10ml∶20mg【用法用量】使用依替巴肽前,应通过以下实验室检测确定是否存在止血异常:红细胞压积或血红蛋白、血小板计数、血清肌酐、凝血酶原时间(PT)/部分凝血活酶时间(aPTT)。
接受PCI的患者还需测定活化凝血时间(ACT)。
如果不进行PCI,aPTT应维持在50~70秒。
在应用肝素治疗的患者,通过严密监测aPTT和ACT 可使出血的可能性降至最低。
1.急性冠状动脉综合征(ACS)的用药剂量∶接受依替巴肽治疗应按以下参数同时给予肝素:药物治疗期间:aPTT目标值50~70秒。
PCI期间:ACT目标值200~300秒。
•若在PCI术前开始给予肝素,则术中应另外给予肝素,将ACT控制在200~300秒。
•PCI术后不建议使用肝素。
2.经皮冠状动脉介入术(PCI):•应同时给予肝素治疗,使ACT维持在目标值200~300秒。
PCI手术前6小时未用肝素治疗的患者,先给予肝素静脉推注。
•在PCI术期间,为了维持ACT目标值,应加用适量肝素静脉推注。
手术中另外给予一定剂量的肝素,以维持ACT水平(200~300秒)。

来源快易捷医药网【说明书修订日期】核准日期:2006年12月18日【药品名称】依达拉奉注射液【商品名】必存【英文名】Edaravone Injection【汉语拼音】Yidalafeng Zhusheye【成份】本品主要成份为依达拉奉。
化学名称: 3-甲基-l-苯基-2-吡唑啉-5-酮(3-methyl-1-phenyl-2-pyrazolin-5-one)化学结构式:分子式:C10H10N2O分子量:174.20辅料:丙二醇【性状】本品为无色或几乎无色的澄明液体。
【适应症】用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。
【规格】(1)5ml:10mg (2)20ml:30mg【用法用量】一次30mg,每日2次,加入适量生理盐水中稀释后静脉滴注.30分钟内滴完,一个疗程为14天以内。
尽可能在发病后24小时内开始给药。
【不良反应】据日本临床病例569例观察,26例(4.57%)出现不良反应。
主要表现为肝功能异常16例(2.81%),皮疹4例(0.70%)。
569例中临床检测值异常变化的有l22例(21.4%),主要是AST 上升7.71%(43/558)、ALT上升8.23%(46/559)等肝功能检测值异常。
严重不良反应有:1、急性肾功能衰竭(程度不明)用药过程中进行多次肾功能检测并密切观察,出现肾功能低下表现或少尿等症状时,停止用药并正确处理。
2、肝功能异常、黄疸(均程度不明)伴有AST、ALT、ALP、γ-GT、LDH上升等肝功能异常和黄疸,用药过程中需检测肝功能并密切观察,出现异常情况,停止用药并正确处理。
3、血小板减少(程度不明)有血小板减少表现,用药过程中需密切观察,出现异常情况,停止给药并正确处理。
4、弥漫性血管内凝血(DIC)(程度不明)可出现弥漫性血管内凝血的表现,用药过程中定期检测。
出现疑为弥漫性血管内凝血的实验室表现和临床症状时,停止给药并进行正确处理。
其他不良反应(发生率)及主要表现为:1、过敏症(0.1~5%):主要表现为皮疹、潮红、肿胀、疱疹、搔痒感。

诺西那生钠注射液Nusinersen汉语拼音:Nuo Xi Na Sheng Na Zhu She Ye【警示语】【成份】本品活性成份为诺西那生钠。
分子式:C234H323N61O128P17S17Na17分子量:7501.0辅料列表:磷酸二氢钠二水合物, 无水磷酸氢二钠, 氯化钠, 氯化钾, 氯化钙, 氯化镁, 氢氧化钠, 盐酸, 注射用水【性状】本品为无色澄明液体。
【适应症】用于治疗5q脊髓性肌萎缩症(SMA)。
【规格】5ml:12mg(按诺西那生计)【用法用量】本品只能由具有脊髓性肌萎缩症(SMA)治疗经验的医生开具处方。
应根据个体患者治疗预期获益的个体化专家评估,并权衡本品治疗的潜在风险后做出治疗决策。
出生时出现严重的肌张力减退和呼吸衰竭的患者(尚未对此类患者进行研究),由于重度SMN蛋白质缺乏可能无法获得具有临床意义的获益。
剂量:推荐剂量为每次12mg(5ml)。
诊断后应尽早开始本品治疗,于第0天、第14天、第28天和第63天给予4次负荷剂量,此后每4个月给予一次维持剂量。
疗程:尚未获得关于本品长期疗效的数据。
应定期评估患者的临床表现和治疗应答,根据患者个体的具体情况决定是否需要继续治疗。
漏用或延迟给药:如果负荷剂量延迟或漏用,应尽快给予本品,两次给药间隔至少14天,并按规定的频率继续给药。
如果维持剂量延迟或漏用,应尽快给予本品,并继续每4个月一次给药。
给药方法:经腰椎穿刺鞘内给药,治疗应由具有腰椎穿刺经验的医疗专业人员进行。
使用脊髓穿刺针,鞘内推注本品,持续1-3分钟,存在皮肤感染或炎症区域不能注射本品。
建议在给药前引流与注射药物相同体积的脑脊液(CSF)。
根据患者的临床状况,给予本品时可能需要镇静。
可考虑使用超声(或其他成像技术)引导鞘内给药,特别是对于年龄较小的患者和脊柱侧凸患者。
制备和给予本品时应采用无菌技术。
药品配制: 1.给药前,应检查诺西那生钠小瓶中是否存在颗粒物。
如果观察到颗粒物和/或小瓶中的液体不是无色澄明的,不得使用该小瓶药品。

注射用依前列醇钠Epoprostenol 【适应症】
主要用于治疗某些心血管疾病(如心肺分流术、血液透析等)时作为抗血小板药以防止高凝状态。
也用于严重外周血管性疾病(如雷诺病)、缺血性心脏病、原发性肺动脉高压和血小板消耗性疾病等。
【规格】
注射用依前列醇钠:每支500β8(附甘氨酸缓冲液50ml)。
【用法用量】
静滴,每分钟5mg/kg,临用时配制,连续滴注时间根据病情而定。
【注意事项】
常见的不良反应有低血压、心率加速、面部潮红、头痛等,其发生率随剂量加大而增多。
也可有胃痉挛、恶心、呕吐、胃部不适、血糖升高、嗜睡、胸痛等。
【药理毒理】
本品具有抗血小板和舒张血管作用,故可防止血栓形成。
前者的作用机制可能在于激活腺苷酸环化酶,而使血小板内cAMP浓度上升所致。
本品性质不稳定,在体内迅速分解为6-酮-PGF1αt为2-3分钟,其代谢物较稳定,但生物活性极弱。
【妊娠分级】
FDA妊娠分级:B。
可善挺说明书药品名称:可善挺(司库奇尤单抗注射液)性状:无色透明液体适应症:COSENTYXTM是适用为中度至严重斑块性银屑病,为全身治疗或光治疗被选者成年患者的治疗。
用法用量:1. 推荐剂量推荐剂量是300 mg,通过皮下注射在0,1,2,3,和4周接着300 mg每4周。
每300 mg剂量是作为2次150 mg 皮下注射给予。
对有些患者,150 mg的剂量可能被接受。
2. 重要给药指导对COSENTYX有三种表现(即,Sensoready笔,预装注射器,和为重建在小瓶中冰冻干燥粉)。
C OSENTYX “为使用指导”对COSENTYX每种表现对制备和给药都包含更详细指导[见使用指导]。
COSENTYX是意向为在医生指导和监督下使用。
适当训练利用Sensoready笔或预装注射器皮下注射技术后和当认为适当的时候患者可能自我注射。
为重建冰冻干燥粉是只为卫生保健提供者使用。
每次注射在以前注射与一个不同解剖位置给予(例如上臂,腿或腹部任何四分之一象限),和不要主任区域皮肤是脆弱,瘀伤,红斑,有硬结或受银屑病侵犯。
COSENTYX在上,外侧臂给予可能由看护或卫生保健提供者进行。
3. 为使用COSENTYX Sensoready®笔和预装注射器制备注射前,从冰箱取出COSENTYX Sensoready笔或COSENTYX预装注射器和允许COSENTYX达到(15 to 30分钟)没有去掉针帽。
COSENTYX Sensoready笔和COSENTYX预装注射器含天然橡胶乳胶可移去帽和不应被对乳胶敏感个体处置[见警告和注意事项]。
给药前肉眼观察COSENTYX有无颗粒物质和变色。
COSENTYX注射液是清澈至略微不透明,无色至略微黄溶液。
如液体含肯件颗粒,是变色或云雾状不要使用。
COSENTYX不含防腐剂,因此,Sensoready笔或预装注射器在从冰箱取出后在1小时内给药。
遗弃保留在Sensoready笔或预装注射器内任何未使用产品。
核准日期:2009年8月12日修改日期:依诺肝素钠注射液说明书请仔细阅读说明书并在医师指导下使用警示语:椎管内血肿。
当实施椎管内麻醉(脊麻和硬膜外麻醉)或椎管穿刺时应注意,使用低分子肝素或肝素类物质预防血栓并发症的病人,有可能引起椎管内血肿,导致长期甚至永久性瘫痪,以上事件很少发生。
放置硬膜外导管或反复硬膜外穿刺,合并使用影响止血功能的药物,如非甾体类抗炎药(NSAIDs)、血小板抑制剂或其它抗凝药物等,血肿发生率可能会更高。
此种情况,应监测病人神经损害的症状和体征,如发现有可能损伤神经,应紧急处理。
医生在对此类病人实施椎管内干预(麻醉或穿刺)时,应进行利弊权衡。
【药品名称】通用名称:依诺肝素钠注射液商品名称:克赛®Clexane英文名称:Enoxaparin Sodium Injection汉语拼音:Yinuogansuna Zhusheye【成份】化学名称:依诺肝素钠(低分子肝素钠)化学结构式:分子量:3500至5500道尔顿辅料:注射用水【性状】本品为无色或淡黄色的澄明液体。
【适应症】2000 Axa IU 和4000 Axa IU注射液:• 预防静脉血栓栓塞性疾病(预防静脉内血栓形成) ,特别是与骨科或普外手术有关的血栓形成。
6000 Axa IU, 8000 Axa IU 和10000 Axa IU注射液:•治疗已形成的深静脉栓塞,伴或不伴有肺栓塞,临床症状不严重,不包括需要外科手术或溶栓剂治疗的肺栓塞。
• 治疗不稳定性心绞痛及非Q波心肌梗死,与阿司匹林合用。
• 用于血液透析体外循环中,防止血栓形成。
•治疗急性ST段抬高型心肌梗死,与溶栓剂联用或同时与经皮冠状动脉介入治疗(PCI)联用。
【规格】(1)0.2ml :2000 AxaIU (2)0.4ml: 4000 AxaIU (3)0.6ml: 6000 AxaIU(4)0.8ml :8000 AxaIU (5)1.0ml :10000 AxaIU【用法用量】预防静脉血栓栓塞性疾病,治疗深静脉栓塞,治疗不稳定性心绞痛及非Q波心肌梗死时应采用深部皮下注射给予依诺肝素;血液透析体外循环时为血管内途径给药;对于ST段抬高型急性心肌梗死,初始的治疗为静脉注射,随后改为皮下注射治疗。
辽宁省医疗保障局、辽宁省卫生健康委关于持续做好国家医保谈判药品落地工作的通知文章属性•【制定机关】辽宁省医疗保障局•【公布日期】2021.12.28•【字号】辽医保发〔2021〕16号•【施行日期】2021.12.28•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医疗管理正文辽宁省医疗保障局、辽宁省卫生健康委关于持续做好国家医保谈判药品落地工作的通知辽医保发〔2021〕16号各市医疗保障局、卫生健康委,省属各医疗机构:为确保国家医保谈判药品(以下简称“谈判药品”)落地实施,按照《国家医保局国家卫生健康委关于建立完善国家医保谈判药品“双通道”管理机制的指导意见》(医保发〔2021〕28号)、《国家医疗保障局国家卫生健康委关于适应国家医保谈判常态化持续做好谈判药品落地工作的通知》(医保函〔2021〕182号)和《国家医保局办公室关于加快2021年国家医保谈判药品落地的紧急通知》等要求,切实打通国家医保目录调整“最后一公里”,确保2022年1月1日起参保患者能享受新版目录药品特别是新增谈判药品的医保待遇,现就有关事项通知如下:一、规范实施谈判药品分类管理综合考虑临床价值、患者合理的用药需求等因素,按照“确保能报销、基金可承受、兼顾同类公平”的原则,对谈判药品继续实施分类管理,将谈判药品分为高值药品和按常规乙类管理的药品,统一制定我省按高值药品管理目录,其中,部分高值药品限门诊使用时单独据实结算,住院使用时沿用各统筹区现行住院付费方式。
经专家论证,将2021年国家医保药品目录中的注射用维得利珠单抗等117种药品(附件序号1-117)确定为按高值管理药品,其中,麦格司他胶囊等34种药品(附件序号84-117)限门诊应用时单独据实结算。
为进一步减轻参保患者用药负担,将高值药品的个人先行自付比例由30%调至20%,全省统一确定高值药品门诊和住院费用政策范围内报销比例,职工医保为80%,居民医保为70%,限门诊使用时单独据实结算的高值药品,住院使用时也按上述政策计算个人待遇。