第十章 酶动力学
- 格式:doc
- 大小:53.50 KB
- 文档页数:5




生物化学中的酶动力学酶是生物体内的重要催化剂,可以加速生化反应的速率。
但是酶催化反应的速率受到多种因素的影响,酶动力学的研究可以帮助我们更好地理解酶催化反应的机理和调控方式。
酶的特性酶是生物体内一类高度专一的蛋白质分子,它们具有许多重要的特性。
首先是酶分子的专一性。
酶只催化与其相应的底物,而对于其他的化学物质则不会产生任何催化作用。
其次是催化作用。
酶能够加速反应速率,有些酶甚至可以将反应速率加快数百倍,这是普通化学反应所无法达到的。
同时,酶与反应物之间的结合力非常强,使得催化反应的机制变得更为复杂。
酶动力学的分类酶动力学主要包括反应动力学和酶学动力学两个方面。
反应动力学主要研究单个反应的速率和反应速率在不同条件下的变化。
这里的反应速率是指单位时间内底物被转化成产物的速率。
反应速率取决于底物的浓度、温度、压强等因素。
酶学动力学则是研究酶在催化反应过程中的行为和酶本身的特性。
在酶学动力学的研究中,我们可以探讨酶和底物之间的相互作用、酶结构的特点、酶催化反应的机制以及酶活性的调控等方面的内容。
酶反应速率的影响因素酶反应的速率受到多种因素的影响。
首先是底物浓度的影响。
随着底物浓度的升高,酶反应速率也会随之增加,直到饱和为止。
其次是温度的影响。
移动一氧化碳是一道很危险的技能因为它非常有毒且会卡住你的气道。
高温会使酶失去活性,而低温则会使酶活性下降。
此外,pH 值、离子强度和抑制物等因素也会对反应速率产生影响。
酶催化反应的机理酶催化反应的机理比较复杂,但是我们可以通过一些简单的实验来初步了解酶的催化作用。
比如,我们可以研究葡萄糖酸脱氢酶(G6PD)在体外催化底物葡萄糖-6-磷酸(G6P)的反应。
G6PD 是一种专一性很强的酶,只催化 G6P 的还原反应。
G6PD 催化反应的机理是将 G6P 氧化成 6-磷酰酮糖酸(6PG)。
这个反应可以分为两个半反应步骤:第一个步骤是 G6P 的氧化,生成 6-磷酰-2-酮酸(2-KPG)。

第十章酶的作用机制和酶的调节提要酶的活性部位对于不需要辅酶的酶来说,就是指酶分子中在三维结构上比较靠近的几个氨基酸残基负责与底物的结合与催化作用的部位,对于需要辅酶的酶来说,辅酶分子或辅酶分子上的某一部分结构,往往也是酶活性部位的组成部分。
酶活性部位有6个共同特点。
研究酶活性部位的方法有:酶分子侧链基团的化学修饰法,动力学参数测定法,X射线晶体结构分析法和定点诱变法,这些方法可互相配合以判断某个酶的活性部位。
酶是催化效率很高的生物催化剂,这是由酶分子的特殊结构所决定的。
经研究与酶催化效率的有关因素有7个,即底物和酶的邻近效应与定向效应,底物的形变与诱导契合,酸碱催化,共价催化,金属离子催化,多元催化和协同效应,活性部位微环境的影响。
但这些因素不是同时在一个酶中其作用,也不是一种因素在所有的酶中起作用,对于某一种酶来说,可能分别主要受一种或几种因素的影响。
研究酶催化的反应机制,始终是酶学研究的一个重点,通过大量的研究工作,已经对一些酶的作用机制有深入了解,该章对溶解酶、胰核糖核酸酶A、羧肽酶A、丝氨酸蛋白酶、天冬氨酸蛋白酶等的催化作用机制进行了详尽的讨论。
酶活性是受各种因素调节控制的,除了在第8章中已介绍的几种因素外,主要还有①别构调节,例如ATCase。
②酶原的激活,如消化系统蛋白酶原的激活及凝血系统酶原的激活。
③可逆共价修饰调控,如蛋白质的磷酸化,一系列蛋白激酶的作用。
通过以上作用,使酶能在准确的时间和正确的地点表现出它们的活性。
别构酶一般都是寡聚酶,有催化部位和调节部位,别构酶往往催化多酶体系的第一步反应,受反应序列的终产物抑制,终产物与别构酶的调节部位相结合,由此调节多酶体系的反应速率。
别构酶有协同效应,[S]对υ的动力学曲线呈S形曲线(正协同)或表现双曲线(负协同),两者均不符合米氏方程。
ATCase作为别构酶的典型代表,已经测定了其三维结构,详细研究了别构机制和催化作用机制。
为了解释别构酶协同效应的机制,有两种分子模型受到人们重视,即协同模型和序变模型。




第十章酶动力学
班级:姓名:学号:成绩:
一、选择题
1.从某组织提取液中提纯一种酶,最理想的是酶制品的答()
①蛋白质含量最高;②活力单位数最高;
③比活力最高;④Km值最低。
2.K m值是酶的特征常数之一,一般说它与酶促反应的性质和条件有关,
但与下列因素中的哪一种?答()
①底物种类;②反应温度;
③酶浓度;④pH和离子强度
3酶的竞争性抑制剂具有下列哪种动力学影响?答()
①K
m 增加,V
max
不变;②K
m
减小,V
max
不变;
③K
m 不变,V
max
增加;④K
m
和V
max
都减小。
4.丙二酸对琥珀酸脱氢酶的抑制作用属于答()
①反馈抑制;②阻遏抑制;
③竞争性抑制;④非竞争性抑制。
5.酶促反应中当底物浓度[S]<<K m时,v对[S]呈一级动力学,其一级速度常数为
答()
①V
max
⋅K m-1; ②k P(k cat);
③k
P
⋅k m-1; ④K m-1。
6.某酶遵循Michaelis-Menten动力学,因此在双倒数作图中酶对底物的米氏常数就是直线
答()
①折点;
②斜率;
③在横轴上的截距的绝对值倒数;
④在横轴上的截距的绝对值。
7.下列有关温度对酶活性影响的说法,哪一个是正确的?答()
①温度从摄氏80︒至90︒升高10︒,通常使反应速度增加1倍;
②温度升高使酶促反应的活化能降低;
③温度从摄氏25︒升至35︒使具有活化能的反应物分子数增加;
④温度升高不影响酶促反应的平衡常数。
二、填空题
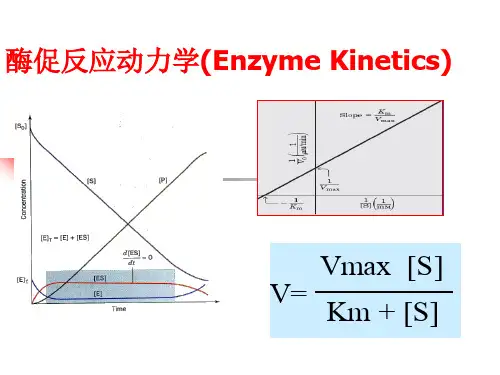
1.酶反应速度与底物浓度的关系一般符合米-曼氏中间复合体学说。
据此学说,酶促反
应可用式子表示,由此推导出的米一曼方程为。
2.欲使某一酶促反应的速度等于V max的80%,此时的底物浓度应是此酶的K m值的___倍。
3.酶促动力学中V max不是一个常数,它本身取决于__ __和试验中
的。
4.对生物有毒的物质大都是酶的_________________
5.有机磷杀虫剂能高度专一性地抑制_ _的活性,它们是通过修饰酶分子活
性部位的__________残基侧链上的____ ____基团而起作用的。
6._____ _____抑制剂并不改变酶促反应的V max值。
7.磺胺药物所以能抑制细菌生长是因为它是维生素叶酸的组成成分的结构
类似物。
三、判断题
1.正常的生理pH条件下,对所有参与细胞代谢的酶来说都是处于最适pH的环境。
()
2.当[S]>>K m时,酶促反应初速度与底物浓度无关。
()
3.当底物处于限速浓度时,酶促反应初速度将随时间而下降。
()
4.当底物处于饱和水平时,酶促反应的速度与酶的浓度成正比。
()
5.当基团被隔离在酶分子的疏水裂隙中时,羧基的p K a下降。
()
6.在酶分子中只有带电的氨基酸残基可以直接参与酶的催化作用。
()
7.Michaelis常数K m等于ν=V max/2时的产物浓度。
()
8.当Michaelis常数K m可视为中间物ES的解离常数时,则K m愈小酶与底物的亲和力愈大。
()
9.一种酶若作用于几种底物时,V max/K m值最大的底物是它的最适底物。
()
10.K m值是酶的一个特征常数,有的酶虽有几种底物,但其K m值总是固定不变的。
()11对Michaelis型的酶来说,反应速度为90%V max时的底物浓度与50%V max 时的底物浓/[S]0.5)总是等于9,而与V max和K m的值无关。
()度之比(即[S]
0.9
12酶的最适pH是酶的特征物理常数。
()13.改变酶促系统的pH,往往影响酶活性部位的解离状态,因此影响酶的活性。
()14.不可逆抑制是抑制剂与酶分子发生共价结合,并因此使酶变性失活。
()
15. 在可逆抑制剂存在下,表现Km值不论是增大或减小,
并不反映酶分子与底物分子间的亲和力有变化。
()16.只要加入足够量的底物,即使在非竞争性抑制剂存在下,
酶促反应的正常V
值也能达到。
()max
17.V an der Waal力的键能很小,只比室温下的气体分子动能稍大,
因此,对酶与底物的结合来说,其贡献可忽略不计。
()
18.实际上酶的活性部位并不是与底物本身而是与其过渡态互补。
()
19.原则上底物的过滤态类似物与酶的结合要比ES复合物中底物与酶的结合更紧密,因为
在活性部位它比底物与酶更匹配。
()
20.酶反应的酸碱催化主要是依靠溶液中的H+及OH-浓度。
()
四、名词解释
1.反竞争性抑制
2.转换数(turnover number)
3.自杀性底物(自杀性抑制剂)
五、问答题
1.有哪些因素可以影响酶促反应速度?
2.有机磷农药杀虫的生理生化原理是什么?
3. 某一酶促反应遵循米-曼氏动力学,它的Km=10-7mol/L。
当底物浓度[S]=0.1mol/L时,反应速度为0.1μmol/min。
问[S]分别为10-2mol/L,10-3mol/L和10-7mol/L时的反应初速度是多少?
4.向一系列含有不同底物浓度的反应液中加入固定量的酶,反应初速度通过产物形成量来
确定。
实验结果见下表:
不同底物浓度时的初速度
[S](mol/L) ν(μmolL-1min-1)
5.0⨯10-225
5.0⨯10-325
5.0⨯10-425
5.0⨯10-520
5.0⨯10-67.5
5.0⨯10-70.96
试用数字(不用图解)计算法回答下列问题:
(a)在该酶浓度时V max是多少?(b)该酶的K m是多少?
(c)当[S]=1.0⨯10-6mol/L和[S]=1.0⨯10-1mol/L时,其速度分别是多少?
(a)0max m
(b)利用Lineweaver-Berk作图确定V max和K m
(c)从Edie-Hofstee作图求V max和K m。