高一化学硝酸和硫酸
- 格式:pdf
- 大小:2.00 MB
- 文档页数:10

高一化学浓硫酸知识点化学是一门研究物质及其变化的科学,而浓硫酸则是其中一个重要的研究对象。
下面将介绍一些高一化学学习中关于浓硫酸的知识点。
一、浓硫酸的定义和性质浓硫酸,化学式为H2SO4,是一种无色,具有强烈刺激性气味的液体。
它是一种极强的酸,可以与许多物质反应,并产生大量的热量。
二、浓硫酸的制备方法1. 质量法制备:将一定质量的硫酸饱和溶液置于蒸发皿中,通过加热使其失去部分水分,得到浓硫酸。
2. 体积法制备:取一定体积的浓硫酸,在滴定管中加入等体积的浓硝酸,慢慢滴入至浓硫酸中,搅拌均匀后,得到浓硫酸。
三、浓硫酸的运用及注意事项1. 在实验室中,浓硫酸常用作催化剂以及其他化学试剂的制备。
2. 浓硫酸具有强酸性和强氧化性,使用时需要注意安全,避免接触皮肤和眼睛。
使用时应穿戴防护服和安全眼镜,并在通风良好的地方进行操作。
3. 浓硫酸在与有机物接触时,可能发生剧烈反应,产生高温和有毒气体,因此需要特别小心操作,避免事故发生。
四、浓硫酸的应用领域1. 在化学合成中,浓硫酸常用于有机物的磺化反应、酯化反应等。
2. 浓硫酸可以用来制备石油清洗剂、硫酸肥料等。
3. 在实验室中,浓硫酸广泛用于进行酸碱中和反应、脱水反应等。
总结:浓硫酸是一种重要的化学物质,具有强酸性和强氧化性。
它在化学实验室和工业生产中有广泛的应用,但使用时需要注意安全,避免与有机物接触以及其他危险情况的发生。
通过学习浓硫酸的性质和制备方法,我们可以更好地理解化学知识,并提高实验操作的技能。

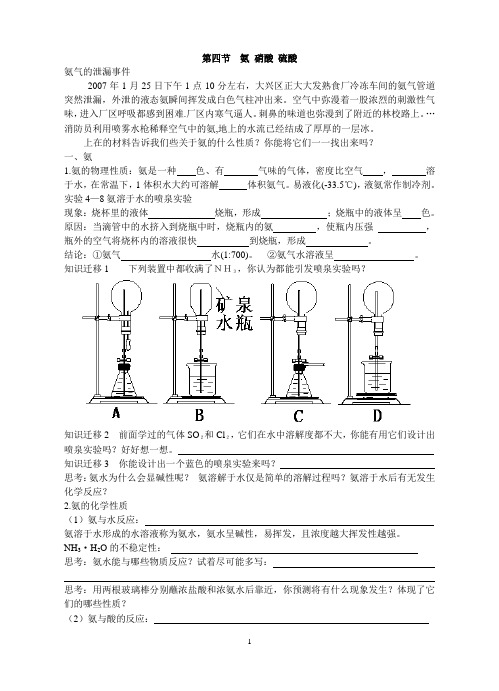
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。

高一化学电离方程式大全以下是一些常见的化学电离方程式,按照不同的酸、碱和盐分类。
一、强酸的电离方程式:1.盐酸(HCl)的电离方程式:HCl → H+ + Cl-2.硝酸(HNO3)的电离方程式:HNO3 → H+ + NO3-3.硫酸(H2SO4)的二次电离方程式:H2SO4 → 2H+ + SO4^2-4.氢碘酸(HI)的电离方程式:HI → H+ + I-5.高氯酸(HClO4)的电离方程式:HClO4 → H+ + ClO4-二、强碱的电离方程式:1.氢氧化钠(NaOH)的电离方程式:NaOH → Na+ + OH-2.氢氧化钾(KOH)的电离方程式:KOH → K+ + OH-3.钙氢氧化物(Ca(OH)2)的电离方程式:Ca(OH)2 → Ca^2+ + 2OH-4.氨水(NH3·H2O)的电离方程式:NH3·H2O → NH4+ + OH-三、盐的电离方程式:1.氯化钠(NaCl)的电离方程式:NaCl → Na+ + Cl-2.硝酸铵(NH4NO3)的电离方程式:NH4NO3 → NH4+ + NO3-3.硫酸铜(CuSO4)的电离方程式:CuSO4 → Cu^2+ + SO4^2-4.碳酸钠(Na2CO3)的电离方程式:Na2CO3 → 2Na+ + CO3^2-5.硫酸铵(NH4)2SO4)的电离方程式:(NH4)2SO4 → 2NH4+ + SO4^2-四、其他电离方程式:1.纯水的电离方程式:H2O → H+ + OH-2.氨(NH3)的电离方程式:NH3 → NH4+ + OH-3.三氯化磷(PCl3)的电离方程式:PCl3 + 3H2O → H3PO3 + 3HCl4.二氧化硫(SO2)的电离方程式:SO2 + H2O → H2SO3这些是常见的化学电离方程式的例子。
需要注意的是,这只是一部分的化学电离方程式,还有很多其他的物质的电离方程式,并且在特定的条件下,一些物质可能会有不同的电离方程式。


高一化学每日一练——第四章第四节氨、硝酸、硫酸(1)班级姓名1.下列气体不能用H2SO4干燥的是()A.CO2B.NH3C.SO2D.HC12.关于氨的下列叙述中,错误的是()A.氨易液化,因此可用来作制冷剂B.氨易溶解于水,因此可用来作喷泉实验C.氨极易溶解于水,因此氨水比较稳定(不容易分解)D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色3.下列物质不能用于检验NH3的是A.湿润的红色石蕊试纸B.无色的酚酞溶液C.蘸有浓盐酸的玻璃棒D.湿润的蓝色石蕊试纸4.下列反应属于氮的固定的是()A.空气在雷电作用下所产生NO B.NO和O2生成NO2C.铜与浓硝酸反应产生NO2D.NH4Cl与Ca(OH)2反应生成NH35.关于反应的说法中正确的是()A.NH3做还原剂,体现氧化性B.O2做氧化剂,体现氧化性C.参加反应的O2中只有一部分做氧化剂,其中做氧化剂的和不做氧化剂的物质的量之比是4:6D.该反应中氧化剂和还原剂的质量之比是5:46.下列实验现象与氧化还原反应有关的是A.NH3使湿润的红色石蕊试纸变蓝B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成C.NO2通入水中,气体由红棕色逐渐转变为无色D.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀7.在下列变化①N2和H2合成氨,②NO与O2化合,③NH4Cl受热分解中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是A.①②③B.②①③C.③②①D.③①②8.有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是 ( )A .氨气极易溶解于水的性质可以解释氨气的喷泉实验B .氨气的还原性可以解释氨气与氯化氢的反应实验C .铵盐的水溶性大是实验室中用NH 4Cl 和Ca(OH)2的混合物制取氨气的原因D .NH 3·H 2O 的热不稳定性可以解释实验室中用加热氨水的方法制取氨气9.将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸变蓝色的有 ( )A .加热浓氨水B .加热NH 4Cl 固体C .加热NH 4Cl 和Ca(OH)2的混合物D .加热饱和NH 4Cl 溶液 10.如图所示,室温下A 、B 两个容积相等的烧瓶中分别集满了两种气体(同温、同压),( )A .①②③B .②③①C .③①②D .③②①11.右图是实验室制取氨气的装置图。
高一化学必修二知识点硝酸高一化学必修二知识点:硝酸引言:化学是我们生活中不可或缺的一部分,它涉及到我们身边的各种物质和化学变化。
在高中化学教学中,硝酸是一个非常重要的知识点。
本文将深入探讨硝酸的性质、制备方法和用途等方面的内容,以帮助学生更好地理解和掌握这一知识点。
一、硝酸的性质硝酸是无机酸的一种,化学式为HNO3。
它是一种无色液体,有着刺激性的气味。
硝酸是一种强酸,具有强烈的腐蚀性,在使用和储存时需要注意安全。
硝酸具有良好的溶解性,可以溶解很多金属、氧化物和碱等物质。
二、硝酸的制备方法硝酸的制备方法主要有以下几种:1. 化学合成法:将浓硫酸与硝酸钾或硝酸银等硝酸盐反应,生成硝酸。
反应方程式为:H2SO4 + KNO3 → HNO3 + KHSO42. 氧化氮化物法:将二氧化氮与水反应,生成硝酸。
反应方程式为:NO2 + H2O → HNO33. 吸收硝酸蒸气法:将硝酸蒸气通过吸收剂,如硫酸,使其与水反应生成硝酸。
这种方法可以高效地制备大量的硝酸。
三、硝酸的用途硝酸具有多种用途,其中的一些主要用途如下:1. 工业应用:硝酸是一种重要的化学原料,在农药、肥料、爆炸物和合成纤维等领域有广泛的应用。
例如,在合成硝化纤维时,硝酸可以与纤维素进行反应,形成硝酸纤维。
2. 医药领域:硝酸也被用作药物的一部分,用于治疗心血管疾病,如心绞痛。
硝酸可以放松血管,增加血流量,从而改善心血管系统的功能。
3. 实验室应用:硝酸在实验室中被广泛应用于化学分析和合成实验中,用于反应试剂、溶液的制备和pH值的调节等用途。
结论:通过本文的介绍,我们可以了解到硝酸的性质、制备方法和用途等方面的知识。
硝酸作为一种常用的化学物质,不仅在工业和实验室中有广泛的应用,还对医药领域有重要意义。
在学习化学的过程中,我们应该加强对硝酸的学习,深入了解其性质和应用,以提高我们对化学的理解和应用能力。
参考文献:1. 何佳佳. 化学必修2 课程标准实验教程. 北京:北京出版社,2018年。
硫酸和硝酸摩尔质量
硫酸和硝酸都是无机强酸,在化学反应中有着广泛的应用。
硫酸的相对分子质量约为98g/mol。
硫酸是一种无色、无臭、高沸点、高密度的油状液体,具有高腐蚀性和强氧化性。
它能与水以任意比例混溶,并放出大量的热,所以在稀释硫酸时,只能将浓硫酸缓慢地倒入水中,同时不断搅拌,切不可将水倒入浓硫酸中。
硝酸的分子式为HNO_3,相对分子质量约为63g/mol。
纯净的硝酸是无色透明液体,具有窒息性刺激气味,能与水混溶,并且和水可以形成共沸混合物。
硝酸不稳定,易分解出二氧化氮,所以它在光照或加热条件下会分解,同时产生有毒烟雾。
硫酸和硝酸的摩尔质量不同,化学性质也有所差异。
硫酸主要用于制造肥料、药物、炸药、颜料等,也广泛应用于净化石油、金属冶炼以及染料等工业中。
硝酸则主要用于制造炸药、硝酸盐、氮肥等,同时也被用于蚀刻和酸洗等工艺中。
需要注意的是,硫酸和硝酸都具有强烈的腐蚀性和刺激性,使用时必须遵循安全操作规程,穿戴好防护用具,避免接触皮肤和眼睛。
同时,在使用这两种强酸时,应该保持通风良好,避免吸入其挥发出来的气体。
总之,硫酸和硝酸是两种重要的强酸,它们的摩尔质量、化学性质和用途都有所不同。
在使用它们时,必须严格遵守安全规定,以确保人身安全和环境安全。
希望这些信息对你有所帮助!。