胃蛋白酶原检测试剂盒(PGⅠ&PGⅡ)产品介绍
- 格式:doc
- 大小:751.50 KB
- 文档页数:3

胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(胶乳免疫比浊法)适用范围:该产品用于体外定量测定人血清或血浆中胃蛋白酶原Ⅰ的浓度。
1.1 产品规格试剂1:60mL×2,试剂2:20mL×2 ;试剂1:60mL×1,试剂2:20mL×1 ;试剂1:45mL×2,试剂2:15mL×2 ;试剂1:45mL×1,试剂2:15mL×1 ;试剂1:30mL×2,试剂2:10mL×2 ;试剂1:30mL×1,试剂2:10mL×1 ;试剂1:60mL×1 ,试剂2:15mL×1 ;试剂1:60mL×2 ,试剂2:12mL×2 ;试剂1:60mL×1,试剂2:12mL×1;试剂1:50mL×1,试剂2:10mL×1 ;试剂1:50mL×2 ,试剂2:10mL×2;试剂1:20mL×1 ,试剂2:4mL×1 ;试剂1:3000mL×1,试剂2:600mL×1 ;试剂1:300mL×1,试剂2:100mL×1 ;试剂1:15mL×1 ,试剂2:5mL×1 ;试剂1:1500mL×1,试剂2:500mL×1 ;20人份(试剂1: 4.8mL×1,试剂2: 1.6mL×1);50人份(试剂1: 12mL×1,试剂2: 4mL×1);100人份(试剂1: 24mL×1,试剂2: 8mL×1);1.2 组成成分1.2.1 试剂组成试剂1:甘氨酸缓冲液 200mmol/L(PH=8.2);试剂2:抗人胃蛋白酶原Ⅰ抗体包被的胶乳悬浊液 <0.5%1.2.2 校准品的组成5个水平的液体校准品,在50mmol/L PH=7.4 的磷酸盐缓冲液中添加胃蛋白酶原Ⅰ/Ⅱ,稳定剂<0.1%;PGⅠ定值范围:(5-15)ng/mL、(20-40)ng/mL、(50-90)ng/mL、(100-150)ng/mL、(160-240)ng/mL;PGⅡ定值范围:(0-10)ng/mL、(10-25)ng/mL、(25-50)ng/mL、(50-75) ng/mL、(75-120) ng/mL。
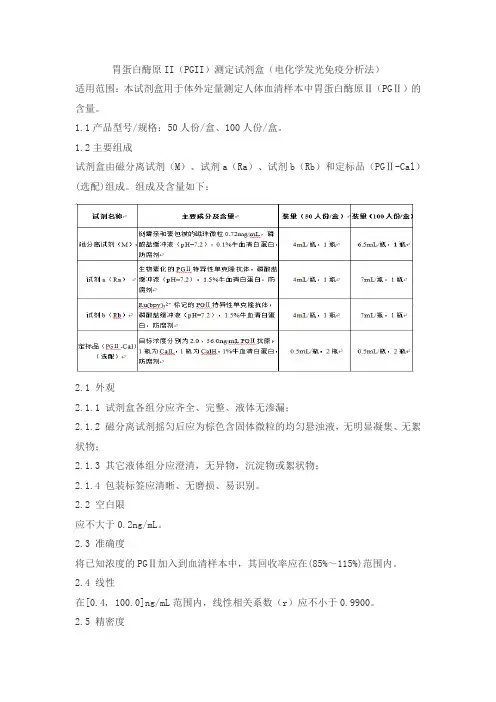
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中胃蛋白酶原Ⅱ(PGⅡ)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(PGⅡ-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.2ng/mL。
2.3 准确度
将已知浓度的PGⅡ加入到血清样本中,其回收率应在(85%~115%)范围内。
2.4 线性
在[0.4, 100.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高低两个水平的的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源至深圳新产业的PGⅡ定标液。

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)二合一测定试剂盒(荧光免疫层析法)
1.性能指标
2.1 外观
2.1.1试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2检测卡的外观应符合下列要求:外观平整、色泽均匀、边缘无毛刺,不能有色斑或污渍。
2.2物理检测
试纸条宽度均为4.0±0.5mm。
2.3液体移行速度
应不小于10.0mm/min。
2.4 空白限
PGⅠ空白限应不高于2ng/mL;
PGⅡ空白限应不高于2ng/mL。
2.5准确度
在试剂盒线性区间内,检测两个不同浓度的工作校准品,测定值与标示值的相对偏差应不超过±15%。
2.6线性
PGⅠ:在线性范围(2~150)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1ng/mL,在(10~150)ng/mL区间内测定的线性相对偏差应不超过±15%。
PGⅡ:在线性范围(2~80)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1 ng/mL,在(10~80)ng/mL区间内测定的线性相对偏差应不超过±15%。
2.7 重复性
用同一批号试剂盒测定两个不同浓度的内部参考品,要求变异系数CV≤15%。
2.8批间差
使用3个不同批号的试剂盒测定高、低两个浓度的参考品,要求批间变异系数CV≤15%。

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)检测试剂盒(荧光免疫层析法)性能指标1外观检查试剂盒应外观整洁平整,各组分齐全、完整,包装标签应清晰、准确、牢固。
试纸条表面应平整、无划伤、无开裂、无变形、无异味及污迹,各材料附着牢固、内容齐全。
检测卡外壳应平整,上下盖应均匀合拢,无明显间隙,试纸条在壳内应附着牢固。
质控品复溶前为白色至淡黄色冻干品;复溶后为澄清、透明液体,无沉淀、悬浮物和絮状物。
2物理检查2.1试纸条宽度试纸条宽度应在3.9mm~4.1mm之间。
2.2液体移行速度液体移行速度应≥10mm/min。
3最低检出限3.1PGⅠ≤1ng/ml;3.2PGⅡ≤0.5ng/ml。
4线性范围4.1PGⅠ:在1~200ng/ml范围内,其相关系数r≥0.9900;4.2PGⅡ:在1~100ng/ml浓度范围内,其相关系数(r)≥0.9900。
5准确度5.1PGⅠ:回收率应在85%~115%范围内。
5.2PGⅡ:回收率应在85%~115%范围内。
6精密度6.1批内精密度6.1.1PGⅠ:变异系数CV(%)≤10%;6.1.2PGⅡ:变异系数CV(%)≤10%。
6.2批间精密度6.2.1PGⅠ:变异系数CV(%)≤15%;6.2.2PGⅡ:变异系数CV(%)≤15%。
7特异性7.1PGⅠ:测试高浓度PGⅡ样本,检测结果≤1.0ng/ml;7.2PGⅡ:测试高浓度PGⅠ样本,检测结果≤0.5ng/ml。
8质控品8.1质控品测定值:测定本质控品,测定结果应在该质控品规定的参考范围内。
8.2瓶内均一性:瓶内变异系数(CV)应≤15%。
8.3瓶间均一性:瓶间变异系数(CV)应≤15%。

人胃蛋白酶原A(PG—A)ELISA试剂盒使用步骤本试剂盒只能用于科学研究,不得用于医学诊断人胃蛋白酶原A(PGA)ELISA检测试剂盒检测原理试剂盒采用双抗体夹心法酶联免疫吸附试验(ELISA)。
往预先包被人胃蛋白酶原A(PGA)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并*洗涤。
用底物TMB显色,TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成终的黄色。
颜色的深浅和样品中的人胃蛋白酶原A(PGA)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保管方法1.血清:使用不含热原和内毒素的试管,操作过程中避开任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞快速小心地分别。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保管:假如样本收集后不及时检测,请按一次用量分装,冻存于20℃,避开反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品酶标仪(450nm)高精度加样器及枪头:0.510uL、220uL、20200uL、2001000uL37℃恒温箱操作注意事项试剂盒保管在28℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶*溶解后再使用。
试验中不用的板条应立刻放回自封袋中,密封(低温干燥)保管。
预处理后的样本无需稀释,直接取10μL加样即可。
严格依照说明书中标明的时间、加液量及次序进行温育操作。
全部液体组分使用前充分摇匀。
试剂盒构成名称 96孔配置 48孔配置备注微孔酶标板 12孔×8条 12孔×4条无标准品 0.3mL 0.3mL 无样本稀释液 6mL 3mL 无检测抗体HRP 10mL 5mL 无20×洗涤缓冲液 25mL 15mL 按说明书进行稀释底物A 6mL 3mL 无底物B 6mL 3mL 无停止液 6mL 3mL 无封板膜 2张 2张无说明书 1份 1份无自封袋 1个 1个无注:标准品浓度依次为:160、80、40、20、10、0ng/mL.试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。


胃蛋白酶原(PG)I/II检测试剂盒(标记免疫分析法)1 范围本标准规定了胃蛋白酶原I/Ⅱ测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输和贮存。
本标准适用于进行胃蛋白酶原I和胃蛋白酶原Ⅱ测定试剂盒(以下简称PGI/Ⅱ试剂盒)。
包括以摩标记、化学发光标记等标记方法免疫分析试剂盒。
本标准不适用于胶体金标记或其他方法标记的半定量测定PG I/Ⅱ试剂(如;试纸条等);用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191—2008包装储运图示标志。
GB/T 29791.2 体外诊断医疗器械制造商提供的信息(标示) 第2部分:专业用体外诊断试剂。
3分类按照标记方法不同可以分为酶标记、(电)化学发光标记、(时间分辨)荧光标记等;根据固相载体不同可以分为微孔板式、管式、磁颗粒、微球珠和塑料珠等;根据操作过程的不同可分为手工操作法和仪器自动操作法。
4要求4.1外观制造商应根据自己产品的包装特点规定适当的外观要求,一般应有试剂盒各组分组成、性状;内外包装、标签清晰等的要求。
4.2 检出限4.2.1PGI试剂盒检测限不高于2.5ng/mL。
4.2.2 PG II试剂盒检测限不高于1.4ng/mL。
4.3线性在制造商给定的线性区间内(PG I下限不高于 3 ng/mL,上限不低于200 ng/mL;PG II下限不高于1.5 ng/mL,上限不低于100 ng/mL),相关系数(r)应不低于0.9900。
4.4准确度准确度应符合如下要求之一:a)在试剂金规定的线性区间内,检测胃蛋白酶原I/Ⅱ国家(或国际)标准品,测定结果的相对偏差应在士15.0%范围内b) 回收率应在85.0%~115.0%范围内。
4.5准确度4.5.1 批内精密度在试剂盒的剂量-反应曲线范围内,设置2个~3个不同浓度的质控品,手工操作试剂盒测定结果的变异系数(CV)应不高于10.0%,全自动操作试剂盒测定结果的变异系数(CV)应不高于8.0%。
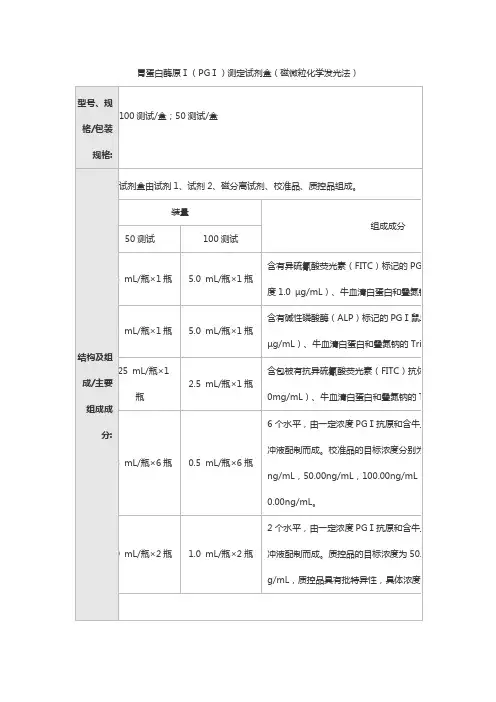
胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(磁微粒化学发光法)
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应无沉淀或絮状物;
2.1.4包装标签应清晰,易识别。
2.2线性
在[1.00,500.00]ng/mL的测量范围内,试剂盒的相关系数(r)应≥0.9900。
2.3检出限
应不高于1.00ng/mL。
2.4准确度
回收率应在85.0%-115.0%范围内。
2.5批内精密度
批内变异系数(CV)应不大于8.0%。
2.6批间精密度
批间变异系数(CV)应不大于15.0%。
2.7质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8特异性
测定浓度为200.00ng/mL的胃蛋白酶原Ⅱ样本,测定结果≤1.00ng/mL。
2.9校准品和质控品的批内瓶间差
2.9.1 校准品的批内瓶间差
校准品B~校准品F的批内瓶间差CV≤8.0%。
2.9.2 质控品的批内瓶间差
质控品批内瓶间差CV≤8.0%。
2.10 稳定性
在2℃~8℃条件下储存,有效期为12个月,在有效期满后检测试剂盒的线性、检出限、准确度、批内精密度、质控品的赋值有效性,应符合2.2、2.3、2.4、2.5、2.7的要求。
2.11 溯源性
根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,胃蛋白酶原Ⅰ校准品溯源至企业校准品,企业校准品与已上市产品比对赋值。

胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中胃蛋白酶原Ⅰ(PG Ⅰ)的含量。
1.1规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分注:1.质控品质控范围批特异,具体浓度详见标签。
2.1物理性能2.1.1外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2膜条宽度膜条的宽度应不小于3mm。
2.1.3移行速度液体移行速度应不低于10mm/min。
2.2溯源性根据GB/T21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3空白限空白限应不高于5ng/mL。
2.4准确度回收率应在85%~115%之间。
2.5线性在线性范围[10,200]ng/mL内,相关系数(r)应不低于0.99。
2.6重复性分别检测高值和低值两个样本,重复性(CV%)应不高于15.0%。
2.7批间差在三个批次产品之间,样本测定结果的变异系数(CV%)应不高于20.0%。
2.8特异性2.9质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10稳定性2.10.1效期稳定性10℃~30℃储存(质控品2℃~8℃),有效期12个月,效期后2个月内分别检测2.3~2.6,2.8,2.9项,其结果应符合各项要求。
2.10.2质控品开瓶稳定性质控品开瓶后2℃~8℃保存,有效期1个月,分别检测2.6、2.9项,其结果应符合各项要求。

胃蛋白酶原Ⅰ/Ⅱ(P GⅠ/P GⅡ)定量检测试剂盒(化学发光法)一、什么是胃蛋白酶原PGⅠ. PGⅡPGI主要来源于胃底腺的主细胞和颈黏液细胞,PGII则来源于全胃腺(胃贲门腺、胃底腺、胃窦幽门腺)和近端十二指肠腺,前列腺和胰腺也产生少量PGII。
血清PG水平反映了不同部位胃粘膜的形态和功能。
因此,联合测定PG I和PG I/II 比值可起到胃底腺粘膜“血清学活检”的作用。
PG I是检测胃泌酸腺细胞功能的指针,胃酸分泌增多PG I升高,分泌减少或胃粘膜腺体萎缩PGI降低;PG II与胃底粘膜病变的相关性较大(相对于胃窦粘膜),其升高与胃底腺管萎缩、肠上皮化生或假幽门腺化生、异型增生有关;PGI/II比值进行性降低与胃粘膜萎缩进展相关。
二、胃癌在严重危害人类的健康胃癌是最常见的恶性肿瘤之一,全世界胃癌死亡率高居常见恶性肿瘤死亡率的第二位,40万的胃癌患者,30万死亡。
尤其在亚洲国家的发病率极高。
降低胃癌死亡率的关键是胃癌的早期发现、早期诊断和早期治疗,早期胃癌筛检则是实现胃癌早期发现的重要手段。
三、目前几种检测方法的比较与传统的胃病检查手段相比,胃蛋白酶原PGI&PGII血清检测具有很强的优势。
(1)胃钡餐造影优点:检测时间短缺点:射线暴露,检测费用高,不能明确疾病性质,结果判定依赖于经验性,受检人群混杂及阳性患者难以随访等问题。
对早期胃癌的判定显得无能为力。
血清PG检测对诊断早期胃癌或肠型胃癌更有价值,钡餐检查对诊断进展期胃癌或弥散型胃癌更有价值。
(2)其他肿瘤相关标记物优点:采用血清检测,无创伤、广泛认知缺点:对胃癌检测的特异性低,对早期胃部疾病的诊断无参考价值。
如:CEA 在胃癌患者胃液中阳性检出率为50%, 血清阳性检出率仅为4.5%(3)胃镜优点:行业金标准,检测准确。
缺点:⒈体内检测,痛苦。
⒉受医生水平影响大。
⒊检测费用高。
⒋不适合体检普查。
(4)胃蛋白酶原PGI&PGII血清检测:优点:1.血清检测无创伤、更安全。

胃蛋白酶原II(PGII)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中胃蛋白酶原Ⅱ的含量。
1.1 产品型号包装规格为:规格1:试剂1:25ml,试剂2:5ml;规格2:试剂1:50ml,试剂2:10ml。
具体装量见表1:表1组成装量主要成分及含量试剂150ml/瓶、25ml/瓶磷酸盐缓冲液(PH7.4):50mmol/L;生物防腐剂:0.05%试剂210ml/瓶、5ml/瓶抗人PGII单克隆抗体的乳胶溶液:(0.2-1.2)g/L;磷酸盐缓冲液(PH7.4):50mmol/L说明书1份/盒/2.1外观:试剂盒各组份应齐全、完整,液体无渗漏;中文包装标签应清晰,无磨损;试剂1无色透明液体,试剂2 乳白色胶体溶液。
2.2 净含量:试剂的净含量不少于标示值。
2.3 试剂空白:用校准品稀释液作为空白样品进行测试,试剂空白吸光度值应小于0.02。
2.4分析灵敏度:以4.8ug/L的胃蛋白酶原II(PGII)为检测样本,吸光度变化率在0.0040-0.1376/min之间。
2.5线性:2.5.1试剂盒的线性范围为[2.0,107.8]ug/L,线性相关系数r不低于0.9900;2.5.2 [2.0,10.0]ug/L,绝对偏差不超过±1ug/L;(10.0,107.8]ug/L ,相对偏差在±10%范围内。
2.6 重复性:分别对浓度为5.4ug/L的低浓度控制血清和浓度为17.5ug/L高浓度的控制血清重复检测10次,变异系数(CV)应不大于10%。
2.7准确性:回收率在85%-115%;2.8分析特异性:检测浓度为245.0ug/L的胃蛋白酶原I中的胃蛋白酶原II的浓度,计算交叉反应率,应小于10%。
2.9批间差:相对偏差不大于10%。
2.10稳定性:2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
胃蛋白酶原Ⅰ测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中胃蛋白酶原Ⅰ(PGⅠ)的含量。
1. 产品型号/规格及其划分说明1.1 包装规格1)试剂1:50mL×1、试剂2:50mL×1;2)试剂1:50mL×2、试剂2:50mL×2;3)试剂1:50mL×1、试剂2:25mL×1;4)试剂1:50mL×2、试剂2:25mL×2;5)试剂1:45mL×1、试剂2:15mL×1;6)试剂1:45mL×3、试剂2:15mL×3;7)试剂1:48mL×1、试剂2:12mL×1;8)试剂1:48mL×3、试剂2:12mL×3;9)试剂1:50mL×1、试剂2:10mL×1;10)试剂1:50mL×3、试剂2:10mL×3;11)试剂1:60mL×1、试剂2:20mL×1;12)试剂1:96mL×1、试剂2:24mL×1;13)试剂1:100mL×1、试剂2:20mL×1;14)试剂1:27mL×1、试剂2:5mL×1;15)试剂1:27mL×2、试剂2:5mL×2。
1.2 组成成分试剂1:Tris-HCl缓冲液(pH7.5)20mmol/LNaCl100mmol/LEDTA50mmol/L试剂2:Tris-HCl缓冲液(pH7.5)20mmol/L抗人胃蛋白酶原I抗体结合胶乳——NaCl100mmol/L 2.1 装量试剂盒内液体装量应不低于瓶签标示装量。
2.2 外观试剂1:无色澄清液体;试剂2:乳白色液体。
2.3 试剂空白吸光度测定温度:37℃;测定波长:700nm;比色杯光径:1.0cm;其空白吸光度应不大于2.0。
胃蛋白酶原Ⅰ(PGⅠ)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中的胃蛋白酶原Ⅰ(PGⅠ)的含量。
1.1产品规格
50测试/盒,100测试/盒,200测试/盒
1.2主要组成成分
注:校准品和质控品浓度具有批特异性,具体浓度详见每批的校准品和质控品标签。
2.1外观
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;
2.1.3液体组分应澄清,无沉淀或絮状物;
2.1.4包装标签应清晰,易识别;
2.2溯源性
应根据GB/T21415-2008及有关规定提供校准品的来源、溯源的赋值方法和相应指标、以及不确定度等内容。
本试剂盒校准品可溯源至企业工作校准品,并与已上市产品比对赋值。
2.3准确度
回收率应在85%-115%范围内。
2.4空白限
应不大于1ng/mL。
2.5线性
在[1,200]ng/mL的测量范围内,相关系数r应≥0.9900。
2.6重复性
变异系数(CV)应不大于8%。
2.7质控品的赋值有效性
质控品的测量值应在质控范围内。
2.8批间差
变异系数(CV)应不大于15.0%。
2.9稳定性
试剂盒在2~8℃贮存,有效期为12个月,取到效期后的试剂盒样品进行检测,检测结果应符合2.3、2.4、2.5、2.6和2.7的要求。
胃蛋白酶原Ⅰ测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中胃蛋白酶原Ⅰ(PGⅠ)的含量。
1.1产品规格校准品(选配):0.5mL×6;1.0mL×6;2.0mL×6。
质控品(选配):水平1:0.5mL×1;1.0mL×1;2.0mL×1;水平2:0.5mL×1;1.0mL×1;2.0mL×1。
1.2主要组成成分校准品靶值批特异,详见校准品瓶签,质控品质控范围批特异,详见质控品瓶签。
2.1 外观试剂1为澄清液体,试剂2为无色或乳白色液体。
校准品、质控品为无色至淡黄色液体。
外包装完整无破损。
2.2装量不少于瓶签标示量。
2.3 试剂空白在700nm(650~750nm)处测定试剂空白吸光度,应≤1.0;2.4 分析灵敏度测试80ng/mL的被测物时,吸光度变化(ΔA)应≥0.008。
2.5 线性2.5.1在[2.5,160] ng/mL区间内,线性相关系数r≥0.990;2.5.2在[2.5,50)ng/mL区间内,线性绝对偏差不超过±7.5ng/mL;在[50,160] ng/mL区间内,线性相对偏差不超过±15%。
2.6精密度2.6.1重复性检测高、中、低三个浓度水平的样本,其结果的变异系数应不超过5%。
2.6.2批间差随机抽取三批试剂盒测试同一份样本,批间相对极差(R)应≤10%。
2.6.3瓶内均一性校准品、质控品瓶内变异系数CV≤10%。
2.7 准确度待检系统与比对系统测值的相关系数r≥0.975;PGⅠ在[2.5,50)ng/mL 区间内,绝对偏差不超过±7.5ng/mL;在[50,160]ng/mL区间内,相对偏差不超过±15%。
2.8校准品溯源性按照GB/T 21415及有关规定建立溯源性,提供校准品的来源、赋值过程及测量不确定度等内容,溯源至公司内部工作校准品,并与已上市产品比对赋值。
胃蛋白酶原I测定试剂盒(酶联免疫法)适用范围:本试剂盒用于体外定量测定人血清中的胃蛋白酶原I含量。
1.1 包装规格注:校准品(A~F)靶值为批特异,质控品(QL、QH)靶值范围为批特异,详见靶值表。
2. 性能指标:2.性能指标2.1.外观组分齐全、完整,液体无渗漏,包被板的包装袋无破损、漏气现象;标签应清晰,易识别。
2.2.装量液体装量应不少于标示值。
2.3.准确度在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在85~115%范围内。
2.4.线性在线性范围[2,200]ng/mL内,剂量反应曲线相关系数(r)的绝对值应不低于0.99。
2.5.空白限应不大于1.75ng/mL。
2.6 重复性同一次试验中分别重复检测浓度为50±10ng/mL和100±20ng/mL的质控品10次,变异系数(CV)应不大于10%。
2.7.批间差用3个批号的试剂分别重复检测浓度为50±10ng/mLL和100±20ng/mL的质控品10次,批间变异系数(CV)应不大于15%。
2.8. 分析特异性测定浓度为200ng/mL人胃蛋白酶原II,交叉反应率不大于5%。
2.9.pH值样本稀释液pH应在[5.5,5.9]范围内。
2.10.稳定性产品在2℃~8℃条件下保存有效期为12个月。
取过效期产品在2个月内进行检测,检测结果应满足2.3~2.6,2.8~2.9项要求。
2.11.溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用校准品的来源、溯源的赋值过程和相应要求、以及不确定度等内容,溯源到本公司工作校准品,工作校准品通过已上市产品比对赋值。
胃蛋白酶原试剂盒说明书1. 产品介绍胃蛋白酶原试剂盒是一种用于检测胃蛋白酶原水平的试剂盒。
胃蛋白酶原是一种在胃部产生的酶原,经过转化成活性胃蛋白酶,在消化过程中起到重要作用。
本试剂盒可以通过测量样品中的胃蛋白酶原水平,提供对胃功能的评估。
2. 试剂盒组成•胃蛋白酶原检测试剂:用于检测样品中的胃蛋白酶原水平。
•标准品:已知浓度的标准品,用于校准仪器和验证试剂盒性能。
•试剂盒说明书:详细介绍了试剂盒的使用方法、注意事项和解读结果的步骤。
3. 使用方法3.1 样品处理•收集待测样品(血清或血浆)并离心去除悬浮物。
•将样品转移到干净的离心管中,并保持冷藏状态,避免冻结。
•如有需要,可以根据实验要求进行稀释。
3.2 校准仪器•取出标准品,并按照说明书中的浓度要求进行适当稀释。
•使用校准仪器,根据仪器厂家提供的操作指南进行校准。
3.3 准备试剂•将胃蛋白酶原检测试剂从冷藏中取出,并在室温下静置15分钟。
•轻轻摇动试剂瓶,确保试剂均匀混合。
3.4 检测步骤1.取出足够数量的微孔板,标记样品编号和对应的标准品编号。
2.加入待测样品、标准品和质控品至相应孔位中。
3.加入适量的胃蛋白酶原检测试剂至每个孔位中,并轻轻摇动混匀。
4.封闭微孔板,放置于恒温箱中,在37°C下孵育30分钟。
5.在孵育结束后,将微孔板取出并倒置于吸水纸上,轻轻拍干底部残留液体。
6.使用洗涤缓冲液洗涤每个孔位,重复3次,并用吸水纸吸干底部液体。
7.加入底物溶液至每个孔位中,轻轻摇动混匀。
8.放置于恒温箱中,在37°C下孵育15分钟。
9.加入停止液至每个孔位中,停止反应。
10.使用酶标仪测量各孔位的吸光度值。
4. 结果解读根据酶标仪测量得到的吸光度值,可以通过标准曲线计算出样品中的胃蛋白酶原浓度。
根据浓度的高低,可以评估胃功能的状态。
5. 注意事项•本试剂盒仅供科研使用,不能用于临床诊断。
•试剂盒应保存在2-8°C的冷藏条件下,避免阳光直射和高温。
体外诊断试剂胃蛋白酶原检测试剂盒一、胃蛋白酶原及胃病胃癌介绍(一)胃蛋白酶原胃蛋白酶原(pepsinogen,PG)是胃分泌的一种消化酶前体,是胃液中胃蛋白酶的无活性前体,为一个由375个氨基酸组成的蛋白多肽链,平均相对分子质量为42000,人胃粘膜中有7组胃蛋白同工酶原。
PG在核糖体上合成,由高尔基体分泌出细胞,被盐酸激活后变成胃蛋白酶。
根据生化性质、免疫原性、细胞来源及组织内分布可分成PGⅠ、PGⅡ两个亚群,1~5组分免疫原性近似,称为PGⅠ,主要由胃腺的主细胞的颈粘液细胞分泌;6~7组分免疫原性近似,称为PGⅡ,除由胃体和胃底黏膜的泌酸腺的主细胞分泌外,泌酸腺的颈黏液细胞、贲门腺和胃窦的幽门腺的黏液细胞及十二指肠上段的Brunner腺也能产生PGⅡ。
约有1%的PG透过胃黏膜毛细血管进入血液循环,进入血液循环的PG在血液中非常稳定。
血清PGⅠ和PGⅡ反映胃黏膜腺体和细胞的数量,也间接反映胃黏膜不同部位的分泌功能。
当胃黏膜发生病理变化时,血清胃蛋白酶原含量也随之改变。
因此,监测血清中胃蛋白酶原的浓度可以作为监测胃黏膜状态的手段。
血清PG含量与良、恶性胃溃疡的鉴别有关,血清PGⅠ水平与萎缩性胃炎、PGⅠ/PGⅡ水平与胃癌、胃癌前期病变呈负相关。
血清PGⅠ与胃泌酸腺细胞功能相关,PGⅡ与胃底粘膜病变的相关性较大,血清PG反映胃总体分泌PG水平。
消化性溃疡的发生与胃酸分泌过多有密切关系。
萎缩性胃炎、胃癌前期病变或胃癌发生时,尤其是幽门螺杆菌感染等因素所干扰时,PGⅠ和PGⅡ的分泌会增加;而在慢性严重萎缩性胃炎中,当主细胞减少时PGⅠ含量下降;当萎缩性胃炎伴有肠化生、胃窦腺化生、假幽门腺化生时,PGⅡ含量会随之增高。
(二)胃病与胃癌胃病实际上是许多病的统称。
它们有相似的症状,如上腹胃脘部不适、疼痛、饭后饱胀、嗳气、返酸,甚至恶心、呕吐等等。
临床上常见的胃病有急性胃炎、慢性胃炎、胃溃疡、十二指肠溃疡、胃十二指肠复合溃疡、胃息肉、胃结石、胃的良恶性肿瘤,还有胃黏膜脱垂症、急性胃扩张、幽门梗阻等。
胃蛋白酶原(PGⅠ&PGⅡ)定量检测
试剂盒(化学发光法)
项目推荐书
胃蛋白酶原检测试剂盒(PGⅠ&PGⅡ)产品介绍我司全国首家自主研发生产的特色产品胃蛋白酶原(PG1/PG2),在个性化治疗领域中起到重点筛查、早期发现的作用,仅需抽取2毫升血液,便能够非介入、精确定量、快速便捷全面地监测胃部疾病,病人痛苦小,费用低,是胃镜、钡餐、碳呼吸等传统胃病检测方法所无法比拟的。
下图是美凯试剂盒、配套仪器:
胃蛋白酶原Ⅰ/Ⅱ定量检测试剂盒(化学发光法):
①最高检出率能达到97%;
②检测方法简单,一台仪器就可以进行检测;
③只需要2毫升血液就可以进行检测;
④低廉的花费就可以判断胃部疾病的进展情况;
⑤可实现对胃癌早发现,早预防,早诊断,早治疗;
⑥非侵入、无痛苦、无不良反应,适用于任何人群。
检验操作流程:。