2019高考化学一轮优练小题10含解析新人教版20180905114
- 格式:pdf
- 大小:695.46 KB
- 文档页数:5

2019高考化学一轮基础题系列(1)李仕才1、(2018届黑龙江省齐齐哈尔市高三第三次模拟考试)阿伏加德罗常数的值为N A,下列说法正确的是A. 0.1 mol NaHSO4晶体中,含有H+的数目为0.1N AB. 28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4N AC. 1L 0.1 mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1N AD. 质量均为22g的T2O与D218O中所含中子数均为12N A【答案】D【解析】硫酸氢钠的晶体中存在的是钠离子和硫酸氢根离子,不存在氢离子,选项A错误。
设乙烯和丙烯的物质的量分别为Xmol和Ymol,有28X+42Y=28,即2X+3Y=2;一个乙烯分子有4个单键(碳氢键),一个丙烯分子有7个单键(6个碳氢键和1个碳碳键),所以单键为:4X+7Y,由上有:4X+7Y>4X+6Y=4,选项B 错误。
根据物料守恒,1L 0.1 mol/L的Na2CO3溶液中CO32-、HCO3-和H2CO3离子数目之和为0.1N A,选项C错误。
T2O与D218O的分子量都是22,所以22g的T2O与D218O的物质的量都为1mol。
T原子有2个中子,O原子有8个中子,18O原子有10个中子,D原子有1个中子,所以两个分子都有12个中子,各自为1mol时,含有的中子均为12mol,因此选项D正确。
2、设N A为阿伏加德罗常数值。
下列有关叙述正确的是A.14 g乙烯和丙烯混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A【答案】A过量硝酸生成硝酸铁,反应中电子转移数目为3N A,错误;D.在标准状况下四氯化碳是液态,不能用气体摩尔体积进行有关物质的量的计算,错误。
3、(2018届天津市第一中学高三上学期第二次月考)下列关于误差分析的判断正确的是( )A. 酸碱中和滴定中滴定终点读数时滴定管内吸入气泡,会使测得浓度偏大B. 用托盘天平称取药品时,药品和砝码位置颠倒,药品质量一定偏小C. 配制1moI/L的NH4NO3溶液时未恢复至室温就转移并定容,所得溶液浓度偏小D. 用湿润的pH试纸测稀酸溶液的pH,测定值偏小【答案】C【解析】A. 酸碱中和滴定中滴定终点读数时滴定管内吸入气泡,会使终点读数偏小,从而使计算出的标准溶液体积偏小,测得的浓度偏小,故A错误;B. 用托盘天平称取药品时,药品和砝码位置颠倒,若未使用游码,则结果无影响,故B错误;C. 硝酸铵溶于水吸热,未恢复至室温就转移并定容,最终恢复至室温后溶液体积偏大,配制的溶液浓度偏小,故C正确;D. 用湿润的pH试纸测稀酸溶液的pH,相当于稀释了稀酸,则测得的pH偏大,故D错误;答案选C。

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是 6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。

人教化学2019高考一轮基础习练(10)李仕才一、选择题1、己知八、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。
2 mol甲分子反应生成1 mol丙和3 mol乙,下列对此判断不正确的是(D )2总一8 +3乙甲内O表示A原子O表示B原子A.1个乙分子中含有2个A原子B.甲的摩尔质量为17 g • mol-1C.同温同压下,生成丙和乙的体积比为1: 3D.标准状况下,11.2 LAP溶于500汕水中,所得溶液中甲的物质的量浓度为1 mol・17】2、下列各组物质的分类(括号里的是类别)都正确的是(B )A.空气(混合物)、C2H50H(醇)、H2SOH离子化合物)、C02(非电解质)B.液氨(氢化物)、NH心住安盐)、HNO,含氧酸)、NaOH(强电解质)C.HC1 (共价化合物)、C&COOH(竣酸)、NaO(碱性氧化物)、卤代桂)D.曲(酸性氧化物)、CHsCHO(有机物)、CO(有机物)、CMOOCH,酯)解析A项,朋0堤共价化合物,错误;C项,NM)2不属于碱性氧化物,属于过氧化物,错误;D 项,N0?不是酸性氧化物,CO是无机物,错误。
3、在A12(S0d3和MgSOi的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,贝IJ原混合液屮A12(S0I)3-^ MgSO.(的物质的量浓度Z比为(D )A. 6 : 1B. 3 : 1C. 2 : 1D. 1 : 2解析溶解Al(0H)3耗碱10 mL,则生成A1(OH)3耗碱为30 mL,生成Mg(0H)2耗碱(50-30) mL = 20mL,故A严与十浓度之比为1 : 1,则Al2(S04)3与MgSO“的物质的量浓度之比为1 : 2。
4、氯水中存在如下平衡:Cb 2(aq)、C12(aq)+H2++Cr+HC10o下列说法正确的是(A )A.向饱和氯水中通入HC1,有c(H+) =c(Cr)+c(0H") +c(C10_)B.氯气在1 mol -「的NaCl溶液中比在1 mol •「的A1C13溶液中的溶解度小C.光照,氯水的漂白性增强D.若向饱和氯水中通入少量比S, C(H+)/C(C1(F)减小解析 根据电荷守恒,A 项正确;1 mol • L 的NaCl 溶液中的c (Cl )比1 mol • L 1的AlCh 溶液中c(Cr)小,所以NaCl 溶液对氯气溶解的抑制作用更小,即氯气在lmol ・「的NaCl 溶液中的溶解度大,B 项错误;光照时HC1O 分解,氯水的漂白作用减弱,C 项错误;若通入 少量£S,发生反应:C12+H 2S=2HC1+S I ,所以溶液中c(『)增大,Cl 2(aq)消耗使第二个 平衡逆向移动,c(C10-)肯定会减小,所以c(H+)/c(Cl(T )增大,D 项错误。

2019高考化学(人教版)一轮优练题(10)含答案一、选择题1、某合作学习小组讨论辨析以下说法,其中正确的是()①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤纯碱和熟石灰都是碱;⑥豆浆和雾都是胶体A.①②③④B.①②⑤⑥C.③⑤⑥D.①③④⑥解析水煤气是不可再生能源;纯碱是Na2CO3,是一种盐而不是碱。
因此②⑤错误。
答案D2、欲配制100 mL 1.0 mol·L-1Na2SO4溶液,下列方法中正确的是()①将14.2 g Na2SO4溶于100 mL水中②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL③将20 mL 5.0 mol·L-1Na2SO4溶液用水稀释至100 mLA.②③B.①②C.①③D.①②③解析100 mL应是溶液的体积,而不是溶剂的体积,另外Na2SO4的物质的量为0.1 mol。
答案A3、下列实验操作正确的是()解析应将钠表面的煤油用滤纸吸干且烧杯中不能装满水(否则会迸溅出液体),A错误;B项都有白色沉淀产生,错误;Na2O2与CO2反应生成氧气,如果棉花燃烧说明达到了着火点,能证明是放热反应,C正确;观察钾的焰色反应应该透过蓝色钴玻璃,D错误。
答案C4、研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:①SO2+NO2===SO3+NO②SO3+H2O===H2SO4③2NO+O2===2NO2NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是() A.潮湿的氯气通过盛有浓H2SO4的洗气瓶B.在蔗糖中加入少量浓硫酸并不断搅拌C.将少量浓硫酸滴入胆矾晶体中D.加入少量硫酸使乙酸乙酯水解解析NO2参与硫酸型酸雨的形成时,发生了化学反应,反应后又重新生成,在反应中起催化作用。
在乙酸乙酯的水解反应中,硫酸也起催化作用。
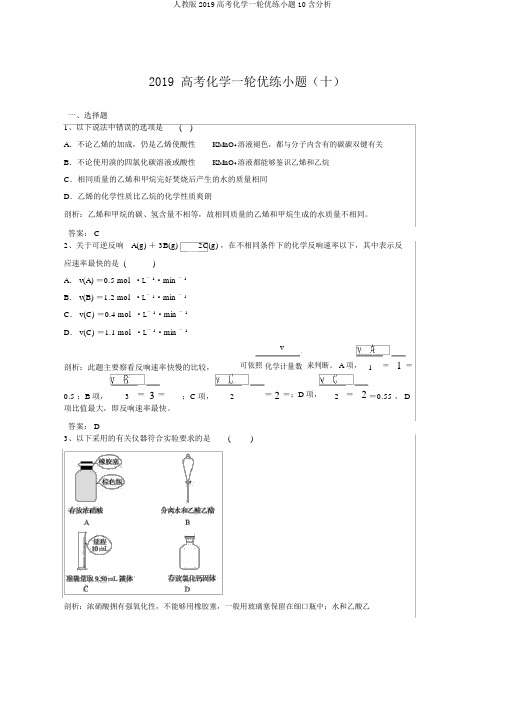
2019 高考化学一轮优练小题(十)一、选择题1、以下说法中错误的选项是()A.不论乙烯的加成,仍是乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关B.不论使用溴的四氯化碳溶液或酸性KMnO4溶液都能够鉴识乙烯和乙烷C.相同质量的乙烯和甲烷完好焚烧后产生的水的质量相同D.乙烯的化学性质比乙烷的化学性质爽朗剖析:乙烯和甲烷的碳、氢含量不相等,故相同质量的乙烯和甲烷生成的水质量不相同。
答案: C2、关于可逆反响A(g) + 3B(g)2C(g) ,在不相同条件下的化学反响速率以下,其中表示反应速率最快的是 ()A. v(A) =0.5 mol ·L-1·min -1B. v(B) =1.2 mol ·L-1·min -1C. v(C) =0.4 mol ·L-1·min -1D. v(C) =1.1 mol ·L-1·min -1v剖析:此题主要察看反响速率快慢的比较,可依照化学计量数来判断。
A 项,1=1=0.5 ;B项,3=3=;C 项,2=2=;D项,2=2=0.55 , D 项比值最大,即反响速率最快。
答案: D3、以下采用的有关仪器符合实验要求的是()剖析:浓硝酸拥有强氧化性,不能够用橡胶塞,一般用玻璃塞保留在细口瓶中;水和乙酸乙酯互不相溶,可用分液漏斗分别;用量筒量取液体只能精准到0.1 mL ;实验室中固体药品要保留在广口瓶中,便于取用。
答案: B4、以下判断,构造正确的选项是()选项项目结论A三种有机化合物:丙烯、氯乙烯、苯分子内所有原子均在同一平面B由溴丙烷水解制丙醇;由丙烯与水反响制丙醇属于同一反响种类C乙烯和苯都能使溴水褪色褪色的原理相同D C4H9Cl 的同分异构体数目 ( 不考虑立体异构 )共有 4种剖析: A 项, CH2===CH— CH3中— CH3所有原子不能能在同一平面,CH2===CHCl所有原子在同一平面,苯是平面六边形,所有原子在同一平面,错误; B 项,溴丙烷在氢氧化钠水溶液中加热发生水解反响( 取代反响 ) 转变成丙醇,丙烯和水发生加成反响生成丙醇,反响种类不同,错误; C 项,乙烯使溴水褪色,发生加成反响,苯使溴水层褪色,原理是萃取,二者原理不相同; D 项,氯原子的地址有 4 种,即 C4H9Cl 的同分异构体有 4 种,正确。

人教化学2019高考一轮选编小练:选择题题(周测)李仕才1. 下列离子的检验方法合理的是()A. 向某溶液屮滴入KSCN 溶液呈血红色,说明不含Fe 汁B. 向某溶液中通入CL,然后再加入KSCN 溶液变血红色,说明原溶液中含有FJ+C. 向某溶液中加入NaOH 溶液,得红褐色沉淀,说明溶液中含有Fe"D. 向某溶液中加入NaOH 溶液得白色沉淀,乂观察到颜色逐渐变为红褐色,说明该溶液中只 含有Fe 2+,不含有Mg?+答案C解析 某溶液中滴入KSCN 溶液呈血红色,说明含Fe 3+,无法判断是否含Fe 2+, A 项错误; 先通入CL 再加入KSCN 溶液变血红色,说明含F&+,但CL 有氧化性,无法判断原来是含 Fe"还是Feb B 项错误;某溶液中加入MaOH 溶液,得红褐色沉淀,说明溶液中含有Fe", C 项正确;某溶液川加入W0H 溶液得白色沉淀,乂观察到颜色逐渐变为红褐色,说明该溶 液中含有Fe 2+,但由于红褐色的掩盖,无法说明是否含有D 项错误。
2. 耕(H2N —NHJ 是一种高能燃料,有关化学反应的能量变化如下图所示,已知断裂1 mol 化学键所需的能量(kJ): N=N 为942、0=0为500、N —N 为154,则断裂1 mol N —II 键所 需的能量(kJ)是()2N(g)+4H(g)+2O(g) :AH2=-2 752 kJ mol-1 [ : N 2H 4(g)+O 2(g) ; ! A/Z^-534 kJ moh 1 ; i i * ▼N 2(g)+2H 2O(g) A. 194 B. 391 C. 516 D. 658答案B解析 由图知 N2H4(g) +02(g) =N 2(g) +2H20(g), △〃 = —534 kJ • mol -1,可设断裂 1 mol M —H 键所需能量为 xkj,由图得出:AM+A/=154kJ ・ moL + 4jvkJ ・ moL + 500 kJ • mol -1—2 752 kJ • mol _, = —534 kJ • mol -1,可求得 %=391, B 项正确。
人教化学2019高考一轮训练选(10)李仕才一、选择题1、单质M 与氧气反应为:2M+02~*2M0,参加反应的M 与生成的M0质量关系如图所示,则M0的摩尔质量(g/mol)为()° 20 MO 质量僖A. 24B. 40C. 48D. 80【答案】B【解析】设M 的相对原子质量为X,根据化学方程式列数据如下:2M+O2=2MO2x 2x(x+l6)12g 20g,解得x=24,则MO 的相对分子质量为24+16=40,根据摩尔质量的数值等于其 相对分子质量,单位是g/mcb 所以MO 摩尔质量40g/mol,故选E 。
点睛:本题考查根据化学方程式的有关计算,解题的关键是理解化学方程式可以表示反应物和生成物的质量关系,利用化学方程式求出某元素的相对原子质量,再根据摩尔质量在数值上等于其相对分子质量 进一步解决问题。
注意利用图像数据得到M 和MO 的质量关系。
2、下列反应的离子方程式书写正确的是A. 铜溶于 0. 5mo/L 的硝酸:Cu+4H ++2N0; =Cu 2,+2N02 f+2出0 B. N&S2O3溶液中加入稀硫酸:2S20产+ 4H +二SO 产+ 3S I + 2出0C. 向Ba(0H)2溶液中加入少量的NHiHSO.,溶液:B 『+OH 「+『+SO 广二BaSCh 1 +H2OD. Ca (HC03)2溶液与少量 NaOH 溶液反应:HCO :「+C/ +0H 二CaC0:N+H2O【答案】DM质量/g12 12g 20g ▲【解析】铜濬于0. 5mo/L 的硝酸生成NO,离子方程式是3Cu+8FT+2N8 =3Cu 尹+2NO | +4曲0,故A 错 误;N H 2S 2O3滚'液中加入稀硫酸,+2价S 发生歧化反应2生成S 单质、S6气体,反应离子方程式是 S2O 产+ 2rf=S6 t +S | +H2O,故B 错误;向Ba (OH) 2溶液中加入少量的NHiHSd 溶液,反应离子方程式是 Ba 2>+2OH-+fT+SO42 +NH4-=BaSO41 +股6 NH 3 - H 2O ,故 C 错误:Ca (HCO3) 2 滚滋与少量 NaOH 溶液反应生成碳酸钙、碳酸氢钠、水,反应离子方程式是:HCCWhf 二CaCO 昇+HX ),故D 正确。
选练习题(10)1、(2018届江西省新余市高三第二次模拟考试)设N A为阿伏加德罗常数的值,下列说法正确的是A.氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2乂B. 2. 0gD20中含有的质子数、电子数均为N AC.向含有FeL的溶液中通入适量氯气,当有1 molFe2+被氧化吋,该反应转移电子数目一定为3N AD.14g分子式为CJk的坯屮含有的共价键的数目一定为2N A【答案】B【解析】八、气体所处的状况不确定,气体的物质的量就不确定,无法计算负极消耗的气体分子数目,故A错误。
B、1个中含有10个质子,10个电子,则物质的量为,含有的质子数、电子数均为故B正确。
C、当有lmolFe2'被氧化时,Fe"被氧化成Fe",转移lmol电子,而碘离子也被氧化,因不知道碘离子氧化后的化合价,所以转移电子的数目不确定,故C错误。
D、14g GH%中所含的C-H键为2N A,共价键总数大于2N A,故D错误。
本题正确选项为B。
2、三种气体X、Y、Z的相对分子质量关系为M:-(X)<M r(Y)=O. 5M,-(Z),下列说法正确的是A.原子数目相等的三种气体,质量最大的是ZB.相同条件卜,同质量的二种气体,气体密度最小的是XC.若一定条件下,三种气体体积均为2. 24 L,则它们的物质的量一定均为0. lmolD.同温下,体积相同的两容器分别充2gY气体和lgZ气体,则其压强比为2: 1【答案】B【解析】试题分析:A、原子数相等,但不能确定其分子数的关系,即不能确定其物质的量的关系,不能确走其质量的犬小,错误,不选加玖相同条件下,同质量的气体,摩尔质量越小,其物质的量越犬,体积越大,密度越小,故X密度最小,正确,选3: C、在一定条件下,三者气体体积均为2.24L,则其物质的量相等,但不一定杲0・1摩尔,没有说明是否在标况下,错误,不选6 D、2gY气体和lgZ气体其物质的量相等,在相同的温度和体积时,其压强也相同,错误,不选D。
人教化学2019高考一轮训练学题(1)李仕才一、选择题1、常温下,在水溶液中发生如下反应①16H ++10C -+2XO -4===2X 2++5C 2+8H 2O ;②2A 2++B 2===2A 3++2B -;③2B -+C 2===B 2+2C -。
下列说法错误的( )A .反应C 2+2A 2+===2A 3++2Cl -可以进行 B .还原性由强到弱的顺序是C ->A 2+>B ->X 2+C .氧化性由强到弱的顺序是XO -4>C 2>B 2>A 3+D .反应③是置换反应 【参考答案】B3、电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。
下图是KOH 溶液分别滴定HCl 溶液和CH 3COOH 溶液的滴定曲线示意图。
下列示意图中,能正确表示用NH 3·H 2O 溶液滴定HCl 和CH 3COOH 混合溶液的滴定曲线的是( )解析:HCl为强电解质,CH3COOH为弱电解质,滴加NH3·H2O,先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液稀释,所以电导率下降。
当HCl被中和完后,继续与CH3COOH弱电解质反应,生成CH3COONH4,为强电解质,所以电导率增大。
HCl 与CH3COOH均反应完后,继续滴加弱电解质NH3·H2O,电导率变化不大,因为溶液被稀释,有下降趋势。
答案:Dc NH3·Oc NH+4的值都变小倍后,稀释后④溶液中的pH大0.001 mol·L-1,一水合氨是弱电解质,NH+4c NH3·2Oc NH+4的值都增大,错误;稀释后③④溶液中3、5,D答案:D5、现有下列仪器,①集气瓶;②量筒;③烧杯;④表面皿;⑤蒸发皿;⑥容量瓶;⑦圆底烧瓶。
其中能用酒精灯加热的是( )A.②③⑤ B.③⑥⑦C.①③④ D.③⑤⑦解析:集气瓶、量筒、表面皿、容量瓶不能加热,烧杯、圆底烧瓶要垫石棉网加热,蒸发皿可直接加热。
2019高考化学(人教)一轮选编练题(10)及答案应;NH4HCO3溶液与盐酸、NaOH溶液均能反应;KHSO4溶液与盐酸不反应,因此②③④⑥⑦属于合理选项。
答案:B4.有a g、b g两份铝粉,分别置于足量的NaOH溶液和盐酸中,在相同条件下,收集到H2的体积相同。
下列有关叙述一定正确的是()A.a=bB.a>bC.c(NaOH)=c(HCl)D.消耗的n(NaOH)与消耗的n(HCl)相等解析:依得失电子守恒知a=b,A项正确,B项错误;因酸、碱均是足量的,且体积未知,故无法确定酸、碱的浓度,c(NaOH)和c(HCl)可能相等,也可能不相等,C项不合题意;由2Al+6H+===2Al3++3H2↑,2Al+2OH-+2H2O===2AlO-2+3H2↑知消耗酸、碱的物质的量不相等,D项错误。
答案:A5.最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。
下列有关H2S的说法正确的是()A.H2S属于非电解质B.人体内H2S可由含硫蛋白质降解产生C.大量吸入H2S对人体无害D.H2S只有还原性没有氧化性解析:酸碱盐均属于电解质,硫化氢是酸,故属于电解质,故A错误;蛋白质中含有S元素,S元素降解后的产物是硫化氢,故B正确;硫化氢气体有毒,不能大量吸入人体,故C错误;硫化氢中S原子为-2价,具有还原性,H原子为+1价,具有氧化性,故D错误。
答案:B6.下列有关硫酸的性质或反应与硫酸表现出的性质相一致的是()A.浓硫酸与氯化钠固体反应制HCl——难挥发性B.蔗糖与浓硫酸反应的“黑面包”实验——吸水性C.在加热条件下木炭与浓硫酸反应——酸性D.久置在敞口容器中的浓硫酸质量增大——脱水性解析:蔗糖炭化体现了浓硫酸的脱水性,B项错误;木炭与浓硫酸的反应体现了浓硫酸的强氧化性,C项错误;久置在敞口容器中的浓硫酸质量增大是因为浓硫酸吸收了空气中的水蒸气,表现吸水性,D项错误。
答案:A7.如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中不正确的是()A.A、C两元素形成的化合物都为共价化合物B.AD2的电子式为C.B、C形成的化合物BC中所含化学键为非极性共价键D.B2的结构式为解析:根据A、B、C、D四种元素在周期表中的位置可知,A、B、C、D分别为C、N、O、S四种元素。