第四章 化学平衡判断题及答案
- 格式:doc
- 大小:28.00 KB
- 文档页数:2

第 三 节 化 学 平 衡 练 习 题一、选择题1.在一个密闭容器中进行反响: 2SO(g) +O 2(g)2SO 3(g)已知反响过程中某一时辰, SO 2、O 2、SO 3 分别是 0.2mol/L 、0.1mol/L 、0.2mol/L ,当反响达到均衡时,可能存在的数据是()A .SO 2为 0.4mol/L ,O 2 为 0.2mol/LB .SO 2为 0.25mol/LC .SO 2、SO 3(g) 均为 0.15mol/LD .SO 3(g) 为 0.4mol/L2 .在必定温度下,可逆反响A(g)+3B(g)2C(g) 达到均衡的标记是()A. C 生成的速率与 C 分解的速率相等B. A 、B 、C 的浓度不再变化C. 单位时间生成 n molA ,同时生成 3n molBD. A 、B 、C 的分子数之比为 1:3:23.可逆反响 H (g)+I 2(g)2HI(g) 达到均衡时的标记是()2A. 混淆气体密度恒定不变B. 混淆气体的颜色不再改变C. H 2、I 2、HI 的浓度相等D. I 2 在混淆气体中体积分数不变4.在必定温度下的定容密闭容器中,取必定量的A 、B 于反响容器中,当以下物理量不再改变时,表示反响: A(s)+2B(g)C(g)+D(g) 已达均衡的是()A .混淆气体的压强B .C .C 、D 的物质的量的比值D .气体的总物质的量5.在一真空密闭容器中,通入必定量气体 A .在必定条件下,发生以下反响:2A(g)B(g) + x C(g) ,反响达均衡时,测得容器内压强增大为 P %,若此时 A 的转化率为 a %,以下关系正确的选项是( )A .若 x=1,则 P >aB .若 x=2,则 P <aC .若 x=3,则 P=aD.若 x=4,则 P ≥a6.密闭容器中,用等物质的量 A 和 B 发生以下反响: A(g)+2B(g)2C(g) ,反响达到均衡时,若混淆气体中A 和B 的物质的量之和与C 的物质的量相等,则这时 A 的转变率为()A .40%B .50%C .60%D.70%7.在 1L 的密闭容器中通入 2molNH 3,在必定温度下发生以下反响: 2NH 3 N 2+3H 2,达到均衡时,容器内 N 2 的百分含量为 a%。
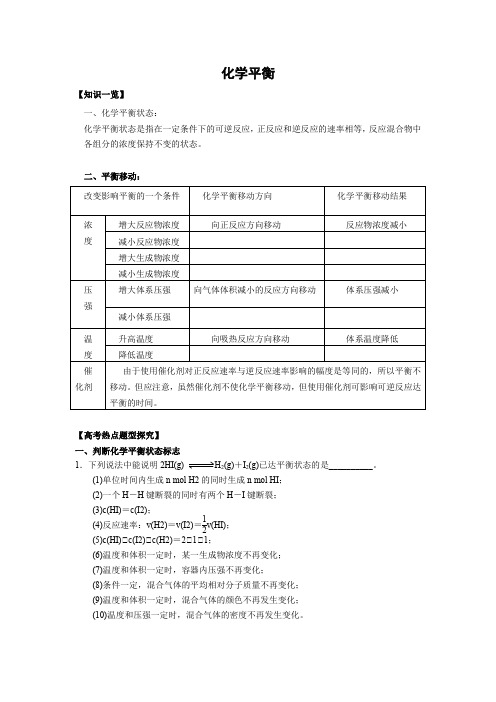
化学平衡【知识一览】一、化学平衡状态:化学平衡状态是指在一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
二、平衡移动:【高考热点题型探究】一、判断化学平衡状态标志1.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是__________。
(1)单位时间内生成n mol H2的同时生成n mol HI;(2)一个H-H键断裂的同时有两个H-I键断裂;(3)c(HI)=c(I2);(4)反应速率:v(H2)=v(I2)=12v(HI);(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;(6)温度和体积一定时,某一生成物浓度不再变化;(7)温度和体积一定时,容器内压强不再变化;(8)条件一定,混合气体的平均相对分子质量不再变化;(9)温度和体积一定时,混合气体的颜色不再发生变化;(10)温度和压强一定时,混合气体的密度不再发生变化。
2.可逆反应: 2A(气) + 3B(气)3C(气), 在 一定的条件下, 使一定量A 和B 气体反应, 达 到平衡状态时, 具有的性质是: ( )A. 各物质的浓度之比为c(A):c(B):c(C)=2:3:3B. 平衡时气体的总体积是反应开始时的3/5C. 平衡时混合物中各组份的浓度相等D. 单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C 物质 3.一定条件下的密闭容器中,可逆反应2A(g) B(g)+3C(g)在下列四种状态中处于平4.在一定容积的密闭容器中发生如下可逆反应: A(g)+2B(g)3C(g); △H >0,达到平衡的标志是: ( )A. 混合气体的压强不再变化B. 混合气体的密度不再变化C. 混合气体的物质的量不再变化D. 混合气体的温度不再变化 5.在一定的温度下的定容密闭容器中,可逆反应:H 2(g )+I 2(g)2HI(g)达到平衡的标志是( )A 、混合气体密度不变B 、混合气体颜色不变C 、混合气体压强不变D 、混合气体总物质的量不变6.在一定的温度下的定容密闭容器中,不能说明可逆反应:2NO+O 22NO 2达到平衡的标志是( )A 、混合气体密度不变B 、混合气体颜色不变C 、混合气体压强不变D 、混合气体总物质的量不变7.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应: A (s ) + 2B (g )C (g )+D (g ) 已达平衡的是 ( )A 、混合气体的压强B 、混合气体的密度C 、 B 的物质的量浓度D 、气体总物质的量二、平衡的移动:8.下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移 ① 2NO(g) + O 2(g)2NO 2 (g)②CaCO3(s)CaO(s) + CO2 (g)③H2O(g) + C (s)CO(g) + H2(g)④H2O(g) + CO(g)CO2(g) + H2(g)⑤H2S(g)H2(g) + S(s)9.在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2 + O22SO3△H<0,试回答下列问题: 生产过程中常常通入过量的空气,你认为其原因是什么?10.反应2A (g)2B (g) + E (g) △H>0达到平衡时,要使反应向正反应方向移动,应采用的措施是( )A、加压B、减压C、加入正催化剂D、升温11.已知NO2能形成二聚分子2NO2N2O4△H<0 现在要测定NO2的相对分子质量,应采用的适宜条件为()A、高温低压B、低温高压C、低温低压D、高温高压12.可逆反应H2O(g)+C(s)CO(g)+H2(g) 在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO浓度有何变化?①加入更多的碳②增加H2的浓度13.反应2A (g)2B (g) + E (g) △H>0达到平衡时,要使正反应速率下降,A的浓度增大,应采用的措施是()A、加压B、减压C、减小E的浓度D、降温14.下列事实中不能用平衡移动原理解释的是()A. 密闭、低温是存放氨水的必要条件B. 实验室用排饱和食盐水法收集氯气C. 硝酸工业生产中,使用过量空气以提高NH3的利用率D. 在FeSO4溶液中,加入铁粉以防止氧化15.对于X+Y(s)Z的平衡,若增大压强,Y的转化率增大,则X和Y的状态是( )A. X为气态,Z为固态B. X为固态,Z为气态C. X为气态,Z为气态D. X为固态,Z为固态16.某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂A ①②B ②⑤C ③⑤D ④⑥17.恒温下, 反应aX(g)bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X 的物质的量浓度由0.1mol/L 增大到0.19mol/L, 下列判断正确的是: ()A. a>b+cB. a<b+cC. a=b+cD. a=b=c 18.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g) +cW(s) ;ΔH>0下列叙述正确的是()A、加入少量W,逆反应速率增大B、当容器中气体压强不变时,反应达到平衡C、升高温度,平衡逆向移动D、平衡后加入X,上述反应的ΔH增大19.反应NH4HS(s)NH3(g)+H2S(g)在某一温度下达到平衡时,下列各种情况中,不能使平衡发生移动的是()A.移走一部分NH4HS 固体B.其他条件不变时,通SO2气体C.容器体积不变时,充入氦气D.保持压强不变时,充入氦气20.在容积一定的密闭容器中,反应2A B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是()A.正反应是吸热反应,且A不是气态B.正反应是放热反应,且A气态C.其他条件不变,加入少量C,该平衡向逆反应方向移动D.改变压强对该平衡的移动无影响21.密闭容器中,反应xA(g) + yB(g) zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。

1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。
解:错,是反应进度为ξ时,反应产物与反应物的偏摩尔吉布斯函数的代数和。
2.在恒定的温度和压力条件下,某化学反应的∆r G m就是在一定量的系统中进行1mol的化学反应时产物与反应物之间的吉布斯函数的差值。
解:错,是在大量系统中的差值。
3.因为= -RT ln K ,所以是平衡状态时的吉布斯函数变化。
解:错,达到平衡时,反应的吉布斯函数变为零。
4.是反应进度的函数。
解:错,与反应进度无关。
5.在等温等压条件下,∆r G m > 0的反应一定不能进行。
解:错,当有非体积功时,Δr G m > 0的反应可以进行,如电解冰。
6.∆r G m的大小表示了反应系统处于该反应进度ζ时反应的趋势。
解:对。
7.任何一个化学反应都可以用来判断其反应进行的方向。
解:错,只能用Δr G m ≤ 0来判断方向。
8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。
若某化学反应在给定条件下∆r G m < 0,则反应物将完全变成产物,反应将进行到底。
解:错,Δr G m < 0只是在给定反应进度那一时刻的判定条件。
当反应进行后,Δr G m会发生变化,到Δr G m = 0时达到平衡。
一般情况下反应物不可能都变成产物。
9.在等温、等压不作非体积功的条件下,反应的∆ r G m < 0时,若值越小,自发进行反应的趋势也越强,反应进行得越快。
解:错,热力学中无时间量,因而无快慢。
10.某化学反应的∆ r G m若大于零,则K 一定小于1。
解:错,K 由决定。
11.理想气体反应A + B = 2C,当p A = p B = p C时,的大小就决定了反应进行方向。
解:对。
12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。
解:对。
13.在给定温度和压力下发生的PCl5的分解反应,只须测定平衡时混合气体的密度就可以求知平衡常数了。

高中化学化学平衡单元测试及参考答案2023一、选择题1. 下列哪个说法关于化学平衡是正确的?A. 反应物和生成物浓度相等时达到化学平衡B. 化学平衡只能在恒定温度下发生C. 化学平衡只涉及液相反应D. 化学平衡不受压力的影响参考答案:B2. 化学平衡与下列哪个物质浓度无关?A. 反应物浓度B. 生成物浓度C. 压力D. 溶液酸碱度参考答案:C3. 在化学平衡条件下,下列哪个因素的改变不会引起平衡位置的移动?A. 反应物浓度改变B. 温度改变C. 压力改变D. 催化剂的添加参考答案:D4. 下列哪个说法关于平衡常数是正确的?A. 反应物之间的惰性气体浓度不影响平衡常数B. 平衡常数的值可以通过改变反应温度来改变C. 反应速率与平衡常数无关D. 将反应物浓度加倍会使平衡常数增大一倍参考答案:B5. 在化学平衡下,添加一个产生反应物的化学物质会导致下列哪项结果?A. 反应向左移动B. 反应向右移动C. 平衡不受影响D. 环境温度升高参考答案:B二、填空题1. 在下列反应中,是那一种气体对平衡常数的测定比较有用?A. CO2B. O2C. N2D. H2参考答案:A2. 当浓度倍增时,平衡常数的值是原来的多少倍?参考答案:4倍3. 铵离子和硝酸根离子生成硝酸铵的方程式是什么?参考答案:NH4+ + NO3- → NH4NO34. 当温度升高时,正面熵变更大的反应朝哪个方向移动?参考答案:正面熵变更大的反应朝右方移动三、计算题1. 对于以下反应:2A + B ⇌ 3C + D,已知反应物的浓度为[A] = 0.2 mol/L,[B] = 0.3 mol/L,生成物的浓度为[C] = 0.4 mol/L,[D] = 0.1 mol/L。
求平衡常数Kc的值。
参考答案:Kc = ([C]^3[D])/([A]^2[B]) = (0.4^3 * 0.1)/(0.2^2 * 0.3) = 2.672. 以下反应在特定温度下处于平衡:2SO2(g) + O2(g) ⇌ 2SO3(g)。

化学平衡复习题一、判断题:1、H3PO4溶液中,c (PO43- ) = K(H3PO4 ) mol·L-1。
.................................................()2、催化剂只能改变反应的活能,不能改变反应的热效应。
........................................()3、由CaCO3和CaO 构成的封闭系统,在任何条件下都不能使反应CaCO3 (s) CaO (s) + CO2 (g) 达到平衡。
................................................................()3、MnS (s) + 2 HAc Mn2+ + 2 Ac- + H2 S 反应的标准平衡常数K= K( MnS )·[ K( HAc ) ]2 / [ K( H2S )·K( H2S ) ]。
............. ()4、密闭容器中,A、B、C 三种气体建立了如下平衡:A (g) + B (g) C (g),若保持温度不变,系统体积缩小至原体积的2时,则反应商Q与平衡常数的关系3是:Q = 1.5 K。
..........................................................................()5、根据同离子效应,沉淀剂加入越多,其离子沉淀越完全。
. ()6、在一定温度下,随着可逆反应2SO2 (g) + O2 (g) 2SO3 (g) 的进行,p (O2 )、p (SO2 ) 不断减少,p (SO3 ) 不断增大,所以标准平衡常数K不断增大。
.....................................()二.选择题:1、在一恒压容器中,某温度、100.0 kPa 条件下,将1.00 mol A 和2.00 mol B 混合,按下式反应:A (g) + 2B (g) C (g)。

⼤学⽆机化学第四章试题及答案第四章化学平衡本章总⽬标:1:了解化学平衡得概念,理解平衡常数得意义;2:掌握有关化学平衡得计算;3:熟悉有关化学平衡移动原理。
各⼩节⽬标:第⼀节:化学平衡状态1:熟悉可逆反应达到平衡得特征——反应体系中各种物质得⽣成速率分别等于其消耗得速率,各种物质得浓度将不再改变。
2:了解平衡常数、平衡转化率这两个概念得意义。
第⼆节:化学反应进⾏得⽅向学会运⽤标准平衡常数判断化学反应得⽅向:时,反应向逆向进⾏。
向正反应⽅向进⾏。
时体系达到平衡状态。
第三节;标准平衡常数与得关系1:掌握化学反应等温式(),当体系处于平衡状态得时候。
2:重点掌握运⽤公式进⾏热⼒学数据之间得计算。
第四节:化学平衡得移动1:熟悉温度、浓度、压强对化学平衡得影响,2:熟练地根据条件得改变判断平衡移动得⽅向。
习题⼀选择题1、可逆反应达平衡后,若反应速率常数k发⽣变化,则标准平衡常数( )(《⽆机化学例题与习题》吉⼤版)A、⼀定发⽣变化B、⼀定不变C、不⼀定变化D、与k⽆关2、反应:2CO(g)+O2(g)2CO2(g)在300K时得Kc与Kp得⽐值约为( )A、25B、2500C、2、2D、0、043、反应得温度⼀定,则下列得陈述中正确得就是( )(《⽆机化学例题与习题》吉⼤版)A、平衡常数能准确代表反应进⾏得完全程度B、转化率能准确代表反应进⾏得完全程度C、平衡常数与转化率都能准确代表反应进⾏得完全程度D、平衡常数与转化率都不能代表反应进⾏得完全程度4、相同温度下:2H2(g)+S2(g)2H2S(g) Kp12Br2(g)+2H2S(g)4HBr+S2(g) Kp2H2(g)+Br2(g)2HBr(g) Kp3则Kp2等于( )A、Kp1? Kp3B、(Kp3)2/ Kp1C、2Kp1? Kp3D、Kp3/ Kp15、下列反应中,K?得值⼩于Kp值得就是( )(《⽆机化学例题与习题》吉⼤版)A、H2(g)+Cl2(g)== 2HCl(g)B、2H2(g)+S(g)== 2H2S(g)C、 CaCO3(s) == CaO(s)+CO2(g)D、C(s)+O2(g)== CO2(g)6、N2(g)+3H2(g)2NH3(g),H=-92、4KJ?mol-1,473K时,三种混合⽓体达平衡。
第四章 化学平衡一、基本公式和内容提要 1. 化学反应的方向和限度(1)反应系统的吉布斯自由能和反应进度反应进行过程中,A 和B 均各以纯态存在而没有相互混合,则在反应进度为ξ时反应体系的总吉布斯自由能G *为:G * = n A μA * + n B μB * = (1-ξ)μA * +ξμB * = μA * +ξ(μB * -μA *)对于封闭体系在定温定压下在反应实际进行过程中,A 和B 是不可能以纯态存在的。
它们是混合在一起的,因此还存在混合吉布斯自由能△mix G 。
△mix G = RT (n A lnX A + n B lnX B ) = RT [(1-ξ)ln(1-ξ) + ξlnξ](2)化学反应标准平衡常数理想气体的化学反应()()()()aA g bB g gG g hH g −−→++←−− bB a A hH gG P P P P P P P P )/()/()/()/(θθθθ= e )--(1θθθθμμμμB A H G b a h g RT-+= 常数 = K θK θ称为标准平衡常数。
(3)化学反应的等温方程式(a )对任意反应达平衡时:△r G m θ = -RTlnK θ△r G m θ是指产物和反应物均处于标准态时,产物的吉布斯自由能和反 应物的吉布斯自由能总和之差,称为反应的“标准吉布斯自由能变化”。
(b )反应在定温定压条件下△r G m = △r G m θ+ RT ln Q p上式称为范特霍夫(Vait Hoff) 等温方程。
(c )依据吉布斯自由能函数可判断反应进行的方向,在温度、压力一定的条件下:RT ln Q a < RTlnK θ Q a <K θ △r G m <0 反应正向自发进行 若 RT ln Q a >RTlnK θ Q a >K θ △r G m >0 反应逆向自发进行若 RT ln Q a = RTlnK θ Q a = K θ △r G m =0 反应达平衡 2. 反应的标准吉布斯自由能变化 (1)化学反应的△r G m 与△r G m θ(a )在一定温度和压力为p θ下,任何物质的标准态化学势μi θ都有确定值,所以任何化学反应的△r G m θ都是常数;(b )△r G m 不是常数,在一定T ,p 下,它与各物质的活度(分压、浓度)等有关,即与Q a 有关;(c )在定温定压条件下0W '=时,△r G m 的正负可以指示化学反应自发进行的方向,在定温下△r G m θ的正负通常不能指示反应进行的方向,根据公式△r G m = △r G m θ+ RT ln Q p ,但当△r G m θ的数值很大时,也可用其值估计反应的方向。
第四章 化学平衡练习题一、判断与问答题:1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。
2.在恒定的温度和压力条件下,某化学反应的∆r G m 就是在一定量的系统中进行1mol 的 化学反应时产物与反应物之间的吉布斯函数的差值。
3.因为m r G ∆= -RT ln K ,所以m r G ∆是平衡状态时的吉布斯函数变化。
4.m r G ∆是反应进度的函数。
5.在等温等压条件下,∆r G m > 0的反应一定不能进行。
6.∆r G m 的大小表示了反应系统处于该反应进度ζ时反应的趋势。
7.任何一个化学反应都可以用m r G ∆来判断其反应进行的方向。
8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。
若某化 学反应在给定条件下∆r G m < 0,则反应物将完全变成产物,反应将进行到底。
9.在等温、等压不作非体积功的条件下,反应的∆ r G m < 0时,若值越小,自发进行反应 的趋势也越强,反应进行得越快。
10.某化学反应的∆ r G m 若大于零,则K 一定小于1。
11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,m r G ∆的大小就决定了反应进行方向。
12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。
13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度就可 以求知平衡常数了。
14.因 K = f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。
15.若已知某气相生成反应的平衡组成,则能求得产物的m r G ∆。
16.温度T 时,若K = l ,说明这个反应在此温度,压力为100kPa 的条件下已达到平衡。
17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
18.因K = ∏(a B ν),所有化学反应的平衡状态随化学反应计量系数而改变。
化学平衡复习题及答案化学平衡是化学中一个重要概念,涉及到反应物和生成物在一定条件下达到动态平衡的状态。
以下是一些化学平衡的复习题及答案,以帮助学生更好地理解和掌握这一概念。
题目一:定义题什么是化学平衡?答案一:化学平衡是指在一个封闭系统中,正向反应和逆向反应以相同的速率进行,系统内各组分的浓度保持不变的状态。
题目二:计算题在一定温度下,一个反应体系中,A和B反应生成C和D。
已知初始时[A] = 0.1 mol/L,[B] = 0.2 mol/L,[C] = [D] = 0。
反应达到平衡时,[C] = 0.05 mol/L。
假设反应的化学方程式为:\[ A + B \rightleftharpoons C + D \]求平衡时[A]、[B]、[D]的浓度。
答案二:根据平衡时[C] = 0.05 mol/L,可以推断出[A]和[B]各消耗了0.05 mol/L。
因此,平衡时[A] = 0.1 - 0.05 = 0.05 mol/L,[B] = 0.2 - 0.05 = 0.15 mol/L。
由于反应是1:1进行的,[D]的浓度也将是0.05 mol/L。
题目三:理解题为什么在化学平衡中,正向反应和逆向反应的速率相等时,并不意味着反应已经停止?答案三:在化学平衡中,正向反应和逆向反应的速率相等意味着它们以相同的速率进行,但这并不意味着反应停止。
实际上,反应物和生成物仍然在不断地转化,只是转化的速率保持恒定,因此宏观上看起来像是反应停止了。
题目四:判断题如果在一个化学平衡体系中增加反应物的浓度,平衡会向哪个方向移动?答案四:根据勒夏特列原理,增加反应物的浓度会使平衡向生成物的方向移动,以减少系统的压力或浓度差。
题目五:应用题在工业生产中,如何通过调节外界条件来提高某一化学反应的产率?答案五:可以通过以下方式提高化学反应的产率:1. 增加反应物的浓度。
2. 减少生成物的浓度,例如通过连续移除生成物。
3. 改变温度,通常升高或降低温度可以使平衡向吸热或放热的方向移动。
1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。
解:错,是反应进度为ξ时,反应产物与反应物的偏摩尔吉布斯函数的代数和。
2.在恒定的温度和压力条件下,某化学反应的∆r G m就是在一定量的系统中进行1mol的化学反应时产物与反应物之间的吉布斯函数的差值。
解:错,是在大量系统中的差值。
3.因为= -RT ln K ,所以是平衡状态时的吉布斯函数变化。
解:错,达到平衡时,反应的吉布斯函数变为零。
4.是反应进度的函数。
解:错,与反应进度无关。
5.在等温等压条件下,∆r G m > 0的反应一定不能进行。
解:错,当有非体积功时,Δr G m > 0的反应可以进行,如电解冰。
6.∆r G m的大小表示了反应系统处于该反应进度ζ时反应的趋势。
解:对。
7.任何一个化学反应都可以用来判断其反应进行的方向。
解:错,只能用Δr G m ≤ 0来判断方向。
8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。
若某化学反应在给定条件下∆r G m < 0,则反应物将完全变成产物,反应将进行到底。
解:错,Δr G m < 0只是在给定反应进度那一时刻的判定条件。
当反应进行后,Δr G m会发生变化,到Δr G m = 0时达到平衡。
一般情况下反应物不可能都变成产物。
9.在等温、等压不作非体积功的条件下,反应的∆ r G m < 0时,若值越小,自发进行反应的趋势也越强,反应进行得越快。
解:错,热力学中无时间量,因而无快慢。
10.某化学反应的∆ r G m若大于零,则K 一定小于1。
解:错,K 由决定。
11.理想气体反应A + B = 2C,当p A = p B = p C时,的大小就决定了反应进行方向。
解:对。
12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。
解:对。
13.在给定温度和压力下发生的PCl5的分解反应,只须测定平衡时混合气体的密度就可以求知平衡常数了。
解:对。
14.因K = f(T),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。
解:错。
平衡组成与压力和惰性组分有关。
15.若已知某气相生成反应的平衡组成,则能求得产物的。
解:对。
16.温度T时,若K = l,说明这个反应在此温度,压力为100kPa的条件下已达到平衡。
解:错。
17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
解:错,改变压力和惰性组分也可使平衡移动。
18.因K= ∏(a Bν) ,所有化学反应的平衡状态随化学反应计量系数而改变。
解:错,平衡状态与方程式的书写方式无关。