果胶酶活性的检测
- 格式:docx
- 大小:21.38 KB
- 文档页数:4

[原理]果胶物质主要存在于植物初生壁和细胞中间,果胶物质是细胞壁的基质多糖。
果胶包括两种酸性多糖(聚半乳糖醛酸、聚鼠李半乳糖醛酸)和三种中性多糖(阿拉伯聚糖、半乳聚糖、阿拉伯半乳聚糖)。
果胶酶本质上是聚半乳糖醛酸水解酶,果胶酶水解果胶主要生成β-半乳糖醛酸,可用次碘酸钠法进行半乳醛酸的定量,从而测定果胶酶活力。
果胶酶活力单位定义]1g(或1ml液体酶)酶粉,于50.0℃、pH3.5条件下,每分钟催化果胶水解生成1微克半乳糖醛酸的酶量为一个活力单位。
1. 试剂和仪器*本标准所使用所有的试剂若无任何说明,均为分析纯1.1 醋酸1.2 碘1.3 碘花钾1.4 浓硫酸1.5 果胶(sigma公司)1.6 硫代硫酸钠1.7 碳酸钠1.8 可溶性淀粉1.9 水浴锅1.10 碘量瓶2. 试剂的制备2.1 pH3.5的酸水用醋酸将蒸馏水调至3.52.2 1%果胶溶液:准确称取分析纯果胶1g,用酸水溶解煮沸,冷却后过滤,定至100ml。
2.2 0.1N碘液:准确称取碘化钾5g,用蒸馏水溶解后,加入2.54g碘,溶解后定容至100ml。
2.3 0.025mol/L硫代硫酸钠:准确称取6.2g硫代硫酸钠,加蒸馏水后定容至1L2.4 0.5%可溶性淀粉指示剂:准确称取可溶性淀粉0.5g放入沸水中消煮至透明。
2.5 1M碳酸钠溶液:准确称取10.6g碳酸钠,定容于100ml的水中2.6 2N硫酸:吸10ml的浓硫酸倒入170ml的水中2.7 酶样的制备准确称取1.000g固体酶或移取1ml液体酶样,定容至100ml,于50℃水浴浸取1小时,过滤,滤液为供试酶液。
则该酶已经稀释100倍。
3. 程序3.1 取1%果胶酶10ml加入5ml酶液和5ml蒸馏水(PH3.5),在50℃水浴中保温反应1小时。
3.2 取出后加热煮沸2~3min,冷却后,补水至20ml。
3.3 取5ml反应液于100ml碘量瓶中,加1M碳酸钠溶液1ml,0.1N碘液5ml,摇匀,具塞,于室温暗处下放置20min。

课题1 果胶酶在果汁生产中的作用一、选择题1.下列与酶的活性有关的说法不准确的是( A )A.酶的活性是由蛋白质结构决定的,不受外界条件的影响B.酶的活性是指酶催化一定化学反应的能力C.酶的活性受温度、pH等因素的影响D.酶活性的高低与反应物浓度无关[解析]酶的活性是由蛋白质的结构决定的,不同酶的结构不同,活性也不同;同时酶的活性又受外界条件的影响,如温度、pH和酶的抑制剂等条件都会影响酶的活性;在其他条件不变时,一定X围内反应速度随底物浓度的增加而加快,当底物浓度达到一定限度时,反应速度不再变化,即反应速度大小与反应物浓度有关,但是酶活性高低与反应物浓度无关。
2.下列关于果胶酶的说法错误的是( C )A.果胶酶的活性是指一定量的果胶酶催化一定量的果胶进行化学反应的能力B.温度、pH和酶的抑制剂等条件会影响果胶酶的活性C.果胶酶能催化果胶分解,但不能提高水果的出汁率,只能使果汁变得澄清D.生产果汁时,为了使果胶酶得到充分的利用,节约成本,需要控制好酶的用量[解析]果胶酶不仅能使果汁变得澄清,而且还能提高水果的出汁率。
3.一般不作为果胶酶活性检测指标的是( D )A.等量的果泥产生等量的果汁所用的时间B.等量的果泥在相同时间内的出汁量C.等量的果泥在相同时间内的澄清度D.等量的果泥在相同时间内产生气泡的数量[解析]果胶酶把果胶分解为可溶性的半乳糖醛酸,能使果汁变得澄清,也能提高出汁率,所以果汁的澄清度、出汁量以及果汁的产出时间都可作为果胶分解速率即果胶酶活性的检测指标。
果胶被果胶酶分解的过程中不产生气泡。
4.探究温度对果胶酶活性影响的实验中,得到如下实验结果。
据此分析不正确的是( C )温度30 35 40 45 50 55 60 65 70 75 80 (℃)A.实验过程中应先将苹果泥和果胶酶分别调节到对应温度后再混合B.为了实验结果的科学性,各组混合处理时间和过滤果汁时间均应相同C.应在50~55 ℃之间设置更细温度梯度进行实验探究果胶酶的最适温度D.该实验结果表明高温能使果胶酶失活,但高温也可能促进果胶分解[解析]实验过程中应先将苹果泥和果胶酶分别调节到对应温度后再混合,A正确;为了实验结果的科学性和控制单一变量,各组混合处理时间和过滤果汁时间均应相同,B正确;实验中的温度梯度跨度较大,要想确定最适温度,需要设置更细温度梯度进行实验,分析数据,应该在45~55 ℃(或45~60 ℃)之间设置更细温度梯度进行实验探究果胶酶的最适温度,C 错误;高温可以使酶失活,由表格数据可以看出,高温也可能促进果胶分解,D正确。


1果胶酶酶活力测定方法果胶酶降解底物的糖苷键,生成含还原端基产物,故采用常用的还原糖测定法—DNS 法。
1.1 测定原理果胶酶在一定条件下水解底物果胶,生成半乳糖醛酸等醛糖,醛糖与3,5—二硝基水杨酸共热产生棕红色的氨基化合物, 在一定范围内还原糖的量和含有呈色氨基化合物的反应液颜色深浅成正比,在540 nm 下测其吸光度,从而计算出果胶酶酶活。
·酶活性单位定义:在上述测定条件下,以每分钟水解底物生成1 μg 还原糖所需酶量定义为一个酶活性单位,单位为U/mL。
1.2 DNS 试剂用400 mL 蒸馏水溶解6.3 g 3,5-二硝基水杨酸,逐步加入21 g 氢氧化钠,再加入185 g 四水合酒石酸钾钠(C4H4O6KNa-4H2O)、5.0 g 苯酚、5.0 g 无水亚硫酸钠,温水浴(不超过48 ℃),不断搅拌,直至溶液清澈透明。
用蒸馏水定容至1000 mL,保存在棕色瓶中,与二氧化碳隔绝,静置5~7 d 后使用,贮存期为6 个月。
1.3 pH 7.0 的磷酸—柠檬酸缓冲溶液参见《现代生化技术》,取Na2HPO4·12H2O 71.62g、C6H8O7·H2O 21.01 g,分别定容到1000 mL,按16.47:3.53 的体积比混合,即可。
1.4 底物的配制称取1.00 g 果胶,用pH 7.0 的缓冲溶液溶解,于磁力搅拌器上恒速搅拌0.5 h,用缓冲溶液定容至100 mL。
存放在0~4 ℃冰箱里。
1.5 粗酶液的制备取发酵液,于10000 r/min,4 ℃离心5 min 后,取上清液即为酶液。
2酶学性质分析2.1 酶的最适温度在45 ℃、50 ℃、55 ℃、60 ℃、65 ℃,pH 7.0的条件下,反应30 min,测定果胶酶酶活。
以最大的酶活的活力为100%,其他的以它的百分比计。
2.2 酶的最适pH在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0(pH≤8.0的用磷酸氢二钠- 柠檬酸缓冲液,pH>8.0 的用甘氨酸-氢氧化钠缓冲液),最适温度的条件下,反应30 min,测定果胶酶酶活。



分光光度计法测定果胶酶活力的方法研究果胶酶是指分解果胶质的多种酶的总称,它可分为内切型和外切型两大类。
果胶酶广泛应用于果品的加工工业中,主要作用是果品榨汁时降低果浆泥的粘稠度,提高榨汁效率、出汁率、果汁澄清度和稳定性等。
果胶酶的活力对果品的加工品质影响很大,因此测定果胶酶的活力显得尤为重要。
测定酶活力的方法主要有还原法、色原底物法、粘度法等,其中还原法中的3,5一二硝基水杨酸比色法(简称DNS法)具有操作简便,对试剂、仪器等条件要求不高等优点。
该方法是利用果胶酶在一定温度、时间和条件下水解果胶,释放出还原性D一半乳糖醛酸,与3,5一二硝基水杨酸共热产生棕红色的氨基化合物,即发生显色反应。
在一定范围内,水解生成D一半乳糖醛酸的量与吸光度成正比,与果胶酶活力成正比,通过分光光度计测定吸光度,可以计算出果胶酶的活力。
该方法(又称分光光度计法)简单易行,但操作中影响因素较多,往往影响测定结果的准确性。
本研究就测定中各影响因素进行了优化实验,试图提出果胶酶活力测定的最佳技术参数。
1 材料与方法1.1 材料与仪器乙酸钠(CH3 C00Na·3H2O)、冰乙酸(CH3C00H)、氢氧化钠、无水亚硫酸钠、酒石酸钾钠(C 4H4KNaO6.4H2O)、苯酚以上试剂均为市售分析纯;3,5一二硝基水杨酸国药集团化学试剂有限公司;D一半乳糖醛酸97%,沃凯化学试剂有限公司;果胶、果胶酶天津利华酶制剂厂生产;实验用水均为去离子水。
TU一1810紫外分光光度计北京普析;电热恒温水浴锅上海宝磊。
1.2 实验方法1.2.1 试剂配制1.2.1.1 乙酸一乙酸钠缓冲溶液(pH4.8) 首先制备0.2mol/L 的乙酸溶液和0.2mol /L 的乙酸钠溶液,然后将0.2mol/L 乙酸溶液410.0mL 与0.2mol/L 乙酸钠溶液59 0.0mL混合均匀,用酸度计测定。
1.2.1.2 DNS试剂(3g/L) 称取3.00g 3,5一二硝基水杨酸,溶解于500mL蒸馏水中,再逐步加入10.4gNaOH、9l、0g C4H4KNaO6.4H2O、2.5g苯酚和2.5g无水亚硫酸钠,温水浴(不超过4 8oC)中不断搅拌,直至溶液清澈透明。


果胶酶测定方法“哎呀,这水果怎么这么难弄啊!”我看着手中的水果,不禁发起了牢骚。
“怎么啦?”妈妈笑着走过来,“这就不耐烦啦?”“可不是嘛,我想做点果酱,这果胶也太难处理了。
”我无奈地摇摇头。
“哈哈,那你可就不知道了吧,有一种东西叫果胶酶,可以帮你解决这个问题哦。
”妈妈神秘地说道。
果胶酶测定方法其实并不复杂。
首先呢,要准备好需要的材料和试剂,比如标准果胶溶液、DNS 试剂、缓冲液等等。
然后就是具体的步骤啦,先取适量的酶液,加入到含有果胶的反应体系中,在一定温度下保温一段时间。
接下来,加入 DNS 试剂终止反应,再通过沸水浴显色。
最后呢,用分光光度计测定吸光度,就可以计算出果胶酶的活性啦。
这里面可有不少注意事项呢!比如说,在操作过程中要严格控制温度和时间,不然结果可就不准确啦。
还有啊,试剂的用量也要精确,可不能马虎哦。
那果胶酶有啥应用场景和优势呢?这你可就问对啦!果胶酶在食品工业中可是大有用处呢,像制作果汁、果酱、果酒这些,都能让产品的口感更好,品质更优。
而且它还能提高生产效率,降低成本,多好呀!我就给你讲个实际案例吧。
之前我们隔壁的叔叔家开了个小果酱厂,一开始他们做出来的果酱总是不够细腻,口感也不太好。
后来他们了解到果胶酶,就试着在生产过程中使用,哇,效果简直太明显啦!做出来的果酱那叫一个细腻顺滑,销量都大增了呢。
“哇,听起来好厉害啊!”我不禁感叹道。
“是呀,所以说科技的力量是很强大的。
”妈妈笑着说。
我在心里暗暗想,以后我也要好好研究这些东西,说不定我也能做出超棒的食品呢。
想想看,要是没有这些科学的测定方法和应用,我们的生活该少了多少乐趣和便利呀。
就像我们吃的那些美味的食品,如果没有果胶酶这样的好帮手,可能就没有那么美味啦。
这就好像是一场奇妙的化学反应,把各种元素组合在一起,就产生了意想不到的效果。
所以说呀,我们可不能小看这些小小的酶,它们可是有着大大的能量呢!我现在对果胶酶测定方法充满了好奇和探索的欲望,我要赶紧去试试,看看我能不能也成为一个小小的“果胶酶专家”。
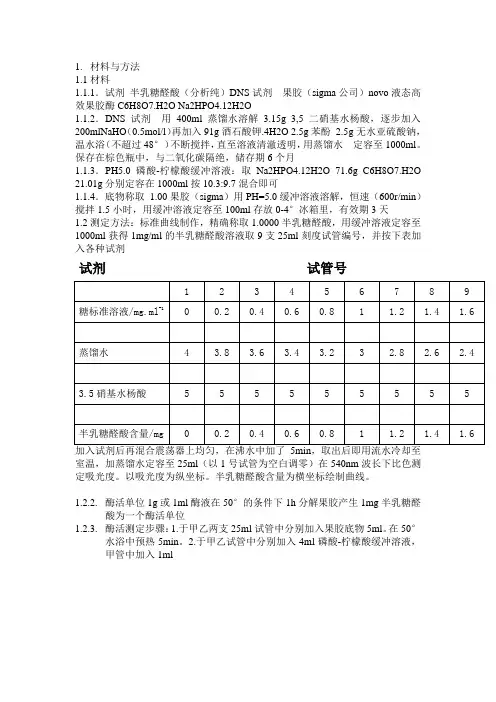
1.材料与方法
1.1材料
1.1.1.试剂半乳糖醛酸(分析纯)DNS试剂果胶(sigma公司)novo液态高效果胶酶C6H8O7.H2O Na2HPO4.12H2O
1.1.2.DNS试剂用400ml蒸馏水溶解3.15g 3,5二硝基水杨酸,逐步加入200mlNaHO(0.5mol/l)再加入91g酒石酸钾.4H2O
2.5g苯酚2.5g无水亚硫酸钠,温水浴(不超过48°)不断搅拌,直至溶液清澈透明,用蒸馏水定容至1000ml。
保存在棕色瓶中,与二氧化碳隔绝,储存期6个月
1.1.3.PH5.0磷酸-柠檬酸缓冲溶液:取Na2HPO4.12H2O 71.6g C6H8O7.H2O 21.01g分别定容在1000ml按10.3:9.7混合即可
1.1.4.底物称取1.00果胶(sigma)用PH=5.0缓冲溶液溶解,恒速(600r/min)搅拌1.5小时,用缓冲溶液定容至100ml存放0-4°冰箱里,有效期3天
1.2测定方法:标准曲线制作,精确称取1.0000半乳糖醛酸,用缓冲溶液定容至1000ml获得1mg/ml的半乳糖醛酸溶液取9支25ml刻度试管编号,并按下表加入各种试剂
试剂试管号
室温,加蒸馏水定容至25ml(以1号试管为空白调零)在540nm波长下比色测定吸光度。
以吸光度为纵坐标。
半乳糖醛酸含量为横坐标绘制曲线。
酶活单位1g或1ml酶液在50°的条件下1h分解果胶产生1mg半乳糖醛酸为一个酶活单位
酶活测定步骤:1.于甲乙两支25ml试管中分别加入果胶底物5ml。
在50°水浴中预热5min。
2.于甲乙试管中分别加入4ml磷酸-柠檬酸缓冲溶液,甲管中加入1ml。
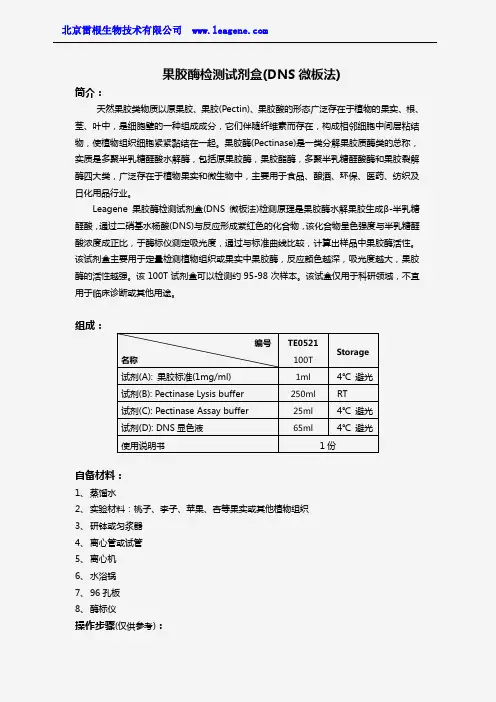
果胶酶检测试剂盒(DNS 微板法)简介:天然果胶类物质以原果胶、果胶(Pectin)、果胶酸的形态广泛存在于植物的果实、根、茎、叶中,是细胞壁的一种组成成分,它们伴随纤维素而存在,构成相邻细胞中间层粘结物,使植物组织细胞紧紧黏结在一起。
果胶酶(Pectinase)是一类分解果胶质酶类的总称,实质是多聚半乳糖醛酸水解酶,包括原果胶酶,果胶酯酶,多聚半乳糖醛酸酶和果胶裂解酶四大类,广泛存在于植物果实和微生物中,主要用于食品、酿酒、环保、医药、纺织及日化用品行业。
Leagene 果胶酶检测试剂盒(DNS 微板法)检测原理是果胶酶水解果胶生成β-半乳糖醛酸,通过二硝基水杨酸(DNS)与反应形成紫红色的化合物,该化合物呈色强度与半乳糖醛酸浓度成正比,于酶标仪测定吸光度,通过与标准曲线比较,计算出样品中果胶酶活性。
该试剂盒主要用于定量检测植物组织或果实中果胶酶,反应颜色越深,吸光度越大,果胶酶的活性越强。
该100T 试剂盒可以检测约95-98次样本。
该试盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 蒸馏水2、 实验材料:桃子、李子、苹果、杏等果实或其他植物组织3、 研钵或匀浆器4、 离心管或试管5、 离心机6、 水浴锅7、 96孔板8、 酶标仪操作步骤(仅供参考):编号 名称TE0521 100T Storage试剂(A): 果胶标准(1mg/ml) 1ml 4℃ 避光 试剂(B): Pectinase Lysis buffer 250ml RT 试剂(C): Pectinase Assay buffer 25ml 4℃ 避光 试剂(D): DNS 显色液 65ml4℃ 避光 使用说明书1份1、果胶酶提取:取果实或其他植物组织,洗净,擦干,称取剪碎的新鲜样品,置于提前4℃预冷的研钵或匀浆器,加入预冷的Pectinase Lysis buffer,充分研磨或匀浆后转入离心管或试管,离心。
果胶酶活性检测试剂盒说明书可见分光光度法货号:UPLC-MS-4140规格:50T/24S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件提取液液体50mL×1瓶4℃保存试剂一液体40mL×1瓶4℃保存试剂二液体40mL×1瓶4℃保存标准品粉剂×1支4℃保存溶液的配制:1、试剂一:若溶液中有不溶解物质,可以50℃水浴溶解。
2、标准品:10mg半乳糖醛酸。
临用前加入0.943mL蒸馏水,配成50μmol/mL的标准液。
产品说明:果胶酶(pectinase)是分解果胶的酶类,包括原果胶酶,果胶酯酶,多聚半乳糖醛酸酶和果胶裂解酶四大类,广泛存在于高等植物果实和微生物中,是水果加工中最重要的酶。
果胶酶水解果胶生成半乳糖醛酸,半乳糖醛酸与DNS试剂反应生成在540nm有特征吸收峰的棕红色物质,测定540nm处吸光值变化可计算得果胶酶活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、台式离心机、水浴锅、1mL玻璃比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后10000g,4℃,离心10min,取上清置于冰上待测。
2、菌类:按照细菌数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌加入1mL 提取液),冰浴超声波破碎细菌(功率300w,超声3秒,间隔7秒,总时间3min);然后10000g,4℃,离心10min,取上清置于冰上待测。
3、液体:直接检测。
二、测定步骤1、可见分光光度计预热30min以上,调节波长至540nm,蒸馏水调零。
一、实验设计实验序号实验三实验名称特定产物工业生产菌种发酵试验时间2010年13日-23日实验室基础生物2(121)一、实验目的1、掌握菌种选育、菌种发酵条件的优化和微生物酶制剂酶活测定的基本方法;2、了解酶学性质的研究.3、了解影响果胶酶对果汁澄清效果的各种因素二、实验与原理1、果胶酶概况(1)、果胶质:是高等植物细胞壁内及细胞壁间的结构性多糖,是一类高分子碳水化合物,它的存在往往给果蔬加工等工艺带来许多麻烦和损失。
(2)、果胶酶:是指能分解果胶质的多种酶的总称,广泛存在于高等植物和微生物中。
(3)、产生果胶酶的微生物:细菌、放线菌、酵母和霉菌,但目前商品果胶酶多数来自霉菌。
(4)、果胶酶的应用:主要是用于果胶的分解,在水果加工、葡萄酒生产、麻类脱胶和饲料等方面有着广泛的应用。
2、果胶酶的酶活测定方法(1)、粘度降低法:利用粘度计测量在一定温度、酶浓度和一定反应时间内,标准果胶溶液的粘度降低值。
(2)、脱胶作用时间法:以脱胶作用的时间来测定果胶酶的酶活力。
(3)、次亚碘酸法:用滴定法定量测定半乳糖醛酸的生成量,以表示果胶酶的活力。
(4)、还原糖法(DNS法):根据果胶酶水解果胶生成半乳糖醛酸,后者是一种还原糖,与3,5 -二硝基水杨酸共热后被还原成棕红色的氨基化合物,在一定的范围内,还原糖的量和反应液的颜色呈比例关系,可利用比色法在540nm进行测定。
3、微生物发酵生产产品受以下条件制约:(1)、培养基成分:C源、N源、无机盐、水和生长因子(2)、培养条件:温度、pH、溶解氧等(3)、附加条件:诱导物、表面活性剂等4、酶催化反应的进行受多种因素的影响:底物浓度、酶浓度、温度、pH、激活剂、抑制剂三、设备与材料(一)、培养基1、菌种筛选使用培养基(1)、基本培养基:果胶1% 、磷酸氢二钠0.5%、蛋白胨1%、pH4.5、琼脂2.0%。
(2)、分离培养基:果胶0.5%、磷酸氢二钠0.5%、琼脂2.0%、H4.5。
果胶酶高产菌株筛选发酵条件优化以及酶学性质的研究果胶酶是一种重要的工业酶,具有广泛的应用前景。
为了提高果胶酶的产量,本研究旨在筛选果胶酶高产菌株,并优化其发酵条件,同时对其酶学性质进行研究。
首先,我们从自然环境中采集了一系列样品,包括土壤和水体样品。
然后,将这些样品进行稀释并接种到含有果胶为唯一碳源的培养基中。
经过连续传代和筛选,最终从中获得了一株具有较高果胶酶活性的菌株A。
接下来,为了优化菌株A的发酵条件,我们设计了一系列实验。
首先是培养基的优化。
我们通过改变碳源、氮源和矿物盐等成分的浓度和组合,最终确定了一种最适合菌株A生长和果胶酶产量的培养基配方。
然后,对于菌株A的培养条件进行了进一步的优化。
我们调整了温度、pH值、培养时间和初始菌体浓度等参数,并通过检测果胶酶活性来评估不同条件下的产酶效果。
最终,找到了最适宜的发酵条件,菌株A在这种条件下果胶酶的产量显著提高。
接下来,我们对菌株A产生的果胶酶进行了酶学性质的研究。
首先是酶活温度和酶活pH的测定。
我们利用不同温度和不同pH值下的底物降解实验,确定了菌株A产生的果胶酶的最适活性温度和最适活性pH。
然后,对菌株A产生的果胶酶进行了酶动力学性质的研究。
我们通过测定果胶酶对果胶的降解效果,建立了不同底物浓度下果胶酶的反应速率曲线,并利用Michaelis-Menten方程对其进行了分析。
最后,我们对菌株A产生果胶酶的产酶机制进行了初步探究。
通过基因组测序和蛋白质组学技术的应用,我们发现菌株A产生果胶酶的基因和调控机制,为进一步提高果胶酶产量和改良菌株奠定了基础。
总结而言,本研究通过筛选果胶酶高产菌株并优化发酵条件,成功提高了果胶酶的产量。
同时,对果胶酶的酶学性质进行了深入研究,探究了其最适工作温度、pH值以及底物浓度对酶活性的影响。
通过对产酶机制的初步探究,为今后果胶酶的应用及菌株改良提供了一定的参考依据综上所述,本研究通过对菌株A产生的果胶酶进行了全面的酶学性质和酶动力学性质的研究,同时对其产酶机制进行了初步探究。
果胶酶活力测定
原理:果胶是广泛存在于果蔬植物组织中的多糖物质。
果胶酶以果胶为底物,可以使果胶分解并产生半乳糖醛酸。
3, 5二硝基水杨酸(DNS)与醛糖共热能够产生棕红色氨基化合物,在一定范围内还原糖量与呈色物溶液颜色成正比,一定波长下,测定溶液吸光值可算出半乳糖醛酸含量,从而计算果胶酶酶活。
试剂:
DNS溶液:酒石酸钾钠182 g,溶于500mL蒸馏水中,加热,于热溶液中依次加入3,5-二硝基水杨酸6.3 g,NaOH 21g,苯酚5 g,搅拌至全溶,冷却后用蒸馏水定容至1000 mL,贮于棕色瓶中,室温保存.
D-半乳糖醛酸溶液(1mg/mL): 准确称取0.100g半乳糖醛酸于锥形瓶中,用pH 5.0的柠檬酸-磷酸氢二钠缓冲液定容到100mL。
方法:
标准曲线的绘制:
,放置20min,测定540nm波长下吸光度。
果胶酶活性的检测
目的
本检测方法是用来确定本公司果胶酶的催化活性。
本方法适用于各种固体和液体果胶酶制剂。
说明
本方法适合于果胶酶的质量分析和质量控制领域。
但不是本公司产品及其它公司产品的绝对活力的预测,而各种酶制剂的最终的酶活力在良好的实验操作下仍可发挥出更好的催化活力。
原理
果胶物质主要存在于植物初生壁和细胞中间,果胶物质是细胞壁的基质多糖。
果胶包括两种酸性多糖(聚半乳糖醛酸、聚鼠李半乳糖醛酸)和三种中性多糖(阿拉伯聚糖、半乳聚糖、阿拉伯半乳聚糖)。
果胶酶本质上是聚半乳糖醛酸水解酶,果胶酶水解果胶主要生成β-半乳糖醛酸,可用次碘酸钠法进行半乳醛酸的定量,从而测定果胶酶活力。
果胶酶活力单位定义
1g(或1ml液体酶)酶粉,于50.0℃、pH3.5条件下,每分钟催化果胶水解生成1微克半乳糖醛酸的酶量为一个活力单位。
1.试剂和仪器
*本标准所使用所有的试剂若无任何说明,均为分析纯
1.1醋酸1.2碘1.3碘花钾1.4浓硫酸
1.5果胶(sigma公司)1.6硫代硫酸钠1.7碳酸钠1.8可溶性淀粉
1.9水浴锅1.10碘量瓶
2.试剂的制备
2.1 pH
3.5的酸水
用醋酸将蒸馏水调至3.5
2.2 1%果胶溶液:
准确称取分析纯果胶1g,用酸水溶解煮沸,冷却后过滤,定至100ml。
2.2 0.1N碘液:
准确称取碘化钾5g,用蒸馏水溶解后,加入2.54g碘,溶解后定容至
100ml。
2.3 0.025mol/L硫代硫酸钠:
准确称取6.2g硫代硫酸钠,加蒸馏水后定容至1L
2.4 0.5%可溶性淀粉指示剂:
准确称取可溶性淀粉0.5g放入沸水中消煮至透明。
2.5 1M碳酸钠溶液:
准确称取10.6g碳酸钠,定容于100ml的水中
2.6 2N硫酸:
吸10ml的浓硫酸倒入170ml的水中
2.7酶样的制备
准确称取1.000g固体酶或移取1ml液体酶样,定容至100ml,于50℃水浴浸取1小时,过滤,滤液为供试酶液。
则该酶已经稀释100倍。
3.程序
3.1取1%果胶酶10ml加入5ml酶液和5ml蒸馏水(PH3.5),在50℃水浴中保温反应1小时。
3.2取出后加热煮沸2~3min,冷却后,补水至20ml。
3.3取5ml反应液于100ml碘量瓶中,加1M碳酸钠溶液1ml,0.1N碘液5ml,摇匀,具塞,于室温暗处下放置20min。
3.4取出后加2N硫酸2ml,立即用0.05N硫代硫酸钠溶液滴定至浅黄色,加1ml0.5%可溶性淀粉溶液,继续滴定至蓝色消失为止。
3.5空白试验以煮沸失活的酶液或蒸馏水代替酶液进行滴定。
3.6每个酶样最少做两个平行样。
4.计算
4.1将测得的各平行样求OD值的均值。
4.2计算酶的活性单位依据以下公式
酶的活力=U/g(ml)式中:
A:
样品滴定所消耗硫代硫酸钠的毫升数。
B:
空白滴定所消耗硫代硫酸钠的毫升数。
N:
硫代硫酸钠摩尔浓度。
0.5:1当量硫代硫酸钠相当于0.5当量半乳糖醛酸。
20:反应液总体积
51:酶液体积以1ml计
52:吸取反应液
n:
稀释倍数
W:
酶粉重量g或酶液体积ml。