酸碱盐第二课
- 格式:ppt
- 大小:4.08 MB
- 文档页数:42

酸碱盐知识点总结教案一、酸碱盐的定义1. 酸的定义:酸是指能够释放出氢离子的化合物。
根据布朗斯特德理论,酸可以释放出氢离子的叫做酸。
2. 碱的定义:碱是指能够释放出氢氧根离子的化合物。
根据布朗斯特德理论,碱可以释放出氢氧根离子的叫做碱。
3. 盐的定义:盐是由金属离子和非金属离子组成的化合物。
二、酸碱盐的性质1. 酸的性质:酸呈酸性,能与碱中和反应,可溶于水生成氢离子。
2. 碱的性质:碱呈碱性,能与酸中和反应,可溶于水生成氢氧根离子。
3. 盐的性质:盐一般是晶体或结晶状,呈中性,可以在水中溶解。
三、酸碱盐的分类1. 酸的分类:按照溶解度可以分为无机酸和有机酸;按照酸性强弱可以分为强酸、弱酸和中性物质。
2. 碱的分类:按照溶解度可以分为水溶性碱和水不溶性碱;按照碱性强弱可以分为强碱和弱碱。
3. 盐的分类:按照成分可以分为氧化物盐、酸盐和复盐。
四、酸碱盐的共同点1. 溶于水中:酸、碱、盐都可以在水中溶解。
2. 酸碱中和反应:酸碱可以发生中和反应,生成盐和水。
3. 电解质:酸、碱、盐都是电解质,在水中能够电离产生氢离子和氢氧根离子。
4. 形成化合反应:酸碱可以与金属和非金属发生化合反应。
五、酸碱盐的实际应用1. 化学实验:酸碱盐可以用于中和反应、电解质实验等化学实验中。
2. 工业生产:酸碱盐可以被用于生产肥料、化肥、洗涤剂、废水处理等工业生产中。
3. 医药卫生:酸碱盐可以用于医疗卫生领域,例如调节酸碱平衡、处理皮肤疾病等。
4. 日常生活中:酸碱盐可以用于调味、清洁、消毒等日常生活中的用途。
以上就是酸碱盐的知识点总结,希望对大家有所帮助。

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。

酸和碱的中和反应说课各位专家、各位老师:大家好!我说课的内容是:人教版教材九年级化学下册第十单元课题2 酸和碱的中和反应,下面我将从五个方面来展示我的说课内容:一、教材分析酸和碱之间发生中和反应是贯穿酸碱盐知识的一个重要纽带,而且,中和反应在实际中有广泛的应用,所以,教材没有简单将它作为酸或碱的性质来介绍,而是专门编成一个课题来说明。
教材根据学生的认知特点,从学生的实验探究开始,让学生自己动手去实验,从实验探究的过程中感悟酸碱中和的结果——酸和碱各自特性都消失;感悟酸碱之间的对立统一;明确中和反应的热效应,感悟化学变化中有能量变化。
接着,教材通过中和反应的产物引出盐的学习,为下节课的学习打下基础。
为此,我设立了如下教学目标:知识与技能:1.了解酸碱中和反应中pH的变化和热量变化;2.了解盐的组成特点,能初步判断怎样的物质属于盐类;3、了解中和反应在实际中的运用。
过程与方法:1、通过引导探究,培养学生发现问题、解决问题的能力和动手操作能力。
2、通过讨论交流,培养学生收集处理信息的能力和良好的学习习惯。
情感态度与价值观:1、初步感受对立统一的思想;2、在探究中培养学生实事求是的科学精神、感受探究的成功与喜悦。
教学重点:知道酸和碱之间发生的中和反应。
教学难点:判断是否发生中和反应。
二、教法选择前苏联教育家苏霍姆林斯基主张知识应“让学生自己找出来”。
我认为“让学生自己找出来”的最佳途径就是让学生参与教学,把学习的主动权“交还”学生。
否则学生就不可能有主动参与的积极性,也就没有发现问题、发展能力的机会,更谈不上创新精神和创新能力的培养。
如何让学生参与到教学中来呢?根据教材的特点以及教学目标、学生实际情况,我在教学中主要选择了引导探究法,通过创设情景、设计实验以及利用多媒体等手段来探究中和反应,从探究中层层启发,发现问题,分析问题,适时营造学生学习的氛围,激发学生学习的动力,为他们的学习添加“助推剂”。
因此做好每一个分组实验、演示实验和调动好学生的积极性,不断提供动脑的探究情景,提供动手练习的机会,让每个学生参与到学习中来是上好本节课的关键。
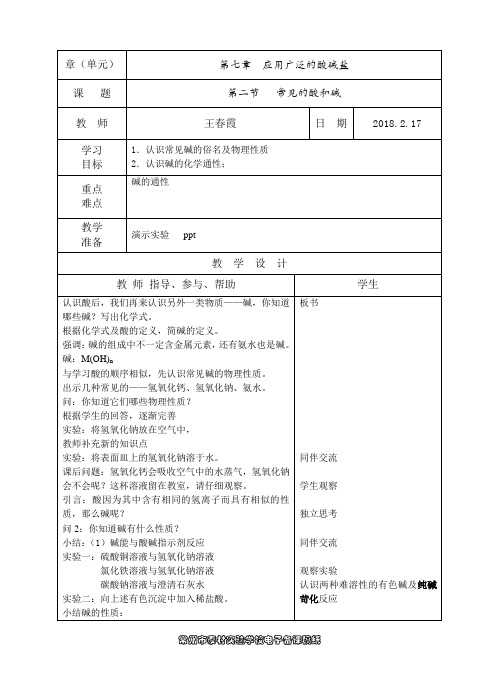


新沂市第六中学教案课时总编号新沂市第六中学教案课时总编号新沂市第六中学教案课时总编号备课组化学上课时间第3课时课型复习主备教学内容第七章应用广泛的酸碱盐(复习3)教学目标1.熟悉常见的盐(食盐、纯碱、硫酸铜、碳酸钙)的性质及用途2.熟练掌握盐的溶解性,铵盐的检验,化学肥料的使用。
3.知道金属活动性顺序的探究,了解复分解反应发生的条件教学重点1.盐的化学性质。
2.金属活动性顺序的探究教学难点1.复分解反应发生的条件2.金属活动性顺序的探究教学方法总结归纳练习教具教学过程教学活及组织过程动个案创新自学指导一、知识点归纳1.你知道锌、铁、铜三种金属活动性强弱顺序吗?请提出你的假设,并设计实验检验你的假设是否正确。
猜想:操作方法现象结论及方程式2.总结出常见金属的活动性顺序3.掌握金属活动性顺序有何用途?4.金属活动性顺序主要应用于在溶液中进行的两类置换反应:(一)、金属+酸→盐和氢气.1.在金属活动性顺序中金属排在氢前边;2.酸是指盐酸和稀硫酸等非氧化性酸,而浓硫酸、硝酸,不溶性酸、极弱的酸除外(二)、金属+盐→另一种金属+另一种盐.1.反应物中的金属必须排在盐中的金属元素前边;2.盐必须可溶.交流展示拓展提高5.化肥哪几种?6.铵态氮肥的检验:活动二:交流展示拓展提高例1.不能与稀硫酸反应生成氢气的金属是( )A.银 B.镁 C.锌 D.铁例2.为验证a、b、c三种金属的活动性,将它们分别投入稀盐酸中,只有c不能与盐酸作用产生气体。
再把a投入b的硝酸盐溶液中,在a的表面有b析出。
则三种金属的活动性顺序为( )A.b>a>c B.a>b>c C.b>c>a D.c>a>b例3.请你设计实验方案证明锌、银、(H)、铜的活动性【总结】设计实验验证金属活动性顺序的一般思路1-金属与酸:能反应的比不能反应的活动性强,都能反应的比较反应的快慢,反应快的比反应慢的活动性强2-金属与盐;能置换说明该金属的活动性比盐中的金属活动性强二、随堂测试1.化学就在我们身边,生活中处处有化学。
化学初中酸碱盐讲课教案
一、教学目标:
1. 知识目标:学生能够理解酸碱盐的概念,能够区分酸碱盐的性质和特点。
2. 能力目标:学生能够运用化学知识解决实际生活中的问题。
3. 情感目标:培养学生的实验操作能力和科学思维意识,激发学生学习化学的兴趣。
二、教学重点和难点:
1. 教学重点:酸碱盐的定义、性质及实际应用。
2. 教学难点:学生对于酸碱盐的特性和实际应用的理解。
三、教学内容:
1. 酸的概念及性质:酸的定义、常见酸、酸的性质。
2. 碱的概念及性质:碱的定义、常见碱、碱的性质。
3. 盐的概念及性质:盐的定义、常见盐、盐的性质。
四、教学过程:
1. 导入:通过展示实验现象引入话题,激发学生的兴趣。
2. 授课:依次介绍酸、碱、盐的定义、性质和实际应用。
3. 实验:让学生进行酸碱盐实验,并观察实验现象。
4. 总结:引导学生总结所学内容,并进行讨论交流。
五、教学手段:
1. 实验仪器:酸、碱、盐、试管、试剂等。
2. 多媒体资料:通过图片、视频等多媒体资料辅助教学。
3. 教学讲义:提供学生相关知识点的讲义,帮助学生理解并记忆知识。
六、教学评价:
1. 考试评价:通过集体讨论、小组合作等方式进行考试。
2. 课堂表现评价:评价学生在课堂上的表现,包括回答问题、实验操作等。
以上是化学初中酸碱盐讲课教案范本,希朿对您有所帮助。
祝您的教学工作顺利!。
第1篇一、活动背景随着新课程改革的不断深入,提高教育教学质量成为我国教育工作的重中之重。
理综教研活动作为教师专业成长的重要途径,对于提升教师教育教学水平具有重要意义。
为了更好地促进教师之间的交流与合作,提高理综教学质量,我校于2021年10月20日开展了理综教研公开课活动。
本次活动旨在为教师提供一个展示自我、学习交流的平台,共同探讨理综教学中的问题与对策。
二、活动目的1. 提高教师教育教学水平,促进教师专业成长。
2. 加强教师之间的交流与合作,形成良好的教研氛围。
3. 探讨理综教学中存在的问题,提出有效的改进措施。
4. 为学生提供优质的教育教学资源,提高理综学习成绩。
三、活动内容1. 语文公开课(1)课题:《荷塘月色》(2)主讲教师:张老师(3)教学过程:①导入:通过图片展示荷塘美景,激发学生兴趣。
②新课导入:分析《荷塘月色》的写作背景,引导学生了解作者的情感。
③新课讲授:通过朗读、分析、讨论等方式,引导学生深入理解课文内容。
④课堂小结:总结本节课的学习内容,布置课后作业。
2. 数学公开课(1)课题:《二元一次方程组的应用》(2)主讲教师:李老师(3)教学过程:①导入:通过生活中的实例,让学生感受到二元一次方程组的实际应用。
②新课导入:回顾二元一次方程组的解法,引出本节课的内容。
③新课讲授:通过实例分析、小组讨论、课堂练习等方式,帮助学生掌握二元一次方程组的解法。
④课堂小结:总结本节课的学习内容,布置课后作业。
3. 英语公开课(1)课题:《My school life》(2)主讲教师:王老师(3)教学过程:①导入:通过播放歌曲,激发学生学习兴趣。
②新课导入:通过图片展示,让学生了解本节课的主题。
③新课讲授:通过听、说、读、写等方式,引导学生掌握本节课的内容。
④课堂小结:总结本节课的学习内容,布置课后作业。
四、活动总结1. 教师们积极参与,认真备课,充分展示了各自的教学风格和教学特色。
2. 在公开课过程中,教师们注重学生的主体地位,关注学生的个体差异,引导学生积极参与课堂活动。
第二讲 酸碱盐知识及物质分类【知识回顾】(1) 混合物与纯净物 项目纯净物 混合物概念 有一种物质组成 由两种或多种物质混合而成 微观构成 由同种分子构成由不同种分子混合组成 特征有固定的物理性质和化学性质各物质都保持原来自己的性质,所以没有固定的性质 相互关系两种或两种以上的纯净物可以机械的混合成混合物混合物可以经物质的分离提纯,得到纯净物 举例 食盐食盐水(2) 单质与化合物 项目 单质化合物概念 由同一种元素组成的纯净物由不同元素组成的纯净物共同点 均为纯净物宏观不同点 由同一种元素组成 由不同种元素组成 微观不同点由同种原子构成 由不同种原子构成一、相关概念1、单质、化合物和氧化物的概念单质:同种元素组成的纯净物化合物:由两种或两种以上元素组成的纯净物氧化物:由两种元素组成的化合物,其中有一种元素是氧2、常见的酸、碱、盐酸性溶液:能使紫色石蕊试液变红的溶液碱性溶液:能使紫色石蕊试液变蓝的溶液常见的酸:盐酸、硫酸、硝酸、碳酸常见的碱:氢氧化钠、氢氧化钾、氨水盐:组成中含有金属离子(或铵根)和酸根离子的化合物【知识衔接】一、氧化物1.定义(1)组成元素的种数:两种(2)组成物质的类别:化合物2.分类(1)按常温下的状态分类①固态氧化物(如:Fe2O3、CuO)②液态氧化物(如:H2O)③气态氧化物(如:CO2)(2)按组成元素分类①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)(3)按酸碱性分①酸性氧化物:能与碱作用,生成物只有盐和水的氧化物。
(大多数非金属氧化物如:CO2、SO2、SO3、SiO2、P2O5等)②碱性氧化物: 能与酸作用,生成物只有盐和水的氧化物。
(大多数金属氧化物如:Na2O、CaO、Fe2O3、CuO、MgO等)(4)按化学性质分类①不成盐氧化物:不能与酸和碱反应生成相应价态的盐和水的氧化物。
第2课时稀酸的化学性质【教学目标】1.知识与技能初步掌握稀硫酸的化学性质以及有关化学方程式。
2.过程与方法通过演示实验和学生分组实验,培养学生的观察能力、逻辑思维能力和实验操作能力以及记录实验的能力。
3.情感、态度与价值观树立事物间的共性与个性的辩证唯物观。
【教学重点】酸的相似的化学性质。
【教学难点】有关化学反应。
【教学准备】仪器:烧杯、胶头滴管、点滴板、镊子、玻璃片、短玻璃管等。
药品:食醋、稀盐酸、稀硝酸、稀硫酸、食盐水、紫色石蕊试液、无色酚酞试液、生锈的铁钉、铜铁镁锌、变黑的铜丝、蒸馏水等。
一、导入新课[教师]同学们,上节课我们学习了浓盐酸和浓硫酸的物理性质和用途,现在老师手中拿的就是这两种酸,它们的标签都被遮挡住了。
那么,在不看标签的情况下,你能够用哪些方法来区分二者?请同学们思考。
[学生]积极思考,回忆所学知识,回答问题。
[教师]那么,稀酸都具有哪些通性呢?各自又有哪些“脾气”和“性质”呢?这就是我们今天主要的学习内容。
二、推进新课活动1认识稀酸的化学性质[提问]试管中的紫色石蕊试液,在不借助任何化学药品的情况下,能否使之变成红色?[学生演示](向试管中吹气,紫色石蕊试液变成红色)[追问]为什么会变色?[学生回答]二氧化碳与水反应生成碳酸。
碳酸使紫色石蕊试液变成红色。
(请学生写出该反应的化学方程式)[提问]除了碳酸,还有其他物质能使紫色石蕊试液变色吗?[学生活动1]分别在稀盐酸和稀硫酸中滴加紫色石蕊试液。
[实验现象交流]与碳酸的现象相似,试液变红。
[板书]三、稀酸的化学性质1.酸溶液与酸碱指示剂作用pH<7溶液呈酸性,性质1 使紫色石蕊试液变红,不能使无色酚酞试液变色。
[过渡]稀盐酸、稀硫酸都能使紫色石蕊试液变红色,它们还有其他的共性吗?[知识回顾]铁跟稀硫酸发生置换反应:Fe+H2SO4=FeSO4+H2↑;铁跟稀盐酸发生置换反应:Fe+2HCl2=FeCl2+H2↑。
[交流]都有氢气;另一生成物都是由金属离子和酸根离子组成的化合物叫做盐。