高中化学五个平衡对比(化学平衡,电离平衡,水的电离平衡,水解平衡,溶解平衡)
- 格式:doc
- 大小:29.00 KB
- 文档页数:2


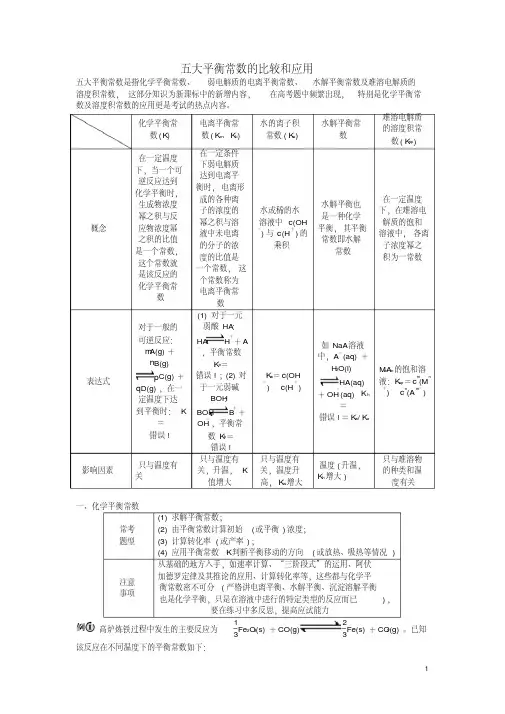
五大平衡常数的比较和应用五大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水解平衡常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
化学平衡常数(K) 电离平衡常数(K a、K b)水的离子积常数(K w)水解平衡常数难溶电解质的溶度积常数(K sp)概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数在一定条件下弱电解质达到电离平衡时,电离形成的各种离子的浓度的幂之积与溶液中未电离的分子的浓度的比值是一个常数,这个常数称为电离平衡常数水或稀的水溶液中c(OH-)与c(H+)的乘积水解平衡也是一种化学平衡,其平衡常数即水解常数在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),在一定温度下达到平衡时:K=错误!(1)对于一元弱酸HA:HA H++A-,平衡常数K a=错误!;(2)对于一元弱碱BOH:BOH B++OH-,平衡常数K b=错误!K w=c(OH-)·c(H+)如NaA溶液中,A-(aq)+H2O(l)HA(aq)+OH-(aq) K h=错误!=K w/K aM m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)影响因素只与温度有关只与温度有关,升温,K值增大只与温度有关,温度升高,K w增大温度(升温,K h增大)只与难溶物的种类和温度有关一、化学平衡常数常考题型(1)求解平衡常数;(2)由平衡常数计算初始(或平衡)浓度;(3)计算转化率(或产率);(4)应用平衡常数K判断平衡移动的方向(或放热、吸热等情况)注意事项从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力高炉炼铁过程中发生的主要反应为13Fe2O3(s)+CO(g)23Fe(s)+CO2(g)。

{高考高参}快速突破溶液中的“四大平衡”●安徽安庆望江县第二中学 江已舒 安徽省滁州二中高中部 王叶梅(一)四大平衡相同点1.都有可逆性。
所有的平衡都建立在“可逆反应”的基础上,这四种平衡分别对应着一种可逆变化。
2.都可以用勒夏特列原理来解释。
当只改变体系中的一个条件时,平衡向能够减弱这种改变的方向移动。
(二)四大平衡不同点(三)对比表格,正确理解平衡之别1.以AgCl (s+(aq )+Cl -(aq ) ΔH>0为例,2.四大平衡常数的比较(一)弱电解质的电离平衡考向1:溶液的酸碱性及pH 的计算【典例1】将pH =1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH 溶液,pH 都升高了1,则加入的水与NaOH 溶液的体积比为( )A.9B.10C.11D.12【答案】C【解析】将pH =1的盐酸加适量水,pH 升高了1,说明所加的水的体积是原溶液体积的9倍;另1份加入与该盐酸物质的量浓度相同的适量NaOH 溶液后,pH 升高了1,则有10-1×1-10-1·x =10-2·(1+x ),解得x =9—11,则加入的9—=11∶1。
广义的化学平衡包括电离平衡、水解平衡、沉淀溶解平衡以及狭义的化学平衡。
这四种平衡被称为四大化学平衡。
四大化学平衡是中学化学知识结构的核心内容之一,而有关这些平衡的试题在近几年的高考中出现的频率较高,逐渐成为高考的热点,考生在复习时需要给予足够的重视。
本文将对水溶液中的四大平衡进行类比分析和解读。
一、分析平衡,理清关系 二、把握命题考向,掌握解题金钥匙 {高考高参}考向2:电离平衡常数的计算和应用【典例2】下列关于一定温度、一定浓度的氨水的说法正确的是( )A. NH 3·H 2O 的电离达到平衡的标志是溶液呈电中性B.c (NH 4+)————————c (H +)·c (NH 3·H 2O)是个常数C.氨水促进了水的电离D.c (NH 4+) + c (H +)=c (NH 3·H 2O) + c (OH -)【答案】B【解析】溶液在任何情况下均呈电中性,A 项错误;设NH 3·H 2O 的电离常数为K b ,则K b =c (NH 4+)·c (OH -)———————c (NH 3·H 2O),而K W =c (H +)·c (OH -),两式相比得K b⸺K W =c (NH 4+)————————c (H +)·c (NH 3·H 2O),因为K b 、K W 为常数,故c (NH 4+)————————c (H +)·c (NH 3·H 2O)为常数,B 项正确;NH 3·H 2O 电离出OH -,抑制了水的电离,C 项错误;根据溶液中的电4+) + c (H +)=c (OH -),D项错误。


快速突破溶液中的“四大平衡”●安徽安庆望江县第二中学 江已舒 安徽省滁州二中高中部 王叶梅(一)四大平衡相同点1.都有可逆性。
所有的平衡都建立在“可逆反应”的基础上,这四种平衡分别对应着一种可逆变化。
2.都可以用勒夏特列原理来解释。
当只改变体系中的一个条件时,平衡向能够减弱这种改变的方向移动。
(二)四大平衡不同点(三)对比表格,正确理解平衡之别1.以AgCl (s+(aq )+Cl -(aq ) ΔH>0为例,2.四大平衡常数的比较(一)弱电解质的电离平衡考向1:溶液的酸碱性及pH 的计算【典例1】将pH =1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH 溶液,pH 都升高了1,则加入的水与NaOH 溶液的体积比为( )A.9B.10C.11D.12【答案】C【解析】将pH =1的盐酸加适量水,pH 升高了1,说明所加的水的体积是原溶液体积的9倍;另1份加入与该盐酸物质的量浓度相同的适量NaOH 溶液后,pH 升高了1,则有10-1×1-10-1·x =10-2·(1+x ),解得x =9—11,则加入的9—=11∶1。
广义的化学平衡包括电离平衡、水解平衡、沉淀溶解平衡以及狭义的化学平衡。
这四种平衡被称为四大化学平衡。
四大化学平衡是中学化学知识结构的核心内容之一,而有关这些平衡的试题在近几年的高考中出现的频率较高,逐渐成为高考的热点,考生在复习时需要给予足够的重视。
本文将对水溶液中的四大平衡进行类比分析和解读。
二、把握命题考向,掌握解题金钥匙 考向2:电离平衡常数的计算和应用【典例2】下列关于一定温度、一定浓度的氨水的说法正确的是( )A. NH 3·H 2O 的电离达到平衡的标志是溶液呈电中性B.c (NH 4+)————————c (H +)·c (NH 3·H 2O)是个常数C.氨水促进了水的电离D.c (NH 4+) + c (H +)=c (NH 3·H 2O) + c (OH -)【答案】B【解析】溶液在任何情况下均呈电中性,A 项错误;设NH 3·H 2O 的电离常数为K b ,则K b =c (NH 4+)·c (OH -)———————c (NH 3·H 2O),而K W =c (H +)·c (OH -),两式相比得K b⸺K W =c (NH 4+)————————c (H +)·c (NH 3·H 2O),因为K b 、K W 为常数,故c (NH 4+)————————c (H +)·c (NH 3·H 2O)为常数,B 项正确;NH 3·H 2O 电离出OH -,抑制了水的电离,C 项错误;根据溶液中的电4+) + c (H +)=c (OH -),D项错误。



高中化学溶液中的三个平衡与三个守恒一、溶液中的三个平衡在中学阶段溶液中的三个平衡包括:电离平衡、水解平衡以及沉淀溶解平衡,这三种平衡都遵循勒夏特列原理——当只改变体系的一个条件时,平衡向能减弱这种改变的方向移动。
1. 电离平衡常数、水的离子积常数、溶度积常数均只与温度有关。
电离平衡常数和水的离子积常数随着温度的升高而增大,因为弱电解质的电离和水的电离均为吸热过程。
2. 弱酸的酸式盐溶液的酸碱性取决于弱酸的酸式酸根离子的电离程度和水解程度的相对大小。
①若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4;②若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4等。
3. 沉淀溶解平衡的应用沉淀的生成、溶解和转化在生产、生活以及医疗中可用来进行污水的处理、物质的提纯、疾病的检查和治疗。
解决这类问题时应充分利用平衡移动原理加以分析。
当Q C>K SP时,生成沉淀;当Q C<K SP时,沉淀溶解;当Q C=K SP时,达到平衡状态。
4. 彻底的双水解常见的含有下列离子的两种盐混合时,阳离子的水解阴离子的水解相互促进,会发生较彻底的双水解。
需要特别注意的是在书写这些物质的水解方程式时,应用“===”,并将沉淀及气体分别用“↓”、“↑”符号标出。
如:当Al3+分别遇到AlO2-、CO32-、HCO3-、S2-时,[3AlO2-+ Al3+ + 6H2O === 4Al(OH)3↓];当Fe3+分别遇到CO32-、HCO3-、AlO2-时;还有NH4+与Al3+;SiO3与Fe3+、Al3+等离子的混合。
另外,还有些盐溶液在加热时,水解受到促进,而水解产物之一为可挥发性酸时,酸的挥发又促进水解,故加热蒸干这些盐溶液得不到对应的溶质,而是对应的碱(或对应的金属氧化物)。
如:①金属阳离子易水解的挥发性强酸盐溶液蒸干后得到氢氧化物,继续加热后得到金属氧化物,如FeCl3、AlCl3、Mg(NO3)2溶液蒸干灼烧得到的是Fe2O3、Al2O3、MgO而不是FeCl3、AlCl3、Mg(NO3)2固体;②金属阳离子易水解的难挥发性强酸盐溶液蒸干后得到原溶质,如Al2(SO4)3、Fe(SO4)3等。

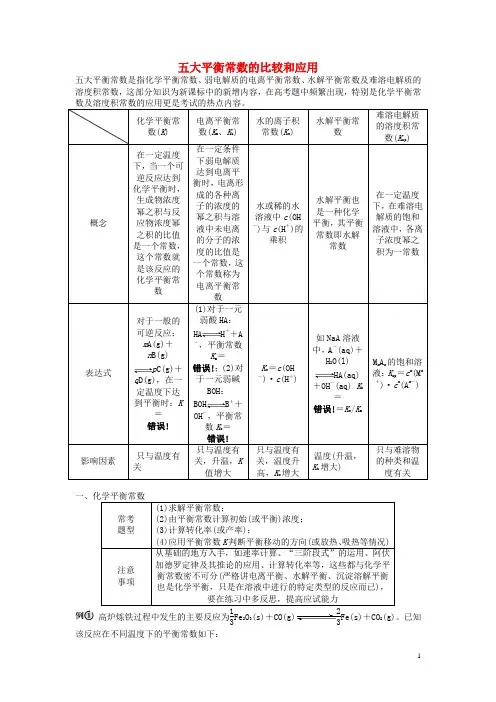
五大平衡常数的比较和应用五大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水解平衡常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
化学平衡常数(K ) 电离平衡常数(K a 、K b ) 水的离子积常数(K w ) 水解平衡常数 难溶电解质的溶度积常数(K sp )概念 在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数 在一定条件下弱电解质达到电离平衡时,电离形成的各种离子的浓度的幂之积与溶液中未电离的分子的浓度的比值是一个常数,这个常数称为电离平衡常数水或稀的水溶液中c (OH -)与c (H +)的乘积 水解平衡也是一种化学平衡,其平衡常数即水解常数 在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数 表达式 对于一般的可逆反应:m A(g)+n B(g) p C(g)+q D(g),在一定温度下达到平衡时:K =错误! (1)对于一元弱酸HA :HA H ++A -,平衡常数K a =错误!;(2)对于一元弱碱BOH :BOH B ++OH -,平衡常数K b =错误!K w =c (OH -)·c (H +) 如NaA 溶液中,A -(aq)+H 2O(l) HA(aq)+OH -(aq) K h =错误!=K w /K a M m A n 的饱和溶液:K sp =c m (M n+)·c n (A m -) 影响因素 只与温度有关 只与温度有关,升温,K 值增大 只与温度有关,温度升高,K w 增大 温度(升温,K h 增大) 只与难溶物的种类和温度有关一、化学平衡常数常考 题型 (1)求解平衡常数;(2)由平衡常数计算初始(或平衡)浓度;(3)计算转化率(或产率);(4)应用平衡常数K 判断平衡移动的方向(或放热、吸热等情况)注意 事项 从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力高炉炼铁过程中发生的主要反应为13Fe 2O 3(s)+CO(g)23Fe(s)+CO 2(g)。
五大平衡常数 专题平衡常数影响因素:所有平衡常数K 、K a 、K b 、K w 、K h 、K sp ,都只与温度和本身性 一、化学平衡常数可逆反应达到平衡后的体系中,m A(g)+n B(g)⇌p C(g)+q D(g) 表达式 K =)B ()A ()D ()C (n m q p c c c c ⋅⋅①T 升高,K 增大,则正反应吸热;T 升高,K 减小,正反应放热。
②Q c <K ,反应向正方向进行; Q c =K ,反应刚好达到平衡; Q c >K ,反应向逆方向进行。
③同一个反应,正逆平衡常数乘积为1, K (正)·K (逆)=1 ④化学计量数均扩大n 倍或缩小为1n ,则K '=K n或K '=K 1n⑤几个不同的可逆反应,Ⅲ式=Ⅰ式+Ⅱ式,则K Ⅲ=K Ⅰ·K Ⅱ。
或Ⅲ式=Ⅰ式-Ⅱ式,则K Ⅲ=K IK II常考点:(1)化学平衡常数表达式; (2)化学平衡常数的计算;(3)由化学平衡常数计算初始浓度或平衡浓度; (4)计算反应物的平衡转化率或生成物的产率;(5)用化学平衡常数K 判断平衡移动的方向、反应的热效应等。
二、电离平衡常数弱酸的电离平衡中,HA ⇌H ++A -表达式 K a =)HA ()A ()H (c c c —⋅+弱碱的电离平衡中,BOH ⇌B ++OH -表达式 K b =)BOH ()OH ()B (c c c —⋅+①T 升高,K 增大;电离是吸热的;②K 越大,酸的酸性或碱的碱性相对越强;反之,K 越小,酸的酸性或碱的碱性相对越弱。
③多元酸的K a1>>K a2>>K a3。
主要考查点:(1)直接计算电离平衡常数、水解平衡常数;(2)由电离平衡常数、水解平衡常数推断弱酸、弱碱的相对强弱或浓 度;(3)由K a 、K b 或K h 计算pH;(4)K a 、K b 、K h 、K W 之间的定量关系。