3种氨基酸锌配合物在水中的溶解焓
- 格式:pdf
- 大小:163.33 KB
- 文档页数:3


氨基酸锌络合物氨基酸锌络合物是一类由氨基酸和锌离子形成的化合物。
氨基酸是构成蛋白质的重要基本单位,它们能够与金属离子形成稳定的配合物,从而产生不同的物化性质。
锌是人体必需的微量元素之一,它在人体内发挥着诸多生理功能。
因此,氨基酸锌络合物具有诸多生物活性和药理作用,在医药、保健品和食品添加等领域得到广泛应用。
一、氨基酸锌络合物的制备方法氨基酸锌络合物的制备方法主要有两种:1.原位合成法:将氨基酸与锌盐一起溶解于水或有机溶剂中,在适当的条件下进行反应,直接形成氨基酸锌络合物。
该方法反应简单、快速、成本低,但制备稳定的络合物有一定难度。
2.后加法合成法:将已形成的氨基酸溶液与锌盐溶液分别调整至特定的pH值,然后慢慢混合两种溶液,通过调节反应条件得到氨基酸锌络合物。
该方法较为灵活,能够得到较为稳定的络合物,但需要对反应条件加以控制。
二、氨基酸锌络合物的生理活性及应用1.保健品:氨基酸锌络合物具有养颜美容、增强免疫力、补血补肾等保健功效。
可以应用于多种保健品的制备中,如补血补气剂、活力保健品等。
2.食品添加剂:氨基酸锌络合物能够增强面包的松软度和品质,改善肉制品的品质和营养价值,并能为乳制品和蛋制品等添加剂提供较好的效果。
3.医药:氨基酸锌络合物可以用于制备口腔清洁剂、儿童多维元素口服液等医药用品。
同时,它还有良好的抗氧化、抗炎、降血压、抗肿瘤等多种生物活性。
三、氨基酸锌络合物的应用前景随着人们对保健和医疗需求的增加,氨基酸锌络合物作为一类新型的生物活性物质应用前景广阔。
在癌症、糖尿病、高血压、低免疫力等疾病的预防和治疗方面,氨基酸锌络合物的研究仍具有重要意义。
另外,氨基酸锌络合物的应用在食品加工领域也有不错的发展前景。
不仅可以提升食品的营养价值和品质,还可以促进食品行业的可持续发展。
总之,氨基酸锌络合物作为一类多功能的物质,其生物活性和应用前景备受关注。
研究人员应对其结构、性质、制备方法和应用领域加强深入探讨,为人类的健康和社会的可持续发展作出积极的贡献。


[Article]物理化学学报(Wuli Huaxue Xuebao )Acta Phys.⁃Chim.Sin .,2007,23(9):1437-1441September Received:March 12,2007;Revised:May 9,2007;Published on Web:June 21,2007.∗Corresponding author.Email:yydi@.国家自然科学基金(20673050)和聊城大学博士后启动基金(31805)资助项目ⒸEditorial office of Acta Physico ⁃Chimica Sinica配合物Zn(Phe)(NO 3)2·H 2O(s)的低温热容和标准摩尔生成焓邸友莹1,∗高胜利2谭志诚3(1聊城大学化学化工学院,山东聊城252059;2西北大学化学系,西安710069;3中国科学院大连化学物理研究所热化学实验室,辽宁大连116023)摘要:利用精密自动绝热热量计直接测定了配合物Zn(Phe)(NO 3)2·H 2O(s)(Phe:苯丙氨酸)在78-370K 温区的摩尔热容.通过热容曲线的解析得到该配合物的起始脱水温度为,T 0=(324.27±0.37)K.将该温区的摩尔热容实验值用最小二乘法拟合得到摩尔热容(C p ,m )对温度(T )的多项式方程,并且在此基础上计算出了它的舒平热容值和各种热力学函数值.依据Hess 定律,通过设计热化学循环,选择体积为100mL 浓度为2mol ·L -1的盐酸作为量热溶剂,利用等温环境溶解⁃反应热量计分别测定混合物{ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}和{Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}的溶解焓为,Δd H 0m,1=(69.42±0.05)kJ ·mol -1,Δd H 0m,2=(48.14±0.04)kJ ·mol -1,进而计算出该配合物的标准摩尔生成焓为,Δf H 0m =-(1363.10±3.52)kJ ·mol -1.另外,利用紫外⁃可见(UV ⁃Vis)光谱和折光指数(refractive index)的测量结果检验了所设计的热化学循环的可靠性.关键词:Zn(Phe)(NO 3)2·H 2O(s);绝热量热法;低温热容;溶解⁃反应量热法;标准摩尔生成焓中图分类号:O642Low 鄄temperature Heat Capacities and Standard Molar Enthalpy ofFormation of the Complex Zn(Phe)(NO 3)2·H 2O(s)DI You ⁃Ying 1,∗GAO Sheng ⁃Li 2TAN Zhi ⁃Cheng 3(1College of Chemistry and Chemical Engineering,Liaocheng University,Liaocheng 252059,Shandong Province,P.R.China;2Department of Chemistry,Northwest University,Xi ′an 710069,P.R.China ;3Thermochemistry Laboratory,Dalian Institute ofChemical Physics,Chinese Academy of Sciences,Dalian 116023,Liaoning Province,P.R.China )Abstract :Low ⁃temperature heat capacities of the complex Zn(Phe)(NO 3)2·H 2O(s)(Phe:phenylalanine)have been precisely measured with a small sample precision automated adiabatic calorimeter over the temperature range from 78to 370K.The initial dehydration temperature of the complex (T 0=(324.27±0.37)K)has been obtained by means of the analysis of the heat capacity curve.The experimental values of molar heat capacities have been fitted to a polynomial equation of heat capacities (C p ,m )vs the temperature (T )with the least square method.The smoothed heat capacities and the thermodynamic functions of the complex have been calculated on the basis of the equation.In accordance with Hess law,dissolution enthalpies of the mixtures {ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}and {Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}in 2mol ·L -1HCl were measured to be:Δd H 0m,1=(69.42±0.05)kJ ·mol -1and Δd H 0m,2=(48.14±0.04)kJ ·mol -1,by using an isoperibol solution ⁃reaction calorimeter.Furthermore,the standard molar enthalpy of formation for the complex was determined as,Δf H 0m =-(1363.10±3.52)kJ ·mol -1,by designing a thermochemical cycle.In addition,the reliability of the designed thermochemical cycle has been verified by UV ⁃Vis spectroscopy and the data of the refractive indices.Key Words :Zn(Phe)(NO 3)2·H 2O(s);Adiabatic calorimetry;Low ⁃temperature heat capacity;Solution ⁃reactioncalorimetry;Standard molar enthalpy of formation1437Acta Phys.鄄Chim.Sin.,2007Vol.23L⁃α⁃氨基酸与锌形成的配合物作为营养添加剂在药物、食品以及化妆品等方面的应用已引起人们的极大重视[1,2].近几十年来,这类新型化合物的合成、结构及性质表征的研究已取得了很大进展.然而,为了进一步改进这些配合物的合成工艺以便使其适用于工业生产,开发它们的新的应用领域,并且进行相关的理论研究,迫切需要该类配合物准确的热力学数据作为理论计算的依据.高胜利等[3]用半微量相平衡法研究了Zn(NO3)2⁃Phe⁃H2O(其中Phe代表L⁃α⁃苯丙氨酸)三元体系在298.15K的溶度图,发现在相图上有两种新的物相生成,将饱和溶液和湿固相组成点连线的延长线交点确定为该相区固相物质的组成.他们在相图的指导下成功合成了未见文献报道的Zn(Phe)(NO3)2·H2O(s)等配合物,并且对其结构和在氧气气氛下的热稳定性等进行了表征.然而,迄今为止,文献中尚未见到配合物Zn(Phe)(NO3)2·H2O(s)的低温热容和标准摩尔生成焓等热力学性质的报道.本文用自己合成的Zn(Phe)(NO3)2·H2O(s)样品,通过精密自动绝热热量计直接测定了这个配合物在78-370K的摩尔热容,并且在此基础上计算出了它的各种热力学函数.利用等温环境溶解⁃反应量热计,通过设计热化学循环,确定了该配合物的标准摩尔生成焓.1实验1.1样品的制备和表征样品制备中所使用的锌盐(Zn(NO3)2·6H2O)为AR级,西安化学试剂厂生产,纯度大于99.90%;L⁃α⁃苯丙氨酸(phenylalanine)为BR级,上海康达氨基酸厂生产,纯度大于99.50%;其它试剂均为AR级.所使用的样品采用文献[3]的方法合成.新制得的配合物Zn(Phe)(NO3)2·H2O(s)为白色沉淀.抽滤,用少量丙酮洗涤三次,真空干燥至恒重得白色粉末.它溶于水而不溶于醇、丙酮等有机溶剂.化学分析表明,该配合物的组成为Zn(Phe)(NO3)2·H2O(s).用意大利1160型元素分析仪和化学分析方法证实了该样品的纯度大于99.90%,符合精密绝热量热法和等温环境溶解⁃反应量热法对测量样品的要求.有关该样品的其它表征,如在氧气气氛下的TG、FTIR以及X射线粉末衍射分析等,请参考文献[3].1.2样品的低温热容测定在中国科学院大连化学物理研究所材料热化学实验室建立的小样品精密自动绝热量热装置中进行低温热容测定.有关该装置的原理和结构细节参考文献[4,5].Zn(Phe)(NO3)2·H2O(s)的用量为3.6409g,即0.0098 mol(分子量为372.609g·mol-1).以间歇式加热方式和交替式测温的程序进行热容测量,测量温度范围为78-370K.液氮作为冷冻剂.样品池的加热速率控制在0.2-0.4K·min-1,升温间隔控制在2-4K.热容测量过程中,内屏与样品容器之间的温差可以自动控制在0.001K以内,样品容器在平衡期的温度变化率可自动控制在10-3-10-4K·min-1.量热实验中,包括电能和温度在内的所有测试数据均由计算机自动采集和适时处理.为了证实该绝热热量计测量结果的准确性,预先测量了量热标准参考物质α⁃Al2O3在78-400K 的摩尔热容,实验数据与标准参考数据[6]之间的相对偏差在±0.20%以内.1.3样品标准摩尔生成焓的测定先利用武汉大学制造的SRC⁃100型溶解⁃反应热量计通过测定所设计反应的反应物和产物在指定溶剂中的溶解焓,计算出样品的标准摩尔生成焓.该热量计的原理和结构细节参见文献[7,8].该仪器控温和测温均由惠斯顿电桥完成,用热敏电阻作温度传感器.如文献[8]中所示,在295-310 K,该仪器的测温热敏电阻的电势变化值与温度变化值呈线性关系,因而可利用热敏电阻的电势变化来表示温度变化.溶解实验和电标定实验产生的温差,由装有精密热敏电阻的直流惠斯顿电桥和与之配用的自动数据采集和处理系统来测定.热量计常数是利用每次溶解实验结束后的溶液,通过电标定方法确定.溶解实验和电标定实验的温差皆通过等面积法校正得到[9].此热量计恒温水浴控温精度为±0.001K,量热本体的测温灵敏度为±0.0001K.实验温度一般控制在T=298.15K.在298.15K下,用原美国标准局提供的量热标准物质THAM(NBS⁃742a)在0.1mol·L-1盐酸中的反应焓,和KCl在二次蒸馏水中的溶解焓的测量,来验证仪器的准确度.结果表明,实验数据与文献标准参考数据[10]之间的相对偏差在±0.30%以内.2结果与讨论2.1热容热容实验值绘于图1.由图1的热容曲线可见,在78-324K温度区间,热容曲线是连续平滑递增1438No.9邸友莹等:配合物Zn(Phe)(NO 3)2·H 2O(s)的低温热容和标准摩尔生成焓的,说明这个配合物在此温区结构稳定,没有相变、分解和缔合等热异常现象发生.然而,在温度高于324K 时,热容曲线呈现明显快速上升趋势,以致图1中的整条曲线在324K 附近出现一个拐点.说明样品在324K 附近开始分解.将78-324K 以及324-370K 两段曲线按照其趋势作直线延伸,其交点被确定为实际起始分解温度.在脱水温区,经过三次重复热容测量,得到三次实验的起始脱水温度分别为,T 0,1=324.55K,T 0,2=323.20K,T 0,3=325.05K,如图1中的插图所示,从而得到三次实验结果的平均值为,T 0=(324.27±0.37)K.按照文献[3]的TG 分析结果,323.15-488.15K 温度区间为该配合物脱水阶段,失重率为5.00%,与水分子在该样品中的质量分数(4.83%)基本吻合.热容曲线在拐点处的温度324.55K 与文献[3]中TG 曲线上的起始脱水温度(323.15K)相差1.40K,基本吻合.两种方法产生一定偏差的主要原因可能是由于TG 实验期间样品表面吸附了空气中的水,此表面吸附水的脱除发生在样品的结晶水脱除以前,从而使得TG 曲线上第一步起始脱水温度降低,且第一步实际脱水时的失重率增加.但是,绝热量热测量中,样品容器在放入样品后,先将样品池抽真空至100Pa 以下,以防止表面吸附水的存在,然后给样品池中充入压力大约为100kPa 的高纯氦气以增加低温热容测量过程中样品池的导热速率和减少达到热平衡所需时间,最后用焊锡将样品池密封.相比较而言,低温热容测量所得结果是可靠的.因为样品在约324.27K 处分解,所以,该配合物热容曲线有效段为78-324K 温区.将该温区的118个摩尔热容实验点用最小二乘法拟合,可以得到一个摩尔热容(C p ,m /(J ·mol -1·K -1))对温度(T )的多项式方程,即:C p ,m =332.636+203.243x +5.015x 2+2.188x 3+14.232x 4式中x 为折合温度,x =(T -201.5)/123.5,T 为绝对温度.该方程在78-325K 温度区间有效.除温度区间两边的几个实验温度点外,由此经验式所得到的舒平热容值与实验值的相对偏差在±0.4%以内.另外,配合物的热容曲线在324K 以后出现缓慢脱水现象,而不是出现一个明显的脱水峰.这可能是由于结晶水在此配合物中的百分含量较大,样品量也较大,在整个绝热量热实验中样品池是密封的,脱水开始后一方面由于温度升高使得脱水速度加快,另一方面由于样品池中水蒸气压力的迅速增大使得脱水的速度受到很大抑制.从图1中的插图看出,三次热容实验在温度低于324K 时,热容测量结果是很吻合的,但是在温度高于324K 时,同一个实验温度下每次热容测量结果有较大的偏差,这主要是由于重复热容测量时的样品量不同,样品热分解时水蒸气压不同,对热容的实验值影响不同所致.由此可知,配合物在温度高于324K 时的实验摩尔热容值实际是无意义的.2.2热力学函数计算用配合物在78-325K 温度区间热容随温度变化的多项式方程,可以计算出该温度区间内的舒平热容值.在此温度区间某一给定温度(T )下,摩尔热容与相对于298.15K 的热力学函数的关系式为,H T -H 298.15K =T 298.15∫C p ,m d TS T -S 298.15K =T298.15∫C p ,m T -1d T G T -G 298.15K =T298.15∫C p ,m d T -TT 298.15∫C p ,m T -1d T通过上式,用摩尔热容多项式方程进行数值积分可以获得298.15-325K 温度区间内每隔5K 的热力学函数值,列于表1中.2.3配合物Zn(Phe)(NO 3)2·H 2O 的标准摩尔生成焓由于Zn(NO 3)2·6H 2O(s)在空气中易潮解,因此本文工作选用ZnSO 4·7H 2O(s)和NaNO 3(s)作为所设计反应的反应物.目标配合物的标准摩尔生成焓的测定是在常压和298.15K 下,按下列化学反应方程式设计Hess 热化学循环进行的:图1样品Zn(Phe)(NO 3)2·H 2O(s)的实验摩尔热容与温度的关系曲线Fig.1Plots of heat capacities (C p ,m )against temperature (T )of the complex Zn(Phe)(NO 3)2·H 2O(s)insert:o )the first series,△)the second series,☆)the third series of heat capacity measurements1439Acta Phys.鄄Chim.Sin.,2007Vol.23ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)=Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)+6H 2O(l)(1)按照式(1)的计量系数为配比,以称取物质的量约为0.001mol 目标配合物Zn(Phe)(NO 3)2·H 2O(s)为基准,分别称取一定量的反应(1)中的反应物和产物.选用100mL 浓度为2mol ·L -1的盐酸作为量热溶剂.将反应物ZnSO 4·7H 2O(s)、NaNO 3(s)和L ⁃Phe(s)分别在玛瑙研钵中研细.在T =298.15K 时,将摩尔比为n (ZnSO 4·7H 2O(s))∶n (NaNO 3(s))∶n (L ⁃Phe(s))=1∶2∶1的混合物(称量时用干净硫酸纸隔开)溶解在浓度为2mol ·L -1的盐酸中.六次测量所得到的溶解焓(Δd H 0m,1)结果列在表2中.若“S ”为100mL 浓度为2mol ·L -1的盐酸,则:{ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}+“S ”=溶液A(solution A)将配合物Zn(Phe)(NO 3)2·H 2O(s)和Na 2SO 4(s)分别在玛瑙研钵中研细,在T =298.15K 时,将摩尔比为n [Zn(Phe)(NO 3)2·H 2O(s)]∶n [Na 2SO 4(s)]=1∶1的混合物(称量时用干净硫酸纸隔开)溶解在浓度为2mol ·L -1的盐酸中.六次测量所得到的溶解焓(Δd H 0m,2)结果列在表3中.若“S ”为100mL 浓度为2mol ·L -1的盐酸,则:{Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}+“S ”=溶液A ′(solution A ′)作为反应(1)产物之一的{6H 2O(l)},在溶液A ′中稀释焓的测定可以表示如下:溶液A ′+{6H 2O(l)}=溶液A由于按照水在这个反应中的计量系数,与其它反应物等当量的水的质量很小.这个过程的稀释焓(Δd H 0m,3)太小,在实验测定误差范围之内,不能检测到,所以可忽略不计.按照Hess 定律,反应(1)的焓变(Δr H m,1)能够通过{ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}(Δd H 0m,1)和{Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}(Δd H 0m,2)在溶剂中的溶解焓计算如下:Δr H m,1=Δd H 0m,1-(Δd H 0m,2+Δd H 0m,3)=(21.28±0.06)kJ ·mol -1此反应焓与一些文献已有的热力学数据,如,T /KC p ,m(J ·mol -1·K -1)(H T -H 298.15)(J ·mol -1)(S T -S 298.15)(J ·mol -1·K -1)(G T -G 298.15)(J ·mol -1)298.15496.754000300500.539307.98 3.0889-618.70305511.4191176.811.464-2319.8310523.4462102.919.890-4063.0315536.8983092.828.386-5848.9320552.0914154.436.976-7677.8325569.3825297.445.685-9550.1表1配合物Zn(Phe)(NO 3)2·H 2O(s)的热力学函数Table 1Thermodynamic functions of the complexZn(Phe)(NO 3)2·H 2O(s)10.37400.1426 1.5640 1.5866469.6548.18248.0120.37340.1424 1.6897 1.6955465.7348.30448.2030.37410.1426 1.5364 1.5778477.8548.42748.2440.37430.1427 1.6495 1.6703469.6948.27448.0550.37460.1428 1.6704 1.6947471.5948.37748.1260.37340.14241.57181.6019473.1948.31948.21average(48.14±0.04)No.m (Zn(Phe)(NO 3)2·H 2O)/gm (NaSO 4)/g ΔE e /mV ΔE s /mV t e /s Q s /J Δd H 0m,2/(kJ ·mol -1)表3{Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}混合物在2mol ·L -1盐酸中的溶解焓Table 3Dissolution enthalpy of {Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}mixture in 2mol ·L -1HCl表2{ZnSO 4·7H 2O(S)+2NaNO 3(s)+L ⁃Phe(s)}混合物在2mol ·L -1盐酸中的溶解焓Table 2Dissolution enthalpy of {ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}mixture in 2mol ·L -1HClΔd H 0m,1=(ΔE s /ΔE e )I 2Rt e (M /m ),where R is the electro ⁃resistance (R =1017.2Ω);I is the electrical current (I =10.115mA);M is the molar mass,m is mass of sample;t e is heating period of electrical calibration;ΔE e is the voltage change during the electrical calibration;ΔE s is the voltage change during thesample dissolution;Q e is electrical energy of electrical calibration;Q s is heat effect of the dissolution.No.m (ZnSO 4·7H 2O)/gm (NaNO 3)/g m (Phe)/g ΔE e /mV ΔE s /mV t e /s Q s /J Δd H m,1/(kJ ·mol )10.28860.17060.16579 1.9979 2.3595788.2869.46669.2220.28820.17040.16556 1.9965 2.3619792.1769.68969.5330.28870.17070.16584 2.0175 2.3668786.4869.77369.5040.28890.17080.16596 1.9911 2.3704797.2069.69269.3750.28910.17090.16607 1.9965 2.3583793.2069.88769.5260.28820.17040.165561.99682.3629790.5369.52569.37average(69.42±0.05)1440No.9邸友莹等:配合物Zn(Phe)(NO 3)2·H 2O(s)的低温热容和标准摩尔生成焓Δf H 0m(Na 2SO 4(s))=-1387.08kJ ·mol -1[11],Δf H 0m (NaNO 3(s))=-466.24kJ ·mol -1[12],Δf H 0m(ZnSO 4·7H 2O(s))=-3077.75kJ ·mol -1[12],Δf H 0m(L ⁃Phe(s))=-(476.21±3.51)kJ ·mol -1[13]和Δf H 0m (H 2O(l))=-(285.83±0.04)kJ ·mol -1[14]等相结合,可求出Zn(Phe)(NO 3)2·H 2O(s)的标准摩尔生成焓,其反应总汇如表4所示.Δf H 0m(Zn(Phe)(NO 3)2·H 2O(s))=ΔH 9=ΔH 1-(ΔH 2+ΔH 3)+(2ΔH 4+ΔH 5+ΔH 6-ΔH 7-6ΔH 8)=Δr H m,1+2Δf H 0m (NaNO 3(s))+Δf H 0m (ZnSO 4·7H 2O(s))+Δf H 0m (L ⁃Phe(s))-Δf H 0m (Na 2SO 4(s))-6Δf H 0m (H 2O(l))=-(1363.10±3.52)kJ ·mol -1紫外⁃可见(UV ⁃Vis)光谱和折光指数结果是判别两种溶液的化学组成和物理性质是否相同的主要依据.由反应(1)中反应物和产物的溶解所得到的溶液(溶液A 和溶液A ′)具有几乎相同的UV ⁃Vis 光谱图,如图2所示.溶液A 的折光指数为(1.6399±0.0007),溶液A ′为(1.6396±0.0006).由此可以看出,溶液A 和溶液A ′处于等同的热力学状态.这些结果表明两种溶液的结构和性质相同.因此,所设计的Hess 热化学循环是合理的,能够用来计算目标配合物Zn(Phe)(NO 3)2·H 2O(s)的标准摩尔生成焓.References1Mahmoud,M.;Abdel ⁃monem,S.;Paul,M.Method of nutritional supplementation for zinc and methionine by ingesting 1:1zinc methionine Patent,US 4039681.1977(Chem.Abstr.,1977,87:15196)2Taguchi,S.;Inokuchi,M.;Nakajima,N.;Inomata,M.;Natitoh,Y.Antipruritic drug and antipruritic composition.WO Patent,WO 10178.1992(Chem.Abstr.,1992,117:258218)3Gao,S.L.;Hou,Y.D.;Liu,J.R.;Ji,M.;Chen,S.P.Acta Chim.Sin.,2000,58(1):65[高胜利,侯育冬,刘建睿,冀棉,陈三平.化学学报,2000,58(1):65]4Tan,Z.C.;Sun,G.Y.;Sun,Y.J.Therm.Anal.,1995,45:595Tan,Z.C.;Liu,B.P.;Yan,J.B.;Sun,L.X.Journal of Computer and Applied Chemistry,2003,20(3):265[谭志诚,刘北平,颜君彪,孙立贤.计算机与应用化学,2003,20(3):265]6Ditmars,D.A.;Ishihara,S.;Chang,S.S.;Bernstein,G.;West,E.D.J.Res.Natl.Bur.Stand.,1982,87:1597Di,Y.Y.;Gao,S.L.;Li,L.W.;Tan,Z.C.J.Chem.Thermodynamics,2006,38:8848Di,Y.Y.;Tan,Z.C.;Gao,S.L.;Wang,S.X.J.Chem.Eng.Data,2004,49:9659Dickinson,H.C.Bull.Natl.Bur.Stand.(US),1914,11:18910Rychly,R.;Pekarek,V.J.Chem.Thermodynamics,1977,9:39111Wagman,D.D.;Evans,W.H.;Parker,V.B.;Schumm,R.H.;Halow,I.;Bailey,S.M.;Churney,K.L.;Nuttall,R.L.J .Phys.Chem.Ref.Data,1982,11(suppl.2):2-30612Dean,nge ′s handbook of chemistry.Trans.Shang,J.F.;Cao,S.J.;Xin,W.M.;Zheng,F.Y.;Lu,X.M.13th ed.Beijing:Science Press,1991:4-126[兰氏化学手册.尚久方,操时杰,辛无名,郑飞勇,陆晓明,林长青译.北京:科学出版社,1991:4-126]13Sabbah,R.;Minadakis,C.Thermochim.Acta,1981,43:26914Pedley,J.B.;Muylor,R.D.;Kirby,S.P.Thermochemical data of organic compounds.2nd ed.London:Champman and Hall,1992:174表4确定配合物Zn(Phe)(NO 3)2·H 2O(s)标准摩尔生成焓的反应总汇Table 4Reaction scheme used to determine the standard molar enthalpy of formation of Zn(Phe)(NO 3)2·H 2O(s)∗σa =Σi=16(x i -x⎺)2/(n (n -1))√,in which n is the experimental number;x i is a single value in a set of dissolution measurements;x ⎺is the mean value of a set of measurement results.图2溶液A 和溶液A ′的紫外⁃可见光谱图Fig.2UV ⁃Vis spectra of solution A and solution A ′No.ReactionsFormed solution (Δf H 0m or Δd H 0m ±σa )∗/(kJ ·mol -1)1{ZnSO 4·7H 2O(s)+2NaNO 3(s)+L ⁃Phe(s)}+“S ”=Solution A A (69.42±0.05)(ΔH 1)2{Zn(Phe)(NO 3)2·H 2O(s)+Na 2SO 4(s)}+“S ”=Solution A ′A ′(48.14±0.04)(ΔH 2)3Solution A ′+{6H 2O(l)}=Solution A A 0(ΔH 3)4Na(s)+(1/2)N 2(g)+(3/2)O 2(g)=NaNO 3(s)-466.24(ΔH 4)5Zn(s)+S(s)+(11/2)O 2(g)+7H 2(g)=ZnSO 4·7H 2O(s)-3077.75(ΔH 5)69C(s)+(11/2)H 2(g)+O 2(g)+(1/2)N 2(g)=L ⁃Phe(s)-(476.21±3.51)(ΔH 6)72Na(s)+S(s)+2O 2=Na 2SO 4(s)-1387.08(ΔH 7)8H 2(g)+(1/2)O 2(g)=H 2O(l)-(285.83±0.04)(ΔH 8)9Zn(s)+27C(s)+(35/2)H 2(g)+(13/2)O 2(g)+(5/2)N 2(g)=Zn(Phe)(NO 3)2·H 2O(s)-(1363.10±3.52)(ΔH 9)diluted 1:201441。
西北大学学报(自然科学版)2004年6月,第34卷第3期,Jun.,2004,Vol.34,No.3Journal of North west University (Natural Science Edi tion)收稿日期:2003-04-10基金项目:国家自然科学基金资助项目(20171023);陕西省教育厅专项科研计划基金资助项目(00JK158)作者简介:王小芳(1962-),女,河南许昌人,西北大学副教授,博士生,从事物理化学研究。
3种氨基酸锌配合物在水中的溶解焓王小芳,王 芳,高胜利(西北大学化学系/陕西省物理无机化学重点实验室,陕西西安 710069)摘要:目的 测定锌与A -Leu,A -Val,A -Thr 3种配合物于298115K 时在水中的溶解焓。
方法 用微量热计,在平衡后记录溶液热效应曲线,计算其溶解焓。
然后依据盖斯定律,计算出Zn(AA)2+(aq,])的标准生成焓。
结果 Zn(Leu)2+(aq),Zn(Val)2+(aq)和Zn(Thr)2+(aq)在298.15K 时的溶解焓分别是(3.17?0.09),(28.46?0.08)及(16.18?0.09)kJ/mol 。
Zn(AA)2+(aq,])的标准生成焓分别是(-1088.26?4.28),(-569.71?3.84)和(955.24?5.70)kJ/mol 。
结论 所用微量热计测定的结果准确可靠。
关 键 词:锌;氨基酸;溶解焓中图分类号:O642.1 文献标识码:A 文章编号:1000-274Ú(2004)03-0294-03 A -氨基酸锌作为添加剂在药物、食品和化妆品中有广泛的应用前景[1,2]。
许多文献已报道了硫酸锌与L-A -亮氨酸(Leu),L-A -缬氨酸(Val),L-A -苏氨酸(Thr)配合物的合成和性质[3~5]。
它们的标准生成焓已有报道[6],但作为应用中很重要的溶解焓数据似未见报道。

新型添加剂氨基酸锌的制备及性质一、实验目的1、熟悉氨基酸锌的合成原理及其方法。
2、对配合物的组成、结构、纯度、热稳定性和热化学性质进行分析。
二、实验原理锌是人体生命必需的微量元素之一,人体缺锌是一种普遍现象。
硫酸锌是主要的补锌药物,已用来治疗口腔溃疡、痤施、食欲不振、肠原性肢体皮炎,胃溃疡、不孕症、湿疹、免疫力低、下肢溃疡、感冒等症。
但对胃肠道产生较严重的不良反应,个别会引起胃出血。
为此人们合成了甘荜锌,葡萄糖酸锌等锌剂,已广泛用于临床。
由于氦基酸所特有的生理功能,氨基酸与锌的配合物,会产生有利于人体的协同作用。
氨基酸锌的主要优点为(1)用氨基酸作为螯合剂,对胃酸亢进或消化性溃疡有好处, (2)氨站酸本身含有电负性很强的N原子,能接受H+质子,还能治疗贵疡病的。
氨基酸锌是以二价锌阳离子与给电子氨基中N原子形成配位键,又与给电子的羰基形成五元或六元环,是一螯合物,具有以下特点:①金属与氨基酸形成的环状结构使分子内电荷趋于中性,在体内pH条件下溶解性好,容易被小肠黏膜吸收进入血液供全身细胞需要,不损害肠胃,故生物利用率高;②具有良好的化学稳定性和热稳定性,具有抗干扰、缓解矿物质之间的拮抗竞争作用,不仅能补锌,又能补氨基酸;③流动性好,与其他物质易混合且稳定不变质、不结块、使用安全、易于储存;④既含氨基酸,又含锌,两者都具有一定的杀菌作用,具有很好的配伍性。
配位化学中的螯合物(Chelate)是一种特殊的络合物。
在其化学结构中,配位体(Ligands)通过配位基和自身的碳链与金属离子形成环状结构。
该环状结构如同蟹、虾等动物(配位体)以螯足夹持着金属离子。
因此,这种络合物被形象地称为螯合物。
配位体又称螯合剂(Chelating Agents)。
氨基酸螯合锌的结构:氨基酸螫合锌是第三代微量元素添加剂,由Zn2+与氨基酸按-定的物质的量比形成的一.类具有独特环状结构的螯合物,结构式如下图所示。
其中:X=NH2:X2=H2或0;M是Zn2+:而R是包含有混合物氨基酸的碳,它有或没有-S.-NH-C0OH或其他官能团,是一般氨基酸。
化学实验设计新型氨基酸锌金属配合物的制备姓名:学号:年级:班级: 学院: 导师:目录摘要 (1)1. 前言 (1)2. 实验目的 (2)3. 实验原理 (2)4•实验设备 (2)5•实验材料及试剂 (3)5.1试剂的配制 (3)5.2材料的处理 (3)5.2.1反应时间的选择 (3)5.2.2反应温度的选择 (3)5.2.3配合物配比的选择 (3)6. 实验操作步骤 (4)7. 结果及计算 (4)8. 讨论 (5)8.1 L 一甘氨酸及甘氨酸锌为例的红外与拉曼光谱分析 (5)参考文献 (8)新型氨基酸锌金属配合物的制备摘要氨基酸是生物体内大量存在的一类生物配体,是蛋白质、酶等的基本结构单元,研究稀土及过渡金属与氨基酸的相互作用将为探索稀土及过渡金属在生物体内的代谢及其生物效应提供基础。
为此,近年来,稀土及过渡金属氨基酸配合物的研究一直为人们所重视,尤其是近十年来发展迅速。
本文概述了近年来锌金属的氨基酸配位化合物的研究,主要介绍了它的性质、运用以及发展等。
对氨基酸配合物的性质研究,主要集中在讨论此类配合物的稳定性和成键特征等方面。
关键词:氨基酸锌金属配合物制备1. 刖言氨基酸是生物体内大量存在的同时具有氨基和羧基的双官能团生命小分子配体,是构成生物体内蛋白质、酶的基本结构单元⑴,氨基酸金属配合物等小分子配合物不仅具有重要生物功能,而且也往往是金属蛋白,金属酶等生物大分子配合物为维持其结构和功能所必需的活性中心。
研究过渡金属与氨基酸的相互作用将为探索过渡金属在生物体内的新陈代谢及其生物效应提供基础[2]。
L 一甘氨酸,L 一丙氨酸,L 一苏氨酸是三种蛋白质氨基酸,表2.1是三种氨基酸的结构式及基本性质⑶。
本论文以上述三种氨基酸作为配体,讨论了其与锌盐(氯化锌,硫酸锌,硝酸锌)的配位反应。
表2」三种氨基酸的基本性质Table 2A The main properties of tbree amino acid名称缩写结构式pKo-Nlh答电点(Pl)分子量甘氨酸甘H^N-CHj-COOH ZU 5.9775 (glycine)(Gl%G)丙亂酸丙HjN-CHCOOH2J4w 6.00(alanine)(AUA)CH J苏規酸苏HjN—CH- COOTCH OH 2.099J0 5.60119(theronine)(Thr,n1CH3金属氨基酸配合物的合成是通过无机盐与氨基酸在一定条件下反应制得的,制备方法可归纳为液相反应合成法阵[4-5]、固一液相反应合成法⑹.固相反应合成法[7]及电解合成法[8]、相平衡合成法[9]等。
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202010695217.4(22)申请日 2020.07.19(71)申请人 广州天科生物科技有限公司地址 510000 广东省广州市花都区花东镇湾弓塘居委会山前大道老虎头1号广州天科生产基地申请人 广东有机宝生物科技股份有限公司(72)发明人 吴彤彪 许详 黄志鹏 (74)专利代理机构 广州厚海专利商标代理事务所(普通合伙) 44662代理人 梁桂萍(51)Int.Cl.G01N 31/16(2006.01)(54)发明名称一种氨基酸锌络合物中游离锌含量的检测方法(57)摘要本发明涉及一种游离锌含量检测技术领域,尤指一种氨基酸锌络合物中游离锌含量的检测方法,主要包括步骤:S1、称取氨基酸锌络合物样品加入烧杯中;S2、往烧杯中加入螯合剂溶液并搅拌,后进行过滤得到滤液A,加入螯合剂溶液对烧杯和滤纸进行重复三次冲洗,冲洗液与滤液A合并为总的滤液,并放置于锥形瓶中;S3、往滤液中添加乙酸溶液以调节溶液的酸碱度,并加入二甲酚橙指示剂;S4、往溶液中滴加六次甲基四胺溶液,然后采用乙二胺四乙酸二钠标准溶液滴定;S5、计算获得游离锌的百分含量;本发明高效检测甘氨酸锌、苏氨酸锌、赖氨酸锌中游离锌的含量,精确判定产品是否反应完全或者生成了多少锌水解产物,便于评价产品的优劣,以及指导工艺和生产。
权利要求书1页 说明书6页CN 111693644 A 2020.09.22C N 111693644A1.一种氨基酸锌络合物中游离锌含量的检测方法,其特征在于,所述的检测方法主要包括以下步骤:S1、称量样品:称取氨基酸锌络合物样品加入烧杯中;S2、过滤取滤液:往步骤S1的烧杯中加入螯合剂溶液,并在常温下搅拌,搅拌5min后进行过滤得到滤液A,然后加入螯合剂溶液对烧杯和滤纸进行重复三次冲洗,冲洗液与滤液A 合并为总的滤液,并放置于250mL锥形瓶中;S3、调节pH:往步骤S2的滤液中添加乙酸溶液以调节溶液的酸碱度,并加入二甲酚橙指示剂;S4、处理:往步骤S3的溶液中滴加六次甲基四胺溶液,然后采用乙二胺四乙酸二钠标准溶液滴定;S5、计算:计算获得游离锌的百分含量。
题目甘氨酸锌螯合物的合成及锌含量的测定学院医药化工学生姓名谢尚杰班级20011级化学制药(2)班学号1132220057指导教师李芳甘氨酸锌螯合物的合成及锌含量的测定医药化工学院化学制药学生:谢尚杰指导老师:李芳摘要:本实验是以碱式碳酸锌和甘氨酸为原料制备甘氨酸锌螯合物。
在95℃条件现加热搅拌合成产物产率稳定且反应条件易控制。
得到产品灰化后得到ZnO,用标准浓度的EDTA滴定其盐溶液,经换算得到锌的含量。
关键词:碱式碳酸锌;甘氨酸锌螯合物;EDTA1.前言1.1锌的作用1.1.1是人体中100多种酶的组成部分。
这些酶在组织呼吸和蛋白质、脂肪、糖、核酸等代谢中起重要作用。
1.1.2锌是DNA聚合酶的必需组成部分,缺锌时蛋白质合成障碍。
可导致侏儒症、损伤组织愈合困难、胎儿发育受影响。
1.1.3锌参加唾液蛋白构成,锌缺乏可导致味觉迟钝,食欲减退。
1.1.4锌参加维生素A还原酶和视黄醇结合蛋白的合成。
1.1.5促进性器官正常发育保持正常的性功能。
缺锌导致性成熟迟缓,性器官发育不全,性功能降低,性冷淡,精子减少,月经不正常。
1.1.6保护皮肤健康。
缺锌时皮肤粗糙、干燥、上皮角化和食道类角化;伤口愈合缓慢,易受感染。
1.1.7维护免疫功能。
根据锌在DNA合成中的作用,缺锌时导致免疫细胞增殖减少,胸腺活力降低。
由于锌在抗氧化生化酶中的作用,缺锌导致细胞表面受体发生变化。
1.1.8其他功能:锌有助于清除体内胆固醇,防治动脉粥样硬化症;锌有助于抑制癌症的发生等。
锌的来源可以是锌单质、氧化锌、氯化锌、硫酸锌、碳酸锌、碱式碳酸锌等,在自然界中有较多的含量。
但大部分的锌不能,或较难被人体吸收。
有些还有着严重的副作用。
因此发现良好的补锌药剂是我们探索的目标。
现在市面上的补锌药剂有葡萄糖酸锌、醋酸锌、氨基酸锌。
1.1.2葡萄糖酸锌葡萄糖酸锌的制备有多种制备方法。
①复分解反应将硫酸锌溶于近沸的水中,在恒温不断搅拌下,分次加人葡萄糖酸钙,待反应完成后,滤去沉淀,滤液浓缩结品,得到粗品,经溶解重结晶后得产品一.zJ,其制备反应为:Ca(C6H111O7 ) 2+ZnSO 4= CaSO4+Zn( HO )2该法合成工艺简单,但由于CaSO4 微溶于水,残留于产品中的硫酸根不易除去产品质量不高.②离子交换树脂法等摩尔葡萄糖酸钙与硫酸在9OC反应,制得葡萄糖酸,趁热滤去硫酸钙,再经离子交换树脂后与氧化锌或氢氧化锌反应,生成葡萄糖酸锌产率在85 %以上.若在产品浓缩过程中.加人95% 乙醇作为结晶促进剂,产率将提高达91.2%,此法较上述方法产品质量高,但合成路线较长,且有副产物生成.③空气催化氧化法在催化剂Pd(Pt)c存在下.葡萄糖经空气氧化成葡萄糖睦.分次加人理论量的氢氧化钠生成葡萄糖酸钠,瑞经过离子交换树脂,得葡萄糖酸.进一步与氧化锌作用得到葡萄糖酸锌,经浓缩.结晶、重结晶后,即得产品.该法氧化反应时间长达15h,方能使转化中的葡萄糖下降到5% 下,本法的技术关键是制备高活性的催化剂,并有效地回收贵金属.使生产成本降低,其合成方程式为:C6 H12 O 5= C6H12 O7 NaC6H 12O7 Na+ 2H2O = C6H12O72C6 H12O7十ZnO = Zn(C6H12O7)2+H2O贺必武改进了上述工艺.在氧化过程中.直接加八廉价的石灰乳,只需3 h便可使葡萄糖酸钙收率达9j 以上,生成的葡萄糖酸钙经复分解法转化成酸.再与氧化锌反应,可生产出符合美国药典质量的葡萄糖酸锌.这种工艺大大缩短了催化氧化所需时间,降低了生产成本,是目前催化氧化法中较先进的合成工艺.葡萄酸锌的特性及适用人群属于常用辅助药物。
西北大学学报(自然科学版)2004年6月,第34卷第3期,Jun.,2004,Vol.34,No.3Journal of North west University (Natural Science Edi tion)收稿日期:2003-04-10基金项目:国家自然科学基金资助项目(20171023);陕西省教育厅专项科研计划基金资助项目(00JK158)作者简介:王小芳(1962-),女,河南许昌人,西北大学副教授,博士生,从事物理化学研究。
3种氨基酸锌配合物在水中的溶解焓王小芳,王 芳,高胜利(西北大学化学系/陕西省物理无机化学重点实验室,陕西西安 710069)摘要:目的 测定锌与A -Leu,A -Val,A -Thr 3种配合物于298115K 时在水中的溶解焓。
方法 用微量热计,在平衡后记录溶液热效应曲线,计算其溶解焓。
然后依据盖斯定律,计算出Zn(AA)2+(aq,])的标准生成焓。
结果 Zn(Leu)2+(aq),Zn(Val)2+(aq)和Zn(Thr)2+(aq)在298.15K 时的溶解焓分别是(3.17?0.09),(28.46?0.08)及(16.18?0.09)kJ/mol 。
Zn(AA)2+(aq,])的标准生成焓分别是(-1088.26?4.28),(-569.71?3.84)和(955.24?5.70)kJ/mol 。
结论 所用微量热计测定的结果准确可靠。
关 键 词:锌;氨基酸;溶解焓中图分类号:O642.1 文献标识码:A 文章编号:1000-274Ú(2004)03-0294-03 A -氨基酸锌作为添加剂在药物、食品和化妆品中有广泛的应用前景[1,2]。
许多文献已报道了硫酸锌与L-A -亮氨酸(Leu),L-A -缬氨酸(Val),L-A -苏氨酸(Thr)配合物的合成和性质[3~5]。
它们的标准生成焓已有报道[6],但作为应用中很重要的溶解焓数据似未见报道。
1 实验部分1.1 试 剂ZnSO 4#7H 2O 为AR 级(西安化学试剂厂),L -A -Leu,L -A -Val 和L-A -Thr 为BR 级(上海康达氨基酸厂),纯度>99.95%;去离子水电导率为5.48@10-8S/c m 。
1.2 分析方法Zn 2+含量用EDTA 滴定法测定;氨基酸用甲醛碱量法测定;测定前用草酸钾溶液掩蔽Zn 2+;C,H,N 含量用美国PE 公司2400元素分析仪测定;SO 2-4含量用重量法测定。
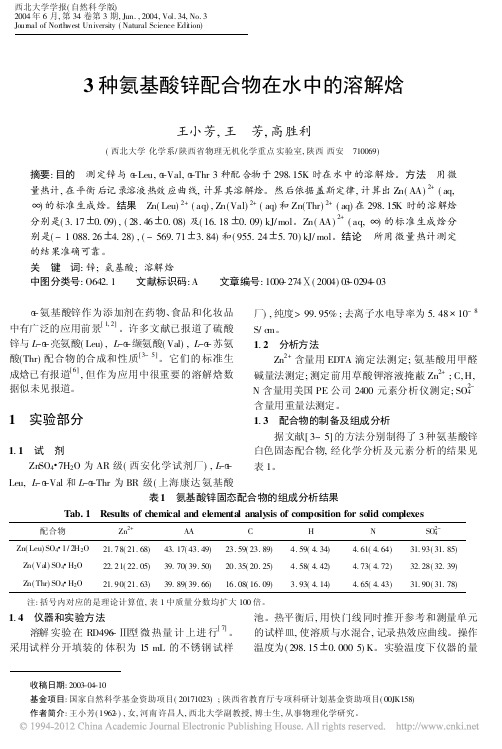
1.3 配合物的制备及组成分析据文献[3~5]的方法分别制得了3种氨基酸锌白色固态配合物,经化学分析及元素分析的结果见表1。
表1 氨基酸锌固态配合物的组成分析结果Tab.1 Results of chemical and elemental analysis of composition for solid complexes配合物Zn 2+AA C H N SO 2-4Zn(Leu)SO 4#1/2H 2O 21.78(21.68)43.17(43.49)23.59(23.89) 4.59(4.34) 4.61(4.64)31.93(31.85)Zn(Val)SO 4#H 2O 22.21(22.05)39.70(39.50)20.35(20.25) 4.58(4.42) 4.73(4.72)32.28(32.39)Zn(Thr)SO 4#H 2O21.90(21.63)39.89(39.66)16.08(16.09)3.93(4.14)4.65(4.43)31.90(31.78)注:括号内对应的是理论计算值,表1中质量分数均扩大100倍。
1.4 仪器和实验方法溶解实验在RD496-Ó型微热量计上进行[7]。
采用试样分开填装的体积为15mL 的不锈钢试样池。
热平衡后,用快门线同时推开参考和测量单元的试样皿,使溶质与水混合,记录热效应曲线。
操作温度为(298.15?0.0005)K 。
实验温度下仪器的量热常数和仪器的准确度与精密度确定方法与文献[8]相同。
结果表明,所用量热系统准确可靠。
2结果与讨论在实验条件下,终态溶液的pH值为5~6,此时Zn2+与AA均以1B1配合物状态存在于水中[9],有较大的稳定性,lg K分别为4.51,4.44,4.43。
溶解试验后在溶液中未检出固体残渣,表明配合物是完全溶解的。
测定结果见表2,其中r为n(H2O)/n(配合物)物质的量的比值。
由于r值很大,实验条件下溶解焓与浓度几乎无关系,因此,可认为该溶解焓为配合物在无限稀释下的溶解焓。
溶解过程可用下式表示Zn(Leu)SO4#12H2O(s)yZn(Leu)2+(aq,])+SO2-4(aq)+12H2O(l),(1) Zn(Val)SO4#H2O(s)yZn(Val)2+(aq,])+SO2+4(aq)+H2O(l),(2) Zn(Thr)SO4#H2O(s)yZn(Thr)2+(aq,])+SO2+4(aq)+H2O(l)。
(3)表2配合物在水中的溶解焓(298.15K)Tab.2Enthalpies of solution in water of complexes(298.15K)配合物质量/mg r$sol H H/kJ#mol-1平均值/kJ#mol-1 Zn(Leu)SO4#1/2H2O7.9016955 3.1214.789063 3.2021.446247 3.07 3.17?0.0923.195776 3.2524.425485 3.1026.085136 3.28Zn(Val)SO4#H2O9.311414728.589.811342628.5010.811218428.4212.701037128.3828.46?0.0814.15930828.3714.80889928.52Zn(Thr)SO4#H2O26.97491616.2027.90475216.1729.33452116.3316.18?0.0931.78417216.1033.06401116.19显然,3种固态配合物的溶解反应均为吸热反应。
依据盖斯定律,由式(1~3)计算出Zn(AA)2+ (aq,])的标准生成焓$f H H m[Zn(AA)2+,aq,298.15K]=$sol H H m[配合物,s,298.15K]+$f H H m(配合物,s,298.15K)-$f H H m (SO2-4,aq,298.15K)-n$f H H m(H2O,l,298115K)。
式中:AA=Leu;n=1/2;AA=Val或Thr;n=1。
计算结果分别为$f H H m[Zn(Leu)2+,aq,298.15K]=(-1088.26?4.28)kJ/mol,$f H H m[Zn(Val)2+,aq,298.15K]=(-569.71?3.84)kJ/mol,$f H H m[Zn(Thr)2+,aq,298.15K]=(955.24?5.70)kJ/mol。
其中,$so l H H m[配合物,s,298.15K]取自表2,$f H H m(配合物,s,298.15K)分别取(-2286.86?4.26),(-1 793.60?3.82),(-256.37?5.69)kJ/mol[6],$f H H m(SO2-4,aq,298.15K)=(-909.60?0.40) kJ/mol[9],$f H H m(H2O),l,298.15K)=(-285.830?0.042) kJ/mol[9]。
参考文献:[1]MAHMOUD M,ABDEL-MONEM.Zinc methionine complexfor acne treatment[P].US Patent4039681,1977-08-02. [2]TAGUC HI S,INOKUC HI M,NAKAJIMA M,et al.Antipruri t-ic pharmaceutical plant extracta[P].WO Paten t,10118,1992-06-25.[3]杨旭武,张晓玉,高胜利,等.硫酸锌与L-亮氨酸配合行为的研究[J].物理化学学报,2000,16(9):850-854.)295)第3期王小芳等:3种氨基酸锌配合物在水中的溶解焓[4] 张晓玉,杨旭武,冀 棉,等.硫酸锌与L -A -缬氨酸固体配合物的合成与表征[J].应用化学,2000,17(3):243-247.[5] 高胜利,张晓玉,杨旭武,等.ZnSO 4-Thr -H 2O 体系(25e )的相平衡及配合物的合成与性质[J].化学学报,2001,59(1):73-77.[6] GAO S L,ZHANG X Y,YANG X W,et al .Preparati on andthermochemical properties of solid complexes of zinc amino acid[J].Chemical Journal on Internet,2000,26(2):2-3.[7] JI M ,LIU M Y,GAO S L,et al .A new microcalorimeter formeasuring thermal effects [J].Instrumentation Science &Technology,2001,29(1):53-54.[8] 高胜利,冀 棉,陈三平,等.硫酸锌与组氨酸的固液反应的热动力学研究[J].无机化学学报,2001,17(5):675-678.[9] COX J D.CODATA recommended key values for thermody -namics[J].J Chem Thermodyn,1978,10(10):903-904.(编 辑 陈镱文)The enthalpies of solution of complexes of zinc withthree amino acids in waterWANG Xiao -fang,WANG Fang,GAO Sheng -li(Department of Chemistry/Shaanxi Provincial Key Laboratory of Physico -Inorganic Chemistry,Northwest University,Xi c an 710069,Chi na)Abstract:Aim To measure the enthalipies of solution of complexes of zinc with L-A -Leucine,L -A -Valine and L -A -Threonine in water at 298K.Methods Measuring the curve of heat effect of the mixture of solute and water after thermal equilibrium by using microcalorimeter and calc ulating the enthalipies of solution according to hess c s law.Results Thevalues of the enthalipies of solution of three complexes are (3.17?0.09)kJ/mol and (28.46?0.08)kJ/mol and (16.18?0.09)kJ/mol respectively.The standard enthalpies of formation of Zn(AA)2+(aq)have been calculated.The y are (-1088.26?4.28)kJ/mol,(-569.71?3.84)kJ/mol and (955.24?5.70)kJ/mol.Conclusion The m-icrocalorimeter used is accurate and reliable.Key words:Zinc;aminoacids;enthalpy of solution#学术动态#哈萨克斯坦考察团来我校访问由哈萨克斯坦共和国总统办公厅内政处主巡视员、哈萨克斯坦共和国人民委员会委员普里明#伏拉基米尔#瓦谢里耶维奇等5人组成的考察团来我校进行参观访问。