GST_catenin融合蛋白表达载体的构建及其在原核细胞中的表达
- 格式:pdf
- 大小:660.70 KB
- 文档页数:4


GST-hDaxx蛋白的构建及其原核表达产物的鉴定唐旭红;朱翠明;万艳平【期刊名称】《肿瘤防治研究》【年(卷),期】2004(31)3【摘要】目的构建GST hDaxx蛋白并在原核细胞中诱导表达GST hDaxx融合蛋白 ,并研究其与 p5 3的结合能力。
方法构建GST hDaxx融合蛋白原核细胞表达载体pGEX 4T/hDaxx ,在大肠杆菌 (E .col i)中用异丙基β D 硫代半乳糖苷(IPTG)诱导表达。
表达产物用亲和层析柱加以纯化后 ,Westernblot鉴定表达产物与纯化物。
通过共免疫沉淀反应与Westernblot观察hDaxx与p5 3的结合反应。
结果在原核细胞中成功表达了GST hDaxx融合蛋白 ,hDaxx与 p5 3可发生共免疫沉淀反应。
结论 1.GST hDaxx融合蛋白成功表达 ;2 .hDaxx和 p5 3的相互结合提示它们可能与肿瘤的发生有关。
【总页数】3页(P133-135)【关键词】GST-hDaxx蛋白;原核表达产物;鉴定;原核细胞;纯化;Western;blot法;融合蛋白;p53蛋白;肿瘤生成【作者】唐旭红;朱翠明;万艳平【作者单位】湖南中医学院西医诊断学教研室;湖南衡阳南华大学病原生物学研究所【正文语种】中文【中图分类】R730.23【相关文献】1.犬瘟热病毒N蛋白基因的克隆、原核表达及其表达产物抗原性鉴定 [J], 申卫红;马素贞;陈胜男;刘腾飞;陶玉成;简子健2.恶性疟原虫富组氨酸蛋白2的原核表达、纯化及表达产物的鉴定 [J], 李珣;薛采芳;缪军;甄荣芬;刘忠湘3.丙型肝炎病毒E1E2蛋白原核表达载体的构建及表达产物的鉴定 [J], 刘秋平;李光玉;杜德伟;潘蕾;魏欣;贾战生4.三角帆蚌(Hyriopsis cumingii)Perlucin蛋白原核表达条件的优化及表达产物的鉴定 [J], 林静云;白志毅;李家乐5.恶性疟原虫裂殖子表面蛋白1-17区基因的原核表达、纯化及表达产物鉴定 [J], 缪军;薛采芳;李珣;甄荣芬因版权原因,仅展示原文概要,查看原文内容请购买。
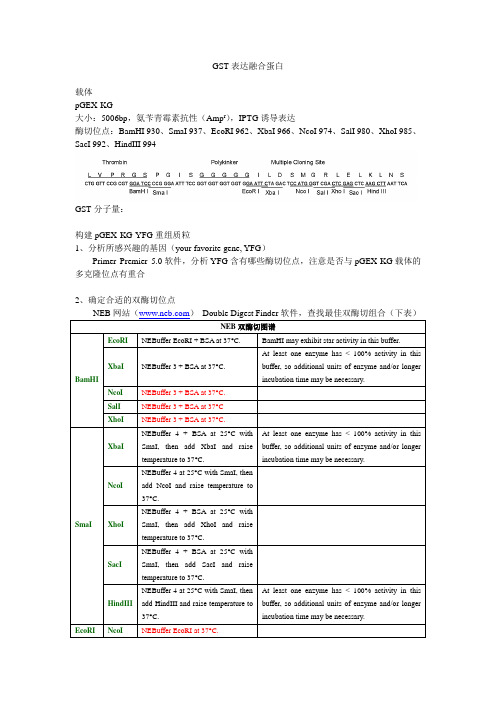
GST表达融合蛋白载体pGEX-KG大小:5006bp,氨苄青霉素抗性(Amp r),IPTG诱导表达酶切位点:BamHI 930、SmaI 937、EcoRI 962、XbaI 966、NcoI 974、SalI 980、XhoI 985、SacI 992、HindIII 994GST分子量:构建pGEX-KG-YFG重组质粒1、分析所感兴趣的基因(your favorite gene, YFG)Primer Premier 5.0软件,分析YFG含有哪些酶切位点,注意是否与pGEX-KG载体的多克隆位点有重合2、确定合适的双酶切位点NEB网站()Double Digest Finder软件,查找最佳双酶切组合(下表)NEB双酶切图谱BamHI EcoRI NEBuffer EcoRI + BSA at 37°C. BamHI may exhibit star activity in this buffer.XbaI NEBuffer 3 + BSA at 37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.NcoI NEBuffer 3 + BSA at 37°C.SalI NEBuffer 3 + BSA at 37°CXhoI NEBuffer 3 + BSA at 37°C.SmaI XbaINEBuffer 4 + BSA at 25°C withSmaI, then add XbaI and raisetemperature to 37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.NcoINEBuffer 4 at 25°C with SmaI, thenadd NcoI and raise temperature to37°C.XhoINEBuffer 4 + BSA at 25°C withSmaI, then add XhoI and raisetemperature to 37°C.SacINEBuffer 4 + BSA at 25°C withSmaI, then add SacI and raisetemperature to 37°C.HindIIINEBuffer 4 at 25°C with SmaI, thenadd HindIII and raise temperature to37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.EcoRI NcoI NEBuffer EcoRI at 37°C.3、设计PCR上、下游引物Primer Premier 5.0软件,设计PCR上、下游引物酶切位点外最多含6个碱基3’端不是A,最好是G或C,但是不推荐使用GC或CG结尾3’端至少保证有10个碱基完全配对得分(Rating)大于70[注意]上游引物:是否添加适当碱基,确保不打乱开放阅读框下游引物:添加终止密码子(UAA、UAG、UGA)4、引物合成及保存合成:上海生工生物工程技术服务有限公司(Email:******************,Tel:81767586);纯化方法:柱层析or聚丙烯酰胺凝胶电泳?;价格1.30/碱基保存:贮存浓度:100pmol/μl(100μM),工作浓度:10pmol/μl(10μM),-20°C保存5、PCR扩增YFG模板:质粒10ng/μl稀释少量-20°C保存引物:10pmol/μl(10μM)-20°C保存Taq酶:NEB Quick-Load Taq 2×Master Mix 扩增片段小于2.0kb反应条件(1)预变性94°C 5 min(2)变性94°C 30 s(3)退火待定30 s(4)延伸72°C 待定(5)重复2-5 25-30个循环(6)补平缺口72°C 10 min(7)暂存10°C[注意]退火温度:参考4(G+C)+2(A+T)-4(互补碱基),参考Ta Opt(Primer Premier 5.0)延伸时间:Taq酶:1kb/min循环数小于30,减少错配琼脂糖电泳检测PCR产物0.8%有效分离范围:10~0.8kb;1.0%有效分离浓度7~0.5kb50ml TAE加入5μl EB母液(5mg/ml)100V,30-45min拍照或者紫外灯下切胶回收6、构建pGEX-KG-YFG酶切:双酶切PCR产物、pGEX-KG回收:PCR产物直接回收、pGEX-KG电泳之后切胶回收连接:pGEX-KG 50ng、插入片段150ng转化铺平板:Amp r挑单克隆:Amp r(四个菌落足够了)鉴定:小提质粒酶切or菌体PCR7、转化BL21(DE3)pLysS菌株检测GST融合蛋白的表达(1)冰上融化BL21(DE3)pLysS感受态细胞(天根)(2)2 ml离心管中,加入25μl BL21+ 3μl质粒(300-500ng),混匀(质粒≤感受态1/10)(3)冰上放置30min(4)42°C,90s(5)冰上放置2-3min(6)加入300μl LB(无抗生素)(相当于菌体10倍体积的LB),37°C,250rpm,1 h (7)4000rpm,2min,弃上清,其余混匀以后涂平板(Amp r),37°C,过夜(16 h)(8)挑单克隆菌落,5ml LB(Amp r),37°C,250rpm,过夜(16 h)()稀释10倍、20倍、50倍测定OD600()选择合适的稀释倍数,5ml菌液,37°C,250 rpm,1 h,测定OD600(7)取100μl菌液加入5ml LB(Amp r)(50倍稀释),37°C,250rpm,过夜(16 h)(8)取500μl菌液加入5ml LB(Amp r)(10倍稀释)(其余菌液4°C保存),测OD600 (9)37°C,250 rpm,2 h(OD600:0.6-0.8),测OD600(10)室温放置20 min(摇床降温,30°C)(11)取100μl作为诱导前对照,冰上放置(12)菌液中加入IPTG,终浓度0.5-1 mM(13)30°C,250 rpm,2 -4h(可做时间梯度),测OD600(14)取100μl作为诱导后对照,连同诱导前菌液,12000rpm,离心2min,加入50μl 1×SDS 上样缓冲液(15)取4ml菌液,12000rpm,离心2min,收集到2ml离心管中(16)加入1ml GST裂解缓冲液重悬菌体(17)超声破碎细胞:超声20s,间隔10s,共3-5次,超声强度200-300W(冰浴)(18)超声后菌液换入一个新1.5ml离心管,4°C,12000rpm,离心5min(19)超声后上清:取25μl上清,加入25μl 2×SDS上样缓冲液(其余上清-80°C保存)(20)超声后沉淀:沉淀加入1ml GST裂解缓冲液重悬,取25μl,加入25μl 2×SDS上样缓冲液(其余沉淀-80°C保存)(21)将四个样品煮沸3min,12000rpm,离心5min(22)8-10%SDS-PAGE,30μl上样,顺序:诱导前菌体、诱导后菌体、超声后上清、超声后沉淀(23)考马斯亮蓝染色[注意](1)菌液OD值小于1即可(2)诱导时间最好做一个梯度,2-6h(3)诱导温度适当摸索,24°C、30°C(4)IPTG浓度可做梯度,1mM(5)超声条件可视实际情况改变,只要使细菌裂解充分即可,即菌液清亮不粘稠8、测序确认上海生工生物工程技术服务有限公司(Tel:81767529)测序引物:pGEX-3通用引物测序样品:过夜菌1ml;质粒(浓度大于50ng/μl,10μl)9、中提质粒(Promega)10、表达纯化GST融合蛋白(1)已经转化的菌液,或者重新转化BL21(DE3)pLysS(2)活化:取20μl菌液加入11ml LB(Amp r)(500倍稀释),37°C,250rpm,过夜(16 h)(3)取10ml菌液加入100ml LB(Amp r)(10倍稀释)(剩余菌液4°C保存)(4)37°C,250 rpm,1 h 10 min-1 h 20 min,OD600 0.6-0.8(OD600小于1.0即可)(5)取1ml菌液作为诱导前对照,冰上放置(6)加入IPTG,终浓度1 mM(7)30°C,250rpm,诱导适当时间(预实验确定)(8)取1ml菌液作为诱导后对照,连同诱导前菌液,12000rpm,离心2min,收集菌体,加入100μl 1×SDS上样缓冲液(9)其余菌液,分为两份,倒入50ml离心管,5000rpm,离心20 min,收集细胞(10)每管加入8-10ml GST裂解缓冲液重悬菌体,转移小烧杯中(无气泡)(11)超声破碎细胞:超声3s,间隔10s,40次左右,超声强度200-300W(冰浴)(12)将超声后菌液转移到50ml离心管中,4°C,13000rpm,离心20-30min(13)将上清转移到1个50ml离心管中,取出50μl,加入50μl 2×SDS上样缓冲液(其余上清-80°C保存)(14)将沉淀加入16-20ml GST裂解缓冲液(或PBS)重悬,取出50μl,加入50μl 2×SDS 上样缓冲液(其余沉淀-80°C保存)(15)将四个样品煮沸3min,12000rpm,离心5min(16)8-10%SDS-PAGE检测诱导、超声是否合适,30μl上样,顺序:诱导前菌体、诱导后菌体、超声后上清、超声后沉淀(17)考马斯亮蓝染色(18)混匀glutathione sepharose beads(4B)(mixed slurry),取200μl加入15ml离心管中(2份)(19)加入10ml PBS,混匀,3000rpm,离心3min,弃上清(20)加入超声后上清液,4°C轻柔摇荡60分钟(或过夜)(横放)(21)4°C,3000rpm,离心3min(22)10ml GST裂解缓冲液洗涤2次(冰上)(23)10ml TBS(含5mM MgCl2、1mM DTT)洗涤2次(冰上)(24)弃上清,加入1倍柱床体积的TBS(含5mM MgCl2、1mM DTT、50%甘油),混匀(25)取悬液测定蛋白浓度或SDS-PAGE(26)-20°C保存beads11、GST-Pull-down(1)10cm培养皿中,未处理的细胞或者转染的细胞(3-5μg质粒转染10cm培养皿,Cos-7、293T或者其他细胞,转染24h)(2)加入1ml 细胞裂解缓冲液,细胞铲刮下细胞(冰上)(3)将裂解液收集到1.5ml离心管中,振荡30s,冰上放置5min,重复2-3次,充分裂解细胞(4)4°C,12000rpm,离心15min,收集上清(5)测定蛋白浓度,取1mg总蛋白做GST-Pull-down?(6)留30μl作为input对照(input与Pull-down蛋白量约为1/10)(7)其余溶液,加入20μl glutathione sepharose beads(PBS洗涤过),4°C,轻柔振荡20min(8)12000rpm,离心3min(9)收集上清,分为两份,一份加入1-15μg GST结合的beads,另一份加入等量GST-融合蛋白结合的beads,4°C,轻柔振荡60min(10)3000rpm,离心3min,回收上清(11)1ml 细胞裂解缓冲液洗涤3次(12)弃尽上清,加入25μl 2×SDS上样缓冲液(13)煮沸3min,12000rpm,离心3min(14)SDS-PAGE,上样顺序:细胞裂解液input、x、GST、x、GST-融合蛋白(x:LSB)(15)考马斯亮蓝染色或免疫印迹[附录]GST裂解缓冲液(前四个组分配好之后4°C保存,DTT和蛋白酶抑制剂现用现加)常用IP细胞裂解液cleared lysates were incubated for 1.5 h with 3 μg immobilized GST or GST-32。

GST-MIG,GST-IP-10融合蛋白原核载体的构建与表达德吉央宗;李勇【摘要】目的探讨GST-MIG,GST-IP-10融合蛋白原核载体的构建与表达.方法高压水动力尾静脉注射pCMV-tag2B空载质粒的12只小鼠为对照组,注射pCMV-tag2B-HBx质粒的12只小鼠为观察组.采用Elisa法检测IFN-γ表达;采用免疫组化法检测小鼠肝脏中MIG,IP-10表达;扩增MIG,IP-10基因至pET42a,构建载体后行IPTG诱导表达;采用PAGE和Western blot法鉴定蛋白表达;采用GST柱纯化表达蛋白。
结果对照组小鼠肝脏中无MIG,IP-10表达,观察组小鼠肝脏中有MIG,IP-10表达;观察组小鼠肝脏中IFN-γ表达升高21.4%,对照组降低了54.1%,与小鼠肝脏中MIG,IP-10表达一致;MIG基因条带为330 bp,IP-10基因条带为246 bp,经重组质粒测序模版检测,并与Blast进行对比,测序结果与目的基因一致;未诱导组无蛋白表达,pET42a空载IPTG诱导仅有GST表达(26 kD),pET42a-mMIG,pET42a-mIP-10重组质粒IPTG诱导有mMIG,mIP-10表达;25℃下,IPTG质量浓度为0.2 mmol/L,转速为150 r/min,GST-MIG,GST-IP-10融合蛋白含量最高;上清经15%SDS-PAGE检测可提高目的蛋白纯度;采用Western blot检测融合蛋白,经GST柱纯化后可见融合蛋白条带.结论 GST-MIG,GST-IP-10融合蛋白原核载体可成功构建,具有高效表达特征,为制备抗体提供了良好条件.%Objective To investigate the construction and expression of GST-MIG, GST-IP-10 fusion protein ptotokaryon vector .Method 12 rats treated high pressure hydrodynamic tail vein injection of pCMV-tag2 B plasmid were taken as control group and 12 rats treated high pressure hydrodynamic tail vein injection of pCMV-tag2B-HBx plasmid were taken as observationgroup .The expression of IFN-γwas detected by ELISA method;the expression of MIG and IP-10 in liver were detected by immunohistochemical method;MIG and IP-10 genes were amplified to pET42a.After the construction of vector ,IPTG expression was induced;the protein expression was detected by PAGE and Western blot method;the expression protein was purified by GST column .Results The results showed that there was no expression of MIG and IP-10 in the liver of mice in the control group ,while MIG and IP-10 expressions were found in the observation group .IFN-γexpression in the liver was increased by 21 .4%in the observation group and that in the control group was reduced by54 .1%, which was in agreement with MIG and IP-10 expressions;MIG gene band was 330 bp,IP-10 gene band was 246 bp,and it was verified that the gene sequence was consistent with that of the target gene after the recombinant plasmid sequencing template detection and through the comparison with Blast;There was no protein expression in the non-induced group,there was only GST (26 kD)expression induced by pET42a IPTG,mMIG expression induced by pET42a-mMIG,pET42a-mIP-10 recombinant plasmid IPTG;The mass concentration of IPTG at 25℃ was 0.2 mmol/L, and speed ,the content of GST-MIG,GST-IP-10 fusion protein was highest at 150 r/m;The purity of target protein in the supernatant could be improved by 15%SDS-PAGE and the fusion protein band could be seen with Western blot method after the fusion protein was purified by GST column .Conclusion GST-MIG, GST-IP-10 fusion protein protokaryon vector can be successfully constructed ,which has a characteristic of high efficientexpression and can provide good conditions for the preparation of antibody .【期刊名称】《北华大学学报(自然科学版)》【年(卷),期】2013(000)004【总页数】5页(P413-417)【关键词】GST-MIG;GST-IP-10;融合蛋白;原核载体;构建与表达【作者】德吉央宗;李勇【作者单位】西藏大学医学院,西藏拉萨 850000;西藏大学医学院,西藏拉萨850000【正文语种】中文【中图分类】Q78趋化因子是机体内与肝素相结合的一种小分子蛋白,可将周围的白细胞输送至机体的炎症部位,趋化因子与相应的受体结合后可引导单核细胞有效穿透机体,并在机体获得性免疫应答过程中起着重要作用[1-3].IFN-γ是CX3C家族中趋化因子中的一员,可有效诱导部分单核因子的合成表达,在体内诱导MIG基因和IP-10基因的表达[4].有研究[5-6]表明:过继性HBV特异性基因转移至小鼠后,会造成肝脏内趋化因子的大量生成,进而诱发MIG和IP-10的高效表达,通过特异的抗原识别,进一步激活肝脏非实质细胞.为了探讨GST-MIG,GST-IP-10融合蛋白原核载体的构建与表达,此次研究选取小鼠24只,随机分为两组,行高压水动力尾静脉注射pCMV-tag2B空载质粒和pCMV-tag2B-HBx质粒,然后进行对比研究,以期探讨GST-MIG,GST-IP-10融合蛋白原核载体的构建与表达的关系.1.1 研究对象周龄为6~8周的小鼠24只,平均为(7.3±0.6)周,其中雌雄各12只,购自四川省实验动物繁育中心.1.2 材料pCMV-tag2B空载质粒与pCMV-tag2B-HBx质粒均通过B型超纯大量质粒提取试剂盒进行提取(北京博大泰克科技有限公司);限制性内切酶和DNA连接酶(Fermentas公司);DNA Maker,Taq MasterMix,Pfu MasterMix(北京天根生化科技有限公司);胎牛血清、RIPA裂解液、蛋白浓度测定试剂盒(江苏碧云天生物技术研究所);GST蛋白纯化试剂盒(Thermo公司);IFN-γElisa试剂盒(BD公司);蒸馏水(娃哈哈纯净水,杭州);琼脂糖(Biowest公司).1.3 仪器超净工作台(上海博迅实业有限公司医疗设备厂);高速电动匀浆器(江苏金坛市仪美仪器公司);凝胶图像分析仪(上海培清科技有限公司);电泳仪(北京留意仪器厂);细胞培养箱(美国Hepa Fliter公司);PCR仪、高速台式低温离心机、紫外分光光度计(德国Eppendorf公司);酶标仪(澳大利亚Tecan公司);电热恒温水槽(上海精宏实验设备公司).1.4 方法对照组高压水动力尾静脉注射pCMV-tag2B空载质粒,观察组高压水动力尾静脉注射pCMV-tag2B-HBx质粒:称15 μg质粒溶于PBS中,给予小鼠尾部红外线加热,10 s内将液体快速推入小鼠的尾静脉,4 d后采用颈椎处理方法处死小鼠,行PCR检测,确认存在HBx基因即可.1.4.1 免疫组化法检测小鼠肝脏中MIG,IP-10表达取小鼠肝组织后用4%多聚甲醛进行固定,然后切片.在60 ℃下烤片过夜,再依次放入二甲苯110 mL、二甲苯210 mL、无水乙醇10 mL、95%乙醇10 mL、80%乙醇10 mL、75%乙醇10 mL、水5 mL,使用50 μL 3%H2O2滴片,室温下湿盒内放置15 min以灭活内源性酶.将800 mL柠檬酸修复液煮沸,并将片子置于其中,加热10 min后自然冷却到室温.将50 μL羊血清用于滴片,37 ℃下湿盒内放置30 min,然后孵育一抗.使用羊抗鼠IP-10抗体单抗和兔抗鼠MIG抗体单抗(11 000稀释),用量50 μL,在4 ℃下湿盒内放置过夜,使用PBS冲洗3次,5 min/次,然后孵育二抗.使用驴抗兔和兔抗羊二抗(11 000稀释),用量50 μL,在37 ℃下放置湿盒内60 min,使用PBS冲洗3次,5 min/次.双蒸水1 mL与蛋白浓度测定试剂盒中A液、B液、C液各1滴进行混合,用量50 μL,显微镜下观察直到显色.冲洗10 min,使用苏木素染色,着色后冲洗5 min,然后进行脱水,一次放入75%乙醇5 mL、80%乙醇5 mL、95%乙醇5 mL、无水乙醇10 mL、二甲苯210 mL、二甲苯110 mL,风干后可封片.1.4.2 Elisa法检测IFN-γ表达肝组织0.05 g放置于1 mL RIPA裂解液中,提前加入PMSF,控制其浓度为1 mmol,然后匀浆,冰浴30 min,蛋白裂解后在4 ℃下离心10 min,设定转速为12 000 r/min.取上清液,然后固定酶标条,每个孔内加入Elisa Diluent 50 μL,然后加入稀释好的标准液和检测样本,震荡混匀后可封板,在室温下孵育2 h.准备好Working Detector,向孔内加入洗涤液300 μL,甩干清洗5次,最后用吸水纸吸干,加入配好的Working Detector 100 μL,封板后在室温下孵育1 h,然后洗板7次,控制间隔时间在1 min.加入TMB-One-Step Substrate Reagent 100 μL,在室温下避光孵育30 min,然后加入Stop Solution 50 μL,在30 min 的终止时间内进行酶标仪吸光度数值读取,设定波长为450 nm.1.4.3 在不同时间点下PAGE和Western blot法鉴定蛋白表达接种重组菌4 mL到4 mL含有100 μg/mL那霉素的LB培养液内,37 ℃下250 r/min震荡过夜.取50 μL过夜液接种到5 mL含有100 μg/mL卡那霉素的LB培养液内,37 ℃下250 r/min震荡3.5 h.取1 mL未诱导的培养液额外操作,剩余培养液加IPTG,控制质量浓度到1 mmol/L,37 ℃下250 r/min震荡,选择不同时间点(3,4,5,10 h)取1 mL样品,12 000 r/min离心1 min,将沉淀悬浮于80 μL PBS液中,加缓冲液20 μL,沸浴10 min,12 000 r/min离心1 min,放冰上降温,到室温后加入15 μL 15%SDS-PAGE,在100 V下进行电泳,直到溴酚蓝迁移到分离胶质底部,行考马斯亮蓝染色,观察条带.1.4.4 GST柱纯化表达蛋白将GST柱放置室温平衡,使用10 mL PBS平衡凝胶,控制流速1 mL/min.使用0.45 μm滤膜进行过滤,然后上样,同时控制流速1 mL/min,收集流出物后检测A280值.使用10 mL PBS冲洗凝胶3次,控制流速1 mL/min,检测流出物的A280值,直到A280值到0为止.加入2 mL洗脱液,在25 ℃下孵育10 min,收集流出物,重复洗脱蛋白3次.使用2 mL再生液1冲洗凝胶,控制流速1mL/min,再使用2 mL再生液2冲洗凝胶,控制流速1 mL/min,重复冲洗3次,使用5 mL PBS平衡凝胶,纯化后使用Western blot检测GST-MIG,GST-IP-10融合蛋白.2.1 免疫组化法检测小鼠肝脏中MIG,IP-10表达免疫组化法检测小鼠肝脏中MIG,IP-10表达结果分析显示(见图1~4):40倍镜下观察对照组小鼠肝脏中MIG抗体、IP-10抗体未见棕黄色染色,无MIG,IP-10表达,观察组小鼠肝脏中MIG抗体、IP-10抗体呈棕黄色阳性染色,有MIG,IP-10表达.2.2 Elisa法检测小鼠肝脏中IFN-γ表达Elisa法检测小鼠肝脏中IFN-γ表达结果中,观察组小鼠肝脏中IFN-γ表达升高21.4%,对照组小鼠肝脏中IFN-γ表达降低了54.1%,与小鼠肝脏中MIG,IP-10表达一致.2.3 pET42a-MIG,pET42a-IP-10载体构建和表达2.3.1 MIG,IP-10基因扩增结果MIG,IP-10基因扩增结果分析显示(见图5~6):MIG基因条带为330 bp,IP-10基因条带为246 bp,经重组质粒测序模版检测,与Blast进行对比,测序结果与目的基因一致,表明MIG,IP-10表达载体可成功构建.2.3.2 pET42a-MIG,pET42a-IP-10表达结果2.3.2.1 GST-MIG,GST-IP-10融合蛋白在不同时间点诱导表达结果GST-MIG,GST-IP-10融合蛋白在不同时间点诱导表达结果分析显示(见图7~8):未诱导组无蛋白表达,pET42a空载IPTG诱导仅有GST表达(26 kD),pET42a-mMIG,pET42a-mIP-10重组质粒IPTG诱导有mMIG表达(38 kD)、mIP-10表达(35 kD).2.3.2.2 GST-MIG,GST-IP-10融合蛋白在不同诱导条件下表达结果GST-MIG,GST-IP-10融合蛋白在不同诱导条件下表达结果分析显示(见图9~10):25 ℃下,IPTG浓度为0.2 mmol/L,转速为150 r/min,GST-MIG,GST-IP-10融合蛋白含量最高.上清经15%SDS-PAGE检测可提高目的蛋白纯度.2.3.2.3 GST-MIG,GST-IP-10融合蛋白鉴定结果GST-MIG,GST-IP-10融合蛋白鉴定结果分析显示(见图11):采用Western blot 检测融合蛋白,经GST柱纯化后可见条带.高压水动力尾静脉注射pCMV-tag2B-HBx质粒是目前用于检测基因变化的有效方法之一[7],通过开展有效基因微阵列分析可以得到不同功能的基因,可为相关疾病的诊断和治疗提供有效的科学依据[8].HBx转基因能够引发体内趋化因子的改变,在机体内的各种炎症反应过程中起着重要作用,通过荧光定量PCR检测可以掌握机体内的趋化因子变化程度和相应基因的表达水平改变情况[9].HBx基因可直接诱导肝细胞MIG,IP-10基因表达的异常升高,而这两个基因在白细胞迁移与肝病发展过程中均起着重要作用.机体内通过大量分泌IFN-γ可有效刺激肝细胞与肝非实质性细胞加速分泌MIG,IP-10基因,同时机体内IFN-γ还可阻断趋化因子减少单核淋巴细胞聚集到肝脏,同时对CTLs 的抗病毒能力也不会造成影响[10].因而可将MIG,IP-10作为此次研究的靶点,进而构建MIG,IP-10的原核表达载体.本次研究中,对照组小鼠肝脏中MIG抗体、IP-10抗体未见棕黄色染色,无MIG,IP-10表达,观察组小鼠肝脏中MIG抗体、IP-10抗体呈棕黄色阳性染色,有MIG,IP-10表达,说明MIG,IP-10蛋白表达与基因保持了良好的一致性.观察组小鼠肝脏中IFN-γ表达升高21.4%,对照组小鼠肝脏中IFN-γ表达降低了54.1%,与小鼠肝脏中MIG,IP-10表达保持了高度的一致性.其中观察组IFN-γ表达明显升高,表明小鼠肝组织在HBx的诱导下可引起MIG,IP-10表达明显升高.MIG基因条带为330 bp,IP-10基因条带为246 bp,经重组质粒测序模版检测,与Blast进行对比,测序结果与目的基因一致.未诱导组无蛋白表达,pET42a空载IPTG诱导仅有GST表达(26 kD),pET42a-mMIG,pET42a-mIP-10重组质粒IPTG诱导有mMIG表达(38 kD)、mIP-10表达(35 kD),说明扩增基因在测序检验后证实确已克隆到pET42a,表明原核的载体构建非常成功.25 ℃下,IPTG 浓度为0.2 mmol/L,转速为150 r/min,GST-MIG,GST-IP-10融合蛋白含量最高,上清经15%SDS-PAGE检测可提高目的蛋白纯度.采用Western blot检测融合蛋白,经GST柱纯化后可见融合蛋白条带,说明原核的表达载体经转化IPTG 有效诱导后经GST柱可得到高纯度的融合蛋白,效果较好.综上所述,GST-MIG,GST-IP-10融合蛋白原核载体成功构建,具有高效表达特征,可为制备抗体提供良好条件.【相关文献】[1] 谭玉明,钟丽,陶晓杰,等.卒中后抑郁患者外周血单核细胞趋化因子受体1、锌指蛋白A20的表达及甲状腺功能的改变[J].中国新药杂志,2012,21(22):2654-2666.[2] 李定良,巫相宏.急性冠脉综合征患者趋化因子CXCL16与GRACE积分的相关性及临床意义[J].当代医学,2011,17(3):19-21.[3] 林青,王春平.调节活化正常T细胞表达与分泌趋化因子与子宫内膜异位症[J].中国实用妇科与产科杂志,2012,28(7):558-560.[4] 李敏,熊英,母得志,等.机械通气前后早产儿动脉血中IFN-γ和IP-10的变化[J].中国当代儿科杂志,2012,14(7):496-498.[5] 范梦柏,王秀娥,宋承平,等.细胞因子TN F-α、IFN-γ、IP-10对结核性胸腔积液诊断价值的研究[J].中国防痨杂志,2012,34(8):550-552.[6] 曹京燕,李呼伦,孙博,等.人缺血脑组织中IP-10和IFN-γ的表达[J].中国免疫学杂志,2006,22(5):422-425.[7] 王健,赵金红,江水清,等.丙型肝炎病毒慢性感染与IL-8、IP-10、Mig表达相关性研究[J].第三军医大学学报,2006,28(13):1420-1423.[8] 赵金红,王健,江水清,等.慢性乙型肝炎患者外周血单个核细胞中趋化因子IP-10和Mig表达及其与干扰素治疗的相互关系[J].中国实用内科杂志,2007,27(4):285-288.[9] 丁艳,贾德胜,王宝香,等.γ干扰素诱导单核因子和诱导蛋白10在婴儿巨细胞病毒肝炎相关性研究[J].中华实用儿科杂志,2008,23(7):523-525.[10] 王洪艳,龚守良,齐亚莉,等.骨髓间充质干细胞对放射性胸腺损伤的修复作用[J].北华大学学报:自然科学版,2011,12(3):300-303.。

gst纯化蛋白步骤GST纯化蛋白是一种常用的蛋白质纯化方法,它利用谷胱甘肽硫转移酶(Glutathione S-Transferase,GST)的亲和性,将GST标签蛋白与GST结合亲和树脂进行结合,然后通过洗脱,最终得到纯化的目标蛋白。
下面将为大家介绍GST纯化蛋白的详细步骤。
1.构建重组蛋白表达载体:首先需要在目标蛋白编码基因的N端或C端加上GST标签,通常选择GST-N和GST-C两种方式。
将GST标签与目标蛋白基因连接后,将其插入合适的表达载体中。
2.转化宿主细胞:将构建好的重组表达载体转化到适合的宿主细胞中,常用的宿主细胞有大肠杆菌和酿酒酵母等。
3.表达目标蛋白:宿主细胞在适宜的培养条件下进行培养,使其产生大量重组蛋白。
常见的培养条件包括温度、培养基的选择和添加诱导物等。
4.细胞破碎:培养得到丰富的重组蛋白的细胞后,通过机械或化学方法将细胞破碎。
常用的方法有超声波破碎、高压均质破碎、冻融法和溶菌酶法等。
5.蛋白纯化:将细胞破碎液进行离心分离,去除残余细胞碎片。
接下来,将蛋白样品加入含有GST结合亲和树脂的柱子中,通过亲和吸附,在树脂上富集GST标签蛋白。
6.洗脱纯化蛋白:使用合适的洗脱缓冲液,可以脱离与亲和树脂结合的非特异性结合蛋白,并洗脱纯化的目标蛋白。
一般使用还原性缓冲液,可将目标蛋白从GST结合亲和树脂上彻底洗脱。
7.蛋白质浓缩:通过合适的方法,如超滤、溶液浓缩装置等,使纯化的目标蛋白浓缩到较高浓度。
8.纯化蛋白的分析:对纯化的目标蛋白进行SDS-PAGE凝胶电泳分析,检测其纯度和分子量等指标。
通过上述步骤,可以得到较高纯度的GST标签蛋白。
需要注意的是,在步骤的选择和操作过程中,要根据目标蛋白的特性和所需纯度等要求进行调整,以获得更好的纯化效果。
希望本文对您进行GST纯化蛋白的实验有所帮助。

gst蛋白纯化原理GST蛋白纯化是一种常用的蛋白质纯化技术,其原理是利用谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)标签与谷胱甘肽的特异性结合来进行纯化。
GST标签可与谷胱甘肽通过二硫键共价亲和,然后通过GSH交换洗脱的原理进行蛋白纯化。
具体步骤如下:1.构建GST标签融合表达载体:将GST基因的编码序列与目标蛋白的编码序列融合,构建GST-目标蛋白融合表达载体。
这样,在细胞中表达该融合蛋白时,GST标签会紧密结合在目标蛋白的C端或N 端。
2.转染和蛋白表达:将构建好的GST-目标蛋白融合表达载体转染到合适的宿主细胞(如大肠杆菌),使其产生大量的融合蛋白。
3.细胞裂解和融合蛋白的亲和层析:收获融合蛋白的细胞,通过细胞裂解等方法破坏细胞膜,释放融合蛋白。
然后,将溶解的细胞提取物加载到含有谷胱甘肽固定在琼脂糖(或其他载体)上的亲和层析柱中。
GST标签可以特异性地与琼脂糖上的谷胱甘肽结合。
4.洗脱:通过洗脱缓冲液来去除非特异性结合的蛋白质,保留GST-目标蛋白复合物。
洗脱通常使用还原剂(如谷胱甘肽)、低pH 或其他方式进行。
5.目标蛋白的解离:将GST标签从目标蛋白上解离,得到纯化的目标蛋白。
这可以通过特定的酶切位点(如蛋白酶TEV切割位点)和相应的酶进行酶切,使GST和目标蛋白分别释放。
6.纯化分析:对纯化的目标蛋白进行分析,如SDS-PAGE凝胶电泳、Western blot等方法,确认目标蛋白的纯度和完整性。
在进行GST蛋白纯化时,对于融合表达载体的设计和构建、宿主细胞的选择、裂解条件和亲和层析条件的优化等方面都需要合理考虑,以获得高质量的纯化目标蛋白。
GST-Glypican 3 N端融合蛋白表达载体构建及表达纯化肖明兵;赵敏星;倪润洲;江枫;周嘉伟【摘要】目的构建人磷酯酰肌醇蛋白聚糖3(Glypican3,GPC3)N端蛋白与谷胱甘肽-S-转移酶(GST)重组的融合蛋白原核表达载体并进行表达及纯化.方法以重组质粒pcDNA3.1-GPC3N为模板,扩增GPC3 N端基因,产物经纯化回收后与载体PGEX-4T-1连接并转化大肠埃希菌Rosetta,酶切鉴定序列完全正确者诱导表达GST-GPC3 N端融合蛋白,并以谷胱甘肽琼脂糖小珠亲和纯化.结果 Glypican 3 N 端基因片段成功插入载体PGEX-4T-1,插入位点及碱基序列完全正确,转化Rosetta 后,经IPGT诱导成功表达分子质量为64 000的GST-GPC3 N端融合蛋白.结论成功建立了重组GST-GPC3 N端融合蛋白的原核表达载体、表达菌株及诱导表达和纯化的方法,为GPC3 N端融合蛋白的进一步应用打下基础.【期刊名称】《临床检验杂志》【年(卷),期】2010(028)003【总页数】3页(P212-214)【关键词】磷酯酰肌醇蛋白聚糖3;载体;克隆;表达【作者】肖明兵;赵敏星;倪润洲;江枫;周嘉伟【作者单位】南通大学附属医院消化病研究室,江苏南通226001;南通大学附属医院消化病研究室,江苏南通226001;南通大学附属医院消化病研究室,江苏南通226001;南通大学附属医院消化病研究室,江苏南通226001;中国科学院上海神经科学研究所,上海200030【正文语种】中文【中图分类】Q78Glypican 3(磷酯酰肌醇蛋白聚糖3,GPC3) 可参与细胞增殖、分化、黏附等, 其异常表达与一些肿瘤关系密切[1-3]。
国内外已相继有表达GPC3 C末端融合蛋白的相关报道,但GPC3 N端融合蛋白的表达国内尚未见报道。
本实验室曾成功构建人GPC3 N端融合基因pcDNA3.1重组载体[4]。
人β肌动蛋白基因原核表达载体的构建及其表达和纯化宋烨琼;郭靖;徐小洁;李玲;梁迎春;洪甜;纪贝贝;叶棋浓;吕朝晖【期刊名称】《生物技术通讯》【年(卷),期】2015(026)006【摘要】目的:构建带GST标签的人β肌动蛋白(β-actin)基因的原核表达产物,纯化出GST-β-actin融合蛋白,为探究β-actin的各项生理功能做准备.方法:以人乳腺文库为模板,利用PCR技术扩增β-actin基因,将其连接到带有GST标签的载体上,经鉴定正确的重组质粒转化大肠杆菌Rossate感受态细胞,小量诱导表达后,利用GST-Sepharose 4B亲和珠纯化GST-β-actin融合蛋白,经SDS-PAGE和Western印迹检测.结果:目的基因经PCR技术得以扩增,将其与带GST标签的载体连接后再经双酶切鉴定及测序后确认构建成功;转化大肠杆菌Rossate感受态后获得小量诱导表达,纯化出GST-β-actin融合蛋白,并证实其有生物活性.结论:构建了人β-actin的原核表达载体,并获得了GST-β-actin融合蛋白.【总页数】3页(P783-785)【作者】宋烨琼;郭靖;徐小洁;李玲;梁迎春;洪甜;纪贝贝;叶棋浓;吕朝晖【作者单位】解放军总医院内分泌科,北京100853;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;军事医学科学院生物工程研究所,北京100850;解放军总医院内分泌科,北京100853【正文语种】中文【中图分类】Q78【相关文献】1.人NDRG2两亚型基因原核表达载体的构建及表达与纯化 [J], 牛锋;邓艳春;秦娜;刘新平2.人NPTX2基因原核表达载体构建及重组蛋白的表达纯化 [J], 张玲;高军;李兆申;杜奕奇;龚燕芳;黄文;金晶;吴洪玉;满晓华3.人IL-24基因原核表达载体的构建及蛋白的表达纯化 [J], 喻放;杨忠华;范汉东;左振宇4.人源DCF1基因原核表达载体构建及蛋白分离纯化 [J], 王倩;杨眉;冯瑞丽;王娇;文铁桥5.APEC毒力基因ygeG的原核表达载体构建、表达纯化及鉴定 [J], 姜楠;郑倩倩;李倩文;涂健;宋祥军;邵颖;刘红梅;祁克宗因版权原因,仅展示原文概要,查看原文内容请购买。
GST-LMO1融合蛋白表达载体的构建及其在原核细胞中的表达顾卉;佟宇鑫;刘彤;李慧;李丹妮;袁正伟【摘要】目的构建GST-LMO1融合蛋白表达载体,并在原核细胞大肠埃希菌(E.coli)中诱导表达.方法以人胎脑文库为模板,用PCR方法法扩增出LMO1基因全长及各个截短突变体,通过BamH Ⅰ和EcoR Ⅰ酶切位点分别将其定向插入pGEX-5X-2载体中,构建原核表达质粒pGEX-5X-2-LMO1及其截短突变体,通过酶切电泳鉴定和DNA序列测定正确后,转入E.coli BL21中,经异丙基硫代β-D半乳糖苷诱导表达,SDS-PAGE和Western blot鉴定.结果酶切电泳及测序结果证明,成功构建了原核表达质粒pGEX-5X-2-LMO1及其截短突变体,并用Western blot方法证实了GST-LMO1全长及各个截短突变体融合蛋白的表达.结论成功构建了LMO1全长及其截短突变体原核表达载体,并证实了其在原核细胞大肠埃希菌中的表达,为LMO1结构与功能的研究提供了前提基础.%Objective To construct GST-LMO1 fusion protein expression vector and induce its expression in Escherichia coli(E.coli). Methods The coding sequence of LMOl and its deletion fragments were amplified from the human fetal brain as the template by PCR and inserted into pGEX-5X-2 by BamH I and EcoR I . The positive recombinants were identified by restriction endonuclease digestion and DNA sequencing. Then they were transformed into E.coli BL21, induced by IPTG and identified by SDS -PAGE and Western blot. Results The prokaryotic expression plasmid pGEX-5X-2-LM01 and its deletion mutants were successfully constructed and confirmed by enzyme digestion and sequencing. The GST-LM01 fusion proteins were expressedand confirmed by Western blot. Conclusion The prokaryotic expression plasmid of LMOl and its deletion mutants were successfully constructed and the expression of fusion proteins in Escherichia coli was con-finned. This study provides the basis for the further research on the structure and function of LMOl.【期刊名称】《中国医科大学学报》【年(卷),期】2011(040)011【总页数】4页(P961-963,978)【关键词】LMO1;截短突变体;质粒;原核表达【作者】顾卉;佟宇鑫;刘彤;李慧;李丹妮;袁正伟【作者单位】中国医科大学附属盛京医院实验研究中心,沈阳110001;中国医科大学基础医学院细胞生物教研室,细胞生物学教育部、卫生部重点实验室,沈阳110001;中国医科大学基础医学院细胞生物教研室,细胞生物学教育部、卫生部重点实验室,沈阳110001;中国医科大学附属盛京医院实验研究中心,沈阳110001;中国医科大学第94期临床医学系,沈阳110001;中国医科大学附属盛京医院实验研究中心,沈阳110001【正文语种】中文【中图分类】Q257LMO家族是只包含LIM结构域的一类蛋白,由两个串联的LIM结构域构成。