13沉淀溶解平衡与溶度积常数
- 格式:doc
- 大小:33.58 KB
- 文档页数:1


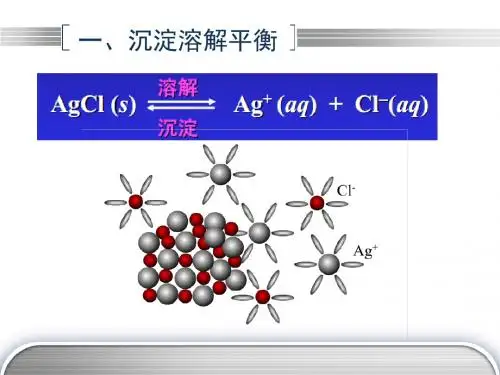
高考难点:溶度积常数及其应用一、沉淀溶解平衡中的常数(K sp)——溶度积1. 定义:在一定温度下,难溶电解质(S<0.01g)的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积)2. 表示方法:以M m A n(s) mM n+(aq) + nA m-(aq)为例(固体物质不列入平衡常数),K sp=[c(M n+)]m·[c(A m-)] n,如AgCl(s)Ag+(aq) + Cl-(aq),K sp=c(Ag+)·c(Cl-)。
3. 影响溶度积(K sp)的因素:K sp只与难容电解质的性质、温度有关,而与沉淀的量无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。
4. 意义:①K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp数值越大的难溶电解质在水中的溶解能力相对越强;②可以用K sp来计算饱和溶液中某种离子的浓度。
二、判断沉淀生成与否的原则——溶度积规则通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Q c)的相对大小,可以判断难溶电解质在给的条件下沉淀能否生成或溶解:1.Q c>K sp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡;2.Q c=K sp,溶液饱和,沉淀与溶解处于平衡状态;3.Q c<K sp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
三、对溶度积的理解1. 溶度积和溶解度都可以用来表示物质的溶解能力,只与温度有关,而与难溶电解质的质量无关。
2. 用溶度积直接比较不同物质的溶解性时,物质的类型应相同。
对于化学式中阴、阳离子个数比不同的难溶电解质,不能通过直接比较K sp的大小来确定其溶解能力的大小(要分析溶解时所需最小浓度决定)。
3. 溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。
4. 当表达式中的浓度是表示平衡时的浓度时,要用[]符号表示,且此时的溶液为饱和溶液。







13. 沉淀溶解平衡与溶度积常数
一、知识梳理
1、难溶电解质的沉淀溶解平衡的预备知识
①20℃时,溶解度与溶解性的关系
②难溶并非不溶,任何难溶物在水中均存在沉淀溶解平衡。
③沉淀溶解平衡常为吸热,但Ca(OH)2为放热,升温其溶解度减少。
④反应后离子浓度降至1×10—5以下的反应为完全反应。
⑤沉淀溶解平衡方程式的书写:注意在沉淀后用(s)、(aq)标明状态,并用“”。
如:Ag 2S(s)2Ag +(aq)+ S 2—(aq)
2、沉淀溶解平衡
(1)定义:一定温度下,沉淀溶解成离子的速率等于离子重新结合成沉淀的速率,形成饱和溶液,固体质量和溶液中各离子的浓度保持不变的状态。
(2)特征:逆、动、等、定、变
(3)影响沉淀溶解平衡的因素:
内因:难溶物质本身性质——主要决定因素
外因:①温度—升温,多数平衡向溶解方向移动 ②浓度—加水,平衡向溶解方向移动 ③同离子效应—向平衡体系中加入相同的离子使平衡向沉淀方向移动
④其他—向平衡体系中加入可与体系中某些离子反应生成更难溶物质或气体时,平衡正移
3、溶度积常数(Ksp )
(1)定义:在一定温度下,难溶电解质在溶液中达到沉淀溶解平衡时,离子浓度保持不变。
其离子浓度的化学计量数次方的乘积为一个常数,称之为溶度积常数,简称溶度积,用Ksp 表示。
(2)表达式:AmBn(s)mA n+(aq)+nB m —(aq) Ksp= [A n+]m •[B m —]n
注:①Ksp 值的大小只与难溶电解质本身的性质和温度有关,与浓度无关。
②Ksp 反映了难溶电解质在水中的溶解能力。
同类型的难溶电解质,在同温度下,Ksp 越大,溶解度越大
二、典例分析
例题1、在含有Mg(OH)2沉淀的饱和溶液中加入固体NH 4Cl 后,则Mg(OH)2沉淀( )
A .溶解
B .增多
C .不变
D .无法判断
考点:难溶电解质的溶解平衡及沉淀转化的本质.
分析:氢氧化镁电离出来的OH —与NH 4+结合生成弱电解质NH 3•H 2O ,从而促进Mg(OH)2
的溶解,据此分析解答.
解答:氢氧化镁溶液中存在溶解平衡Mg(OH)2(s)Mg 2+(aq)+2OH —(aq),Mg(OH)2电离出
来的OH —与NH 4+结合生成难电离的弱电解质NH 3•H 2O ,氢氧根离子浓度降低,从而使Mg(OH)2的溶解平衡向右移动,促进氢氧化镁溶解,故Mg(OH)2能溶于NH 4Cl 溶液中。
故选A .
点评:本题考查了难溶电解质的溶解平衡,从溶解平衡角度进行分析解答即可,难度不大.
三、实战演练
1、下列说法正确的是( )
A .难溶电解质的溶度积Ksp 越小,则它的溶解度越小
B .任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp 表示
C .溶度积常数Ksp 与温度有关,温度越高,溶度积越大
D .升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp 也变小 难溶 微溶 可溶 易溶 g/100g 水)。