钠镁铝铁及其化合物方程式和离子方程式锦集
- 格式:doc
- 大小:66.50 KB
- 文档页数:7

《化学必修1——金属及其化合物》化学方程式归纳一、钠及其化合物1. 钠在空气中表面变暗:4Na + O2 == 2Na2O2. 钠在氧气中燃烧:2Na + O2Na2O23. 钠与水反应:2Na + 2H2O == 2NaOH + H2↑4. 钠和盐酸反应:2Na + 2HCl == 2NaCl + H2↑5. 过氧化钠与水反应:2Na2O2 + 2H2O == 4NaOH + O2↑6. 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 == 2Na2CO3 + O27. NaHCO3受热分解:2NaHCO3Na2CO3 + H2O + CO2↑8. NaHCO3和盐酸:NaHCO3 + HCl === NaCl + H2O + CO2↑9. NaHCO3和NaOH:NaHCO3 + NaOH === Na2CO3 + H2O10. 向Na2CO3溶液中通入CO2:Na2CO3 + CO2 + H2O == 2NaHCO3二、铝及其化合物1. 铝和稀盐酸:2Al + 6HCl== 2AlCl3 + 3H2↑2. 铝和NaOH溶液:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑3. 氧化铝和稀盐酸:Al2O3 + 6HCl == 2AlCl3 + 3H2O4. 氧化铝和NaOH溶液:Al2O3 + 2NaOH == 2NaAlO2 + H2O5. 氢氧化铝和盐酸:Al(OH)3 + 3HCl== AlCl3 + 3H2O6. 氢氧化铝和NaOH溶液:Al(OH)3 + NaOH == NaAlO2 + 2H2O7. 氢氧化铝受热分解:2Al(OH)3Al2O3 + 3H2O8. 制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O == 2Al(OH)3↓+ 3(NH4)2SO4离子方程式:Al3+ + 3NH3·H2O == Al(OH)3↓+ 3NH4+三、铁及其化合物:1. 铁和水蒸气:3Fe + 4H2O(g) 高温Fe3O4 + 4H22. 氧化亚铁和盐酸反应:FeO + 2HCl == FeCl2 + H2O3. 氧化铁和盐酸反应:Fe2O3 + 6HCl == 2FeCl3 + 3H2O4. FeCl3和NaOH溶液反应:FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓(红褐色)5. FeSO4和NaOH溶液反应:FeSO4 + 2NaOH == Na2SO4 + Fe(OH)2↓(白色)6. 除去FeCl2中的FeCl3:Fe + 2FeCl3 == 3FeCl27. FeCl2和Cl2反应:2FeCl2 + Cl2 == 2FeCl38. Fe(OH)2在空气中被氧化:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3(现象:白色絮状沉淀,迅速变成灰绿色,最后变成红褐色)9. Fe(OH)3加热分解:2Fe(OH)3Fe2O3 + 3H2O10. FeCl3和Cu反应:2FeCl3 + Cu == 2FeCl2 + CuCl211. CO还原氧化铁:Fe2O3 + 3CO高温2Fe + 3CO212. Fe3+的检验:Fe3+ + 3SCN- == Fe(SCN)3 (现象:溶液变为血红色)。

金属+非金属化学方程式整理(全)-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN2金属化学方程式整理一、钠、镁、铝及其化合物1、 钠暴露在空气中4Na+O 2==2Na 2O ; 钠在空气中点燃:2Na+O 2 == Na 2O 22、 2Na+2H 2O==2NaOH +H 2↑3、 2Na+2HCl==2NaCl +H 2↑4、 钠投入硫酸铜溶液中:2Na+2H 2O==2NaOH +H 2 ↑ CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 总:2Na+2H 2O+CuSO 4== Cu(OH)2↓+Na 2SO 4 +H 2 ↑5、 Mg+2HCl==MgCl 2+H 2↑ ( Mg+2H +==Mg 2++H 2 ↑ ) 2Al+6HCl ==2AlCl 3+3H 2↑ ( 2Al+6H +==2Al 3++3H 2 ↑ )6、 2Al+2NaOH+2H 2O ==2NaAlO 2+3 H 2↑( 2Al+2OH -+2H 2O ==2AlO 2-+3 H 2↑ )7、 2Na 2O 2+2H 2O==4NaOH+O 2↑ ( 2Na 2O 2+2H 2O==4Na ++4OH -+O 2↑) 8、 2Na 2O 2+2CO 2==2Na 2CO 3+O 29、 Na 2O + 2HCl == 2NaCl + H 2O ( 说明Na 2O 是碱性氧化物 ) 10、2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ ( Na 2O 2不是碱性氧化物 ) 11、Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ ( CO 32- +2H + == H 2O + CO 2↑) 12、NaHCO 3 + HCl== NaCl + H 2O + CO 2↑ ( HCO 3- + H + == H 2O + CO 2↑) 13、2NaHCO 3= Na 2CO 3+H 2O+CO 2↑14、Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ( Al 2O 3 + 6H +== 2Al 3++ 3H 2O ) 15、Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O ( Al 2O 3 + 2OH - ==2AlO 2- + H 2O ) 16、AlCl 3 + 3NH 3·H 2O== Al(OH)3↓+ 3NH 4Cl (实验室制氢氧化铝)Al 3++3NH 3· H 2O== Al(OH)3↓+3NH 4+17、Al(OH)3+3HCl==AlCl 3+3H 2O ( Al(OH)3+3H +== Al 3++3H 2O ) 18、Al(OH)3+NaOH==NaAlO 2+2H 2O ( Al(OH)3+OH - ==AlO 2-+2H 2O )△△△319、2Al(OH)3 == Al 2O 3+3H 2O 20、少量CO 2通入NaOH 溶液:2NaOH+ CO 2== Na 2CO 3+ H 2O ( 2OH -+ CO 2==CO 32-+ H 2O ) 21、足量CO 2通入NaOH 溶液:NaOH+ CO 2== NaHCO 3 ( OH -+ CO 2==HCO 3- ) 22、少量NaOH 加入AlCl 3溶液:AlCl 3+3NaOH== Al(OH)3↓+3NaCl ( Al 3++3OH - ==Al(OH)3↓ ) 23、足量NaOH 加入AlCl 3溶液:AlCl 3+4NaOH== NaAlO 2+3NaCl+2 H 2O ( Al 3++4OH - == AlO 2-+2H 2O ) 24、Na 2CO 3 与NaHCO 3相互转化Na 2CO 3+ H 2O+ CO 2==2NaHCO 3 (CO 32-+ H 2O+ CO 2== 2HCO 3-) NaHCO 3+NaOH== Na 2CO 3+ H 2O (HCO 3-+ OH - == CO 32-+ H 2O )25、氯碱工业(电解饱和食盐水):2NaCl +2 H 2O==== 2NaOH +H 2↑+Cl 2↑ 26、侯氏(侯德榜)制(纯)碱法(饱和食盐水中先通氨气,再通二氧化碳) ①NaCl +NH 3+H 2O+ CO 2==NaHCO 3↓+NH 4Cl ②2NaHCO 3=== Na 2CO 3+H 2O+CO 2↑ 二、铁及其化合物1、Fe+2HCl==FeCl 2+H 2↑ ( Fe +2H +=Fe 2++H 2↑) Fe+CuSO 4==FeSO 4+Cu ( Fe +Cu 2+=Fe 2++Cu )2、FeO+2HCl=FeCl 2 +H 2O ( FeO +2H +=Fe 2++H 2O )3、Fe 2O 3+6HCl=2FeCl 3 +3H 2O ( Fe 2O 3+6H +=2Fe 3++3H 2O )4、Fe 3O 4+8HCl=FeCl 2 +2FeCl 3+4H 2O ( Fe 3O 4+8H += Fe 2++2Fe 3++4H 2O )5、Fe 2? + 2OH ? = Fe(OH)2?6、Fe 3? + 3OH ? = Fe(OH)3?电解△47、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 (现象:白色沉淀迅速变成灰绿色,最后变为红褐色)8、2Fe(OH)3 == Fe 2O 3+3H 2O9、Fe(OH)2+2HCl=FeCl 2 +2H 2O ( Fe(OH)2 +2H +=Fe 2++2H 2O ) 10、Fe(OH)3+3HCl=FeCl 3+3H 2O ( Fe(OH)3 +3H +=Fe 3++3H 2O )11、Fe 3? +3SCN ?=Fe(SCN)3 (现象:溶液呈红色。

课前作业4:1.镁在空气中燃烧2Mg + O 2 2MgO 3Mg +N 2 Mg 3N 2 2Mg + CO 2 2MgO + C 2.镁能溶解在氯化铵溶液中Mg + 2NH 4Cl = MgCl 2 + H 2↑+ NH 3↑ Mg + 2NH 4+ = Mg 2+ + H 2↑+ NH 3↑3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明: 4Al+3O 2=2Al 2O 3 在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
4.铝与盐酸反应、铝与氢氧化钠溶液反应2Al+6HCl = 2AlCl 3+3H 2↑ 2Al+6H + = 2Al 3++3H 2↑2Al+2NaOH+2H 2O = 2NaAlO 2+3H 2↑ 2Al+2OH -+2H 2O =2AlO 2-+3H 2↑ 5.铝在高温条件下与氧化铁(或FeO 、Fe 3O 4、Fe 2O 3、MnO 2、Cr 2O 3)反应2Al +Fe 2O 3 Al 2O 3 + 2Fe 6.氧化铝分别与盐酸、氢氧化钠溶液反应Al 2O 3+6HCl =2AlCl 3+3H 2O Al 2O 3+6H +=2Al 3++3H 2OAl 2O 3+2NaOH =2NaAlO 2+H 2O Al 2O 3+2OH -=2AlO 2-+H 2O (一般金属氧化物都不与碱反应,Al 2O 3特别,应引起注意)课前作业5:1.氢氧化铝分别与盐酸、氢氧化钠溶液反应Al(OH)3+3HCl=AlCl 3+3H 2O Al(OH)3+3H +=Al ++3H 2OAl(OH)3+NaOH=NaAlO 2+2H 2O Al(OH)3+OH -=AlO 2-+2H 2O2.氯化铝(硫酸铝)溶液中加入少量(或过量)的氢氧化钠溶液少量NaOH :AlCl 3+3NaOH =Al(OH)3↓+3NaCl Al 3++3OH - =Al(OH)3↓ 过量NaOH :AlCl 3+4NaOH =NaAlO 2+3NaCl Al 3++4OH - =AlO 2-+2H 2O 3.氯化铝(硫酸铝)溶液中加入少量(或过量)的氨水AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl Al 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+ 4.偏铝酸钠溶液中加入少量(或过量)的盐酸 (Al(OH)3制备方法之一) 少量盐酸:NaAlO 2+HCl+H 2O =Al(OH)3↓+NaCl AlO 2-+H ++H 2O =Al(OH)3↓ 过量盐酸:NaAlO 2+4HCl =AlCl 3+NaCl+2H 2O AlO 2-+4H +=Al 3++2H 2O 5.偏铝酸钠溶液中通入少量(或过量)的二氧化碳 (Al(OH)3制备方法之一) 少量CO 2:2NaAlO 2+CO 2+3H 2O =2Al(OH)3↓+Na 2CO 32AlO 2-+CO 2+3H 2O =2Al(OH)3↓+CO 32-过量CO 2:NaAlO 2+CO 2+2H 2O =Al(OH)3↓+NaHCO 3AlO 2-+CO 2+2H 2O =Al(OH)3↓+HCO 3-6.氯化铝溶液和偏铝酸钠溶液(Al 3+与HCO 3-、CO 32-、S 2-、HS -) (Al(OH)3制备方法之一) AlCl 3 + 3NaAlO 2 + 6H 2O = 4 Al(OH)3↓+3NaCl Al 3++ 3AlO 2-+ 6H 2O = 4Al(OH)3↓ 其他双水解的方程式和离子方程式自己做!7.偏铝酸钠溶液和碳酸氢钠溶液混合NaAlO 2+NaHCO 3+H 2O =Al(OH)3↓+Na 2CO 3 AlO 2-+HCO 3-+H 2O =Al(OH)3↓+CO 32-8.用简单的文字说明和离子方程式描述明矾可以净水的理由 明矾溶于水后电离出Al 3+发生水解生成吸附性很强的Al(OH)3胶体,吸附杂质达到净水目的:Al 3++3H 2O Al(OH)3胶体+3H + 点燃 点燃 点燃 高温。

钠及其化合物的方程式总结一、Na 单质1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na + O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O + O 2 2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二、Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O + 2HCl = 2NaCl + H 2O7、2Na 2O 2 +4HCl = 4NaCl + 2H 2O + O 2 ↑ 三、NaHCO 3与Na 2CO 31、小苏打受热分解: 2NaHCO 3Na 2CO 3 + H 2O +CO 2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOHNa 2CO 3 + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO 3+NaOH = Na 2CO 3+H 2O HCO 3-+OH - = H 2O +CO 32- 4、向NaOH 溶液中通入少量CO 2 :2NaOH + CO 2 = Na 2CO 3 + H 2O△△△△5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑7、Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O6、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O 2NaAlO2+3H2↑2Al+2OH-+2H2O 2AlO2-+3H2↑7、铝和浓硝酸共热:Al+6HNO3 Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu 2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4 Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2O Al2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al 2O 3 4Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应: 2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应: Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合: Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性: Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液: Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓ Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH2NaAlO 2+3Na 2SO 4+4H 2O Al 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)22Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 43Ba 2++6OH -+2Al 3++3SO 42-3BaSO 4 ↓+2Al(OH)3 ↓冰晶石电解8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O Al(OH)3+NaOH AlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl AlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O AlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓铁及其化合物的化学方程式和离子方程式一、Fe单质1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]4、高温条件铁与氧气(Fe过量)反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2 ↑ Fe+2H+Fe2++H2 ↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2 ↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓) Fe(NO3)3+3NO2 ↑+3H2O Fe+6H++3NO3-Fe3++3NO2 ↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑ +2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag Fe+2Ag+Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O2 2Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O FeO+2H+Fe2++H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2 ↑+2H2O FeO+4H++NO3-Fe3++NO2 ↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+Fe2++2Fe3++4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2 ↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2 ↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑ +5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O Fe3O4+8H+3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O Fe2O3+6H+2Fe3++3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O Fe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O Fe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2 ↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2 ↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑ +8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑ +8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe 2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl2ZnCl2+Fe Zn+Fe2+Zn2++Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3 ↓ 12Fe2++3O2+6H2O8Fe3++4Fe(OH)3 ↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O 4Fe2++O2+4H+4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl Fe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2 ↓+2NaCl Fe2++2OH-Fe(OH)2 ↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2 ↓+2Al(OH)3 ↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3 ↓+Fe(OH)2 ↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓Ag++Cl-AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl Fe2++S2-FeS↓13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O 2Fe2++H2O2+2H+2Fe3++2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3 ↓+8NaCl+O2 ↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O218、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe 3Zn+2Fe 3+3Zn 2++2Fe3、铁与氯化铁溶液反应:Fe +2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl Fe3++3OH-Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O Fe(OH)3↓+3NH4+9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl 2Fe 3++H 2S 2Fe 2++S ↓+2H +14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl 2Fe3++2I-2Fe2++I215、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl 2Fe3++S2-2Fe2++S ↓16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl 2Fe3++3S2-2FeS+S ↓17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl 2Fe3++2I-2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓ +Fe(NO3)3Ag++Cl-AgCl↓19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl Fe3++3SCN-Fe(SCN) 320、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3。

高中最全化学方程式及离子方程式集结一·钠及其化合物有关反应方程式(一)与金属钠有关的反应方程式1.钠与氧气在常温下反应:4Na+1O2===2Na2O.钠在氧气中燃烧:2Na+1O2点燃===1Na2O22.钠在氯气中燃烧:2Na+1Cl2点燃===2NaCl3.钠与硫粉研磨发生轻微爆炸:2Na+1S研磨===1Na2S4.钠与水反应:2Na+2H2O===2NaOH+1H2↑【2Na+2H2O===2Na++2OH-+1H2↑】5.钠与稀盐酸反应:2Na+2HCl===2NaCl+1H2↑【2Na+2H+===2Na++1H2↑】6.钠与CuSO4溶液反应: 2Na+1CuSO4+2H2O===1Na2SO4+1Cu(OH)2↓+1H2↑【2Na+1Cu2++2H2O===2Na++1Cu(OH)2↓+1H2↑】(二)与钠的氧化物有关的反应方程式1.Na2O2与水反应:2Na2O2+2H2O===4NaOH+1O2↑【2Na2O2+2H2O===4Na++4OH-+1O2↑】2.Na2O2与CO2反应:2Na2O2+2CO2===2Na2CO3+1O23.Na2O2与稀盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+1O2↑【2Na2O2+4H+===4Na++2H2O+1O2↑】4.Na2O与水反应:1Na2O+1H2O===2NaOH5.Na2O与CO2反应:1Na2O+1CO2===1Na2CO36.Na2O与SO2反应::1Na2O+1SO2===1Na2SO37.Na2O与稀盐酸反应:1Na2O+2HCl===2NaCl+1H2O【1Na2O+2H+===2Na++1H2O 】8.Na2O与氧气反应:2Na2O+1O2==V2Na2O29.Na2O2与SO2反应:1Na2O2+1O2==1Na2SO4二·铁及其化合物有关反应方程式(一)与金属铁有关的反应方程式1.铁在氯气中燃烧:2Fe+3Cl 2点燃===2FeCl 32.铁在氧气中燃烧:3Fe+2O 2点燃===1Fe 3O 43.铁与硫粉反应:1Fe+1S ∆===1FeS4.铁与水蒸气反应:3Fe+4H 2O(g)高温===1Fe 3O 4+4H 25.铁与稀硫酸反应:1Fe+1H 2SO 4===1FeSO 4+1H 2↑【1Fe+2H +===1Fe 2++1H 2↑】6.铁与CuSO 4溶液反应:1Fe+1CuSO 4===1FeSO 4+1Cu【1Fe+1Cu 2+===1Fe 2++1Cu 】7.少量铁与稀硝酸反应:1Fe+4HNO 3===1Fe(NO 3)3+1NO ↑+2H 2O【1Fe+4H ++13NO -===1Fe 3++1NO ↑+2H 2O 】 8.过量铁与稀硝酸反应:3Fe+8HNO 3===3Fe(NO 3)2+2NO ↑+4H 2O【3Fe+8H ++23NO -===3Fe 2++2NO ↑+4H 2O 】 (二)与铁的氧化物有关的反应方程式1.FeO 与稀盐酸反应:1FeO+2HCl===1FeCl 2+1H 2O【1FeO+2H +===1Fe 2++1H 2O 】2.Fe 2O 3与稀盐酸反应:1Fe 2O 3+6HCl===2FeCl 3+3H 2O【1Fe 2O 3+6H +===2Fe 3++3H 2O 】3.Fe 3O 4与稀盐酸反应:1Fe 3O 4+8HCl===1FeCl 2+2FeCl 3+4H 2O【1Fe 3O 4+8H +===1Fe 2++2Fe 3++4H 2O 】4.FeO 与稀硝酸反应:3FeO+10HNO 3===3Fe(NO 3)3+1NO ↑+5H 2O【3FeO+10H ++13NO -===3Fe 3++1NO ↑+5H 2O 】 5.Fe 3O 4与稀硝酸反应:【3Fe 3O 4+28H ++13NO -===9Fe 3++1NO ↑+14H 2O 】6.FeO 与酸性KMnO 4溶液反应:【5FeO+18H ++14MnO -===5Fe 3++1Mn 2++9H 2O 】 7.Fe 3O 4与酸性KMnO 4溶液反应:【5Fe 3O 4+48H ++14MnO -===15Fe 3++1Mn 2++24H 2O 】 (三)与铁的氢氧化物有关的反应方程式1.Fe(OH)3与稀盐酸反应:1Fe(OH)3+3HCl===1FeCl 3+3H 2O【1Fe(OH)3+3H +===1Fe 3++3H 2O 】2.Fe(OH)2与稀盐酸反应:1Fe(OH)2+2HCl===1FeCl 2+2H 2O【1Fe(OH)2+2H +===1Fe 2++2H 2O 】3.Fe(OH)2与稀硝酸反应:3Fe(OH)2+10HNO 3===3Fe(NO 3)3+1NO ↑+8H 2O【3Fe(OH)2+10H ++13NO -===3Fe 3++1NO ↑+8H 2O 】 4.Fe(OH)2在空气中久置:4Fe(OH)2+1O 2+2H 2O===4Fe(OH)35.Fe(OH)3受热分解:2Fe(OH)3∆===1Fe 2O 3+3H 2O(四)与亚铁盐或铁盐有关的反应方程式1.FeCl 2溶液与氯气反应:2FeCl 2+1Cl 2===2FeCl 3 【2Fe 2++1Cl 2===2Fe 3++2Cl -】2.FeCl 2溶液与稀硝酸反应:3FeCl 2+4HNO 3===3Fe(NO 3)3+1NO ↑+2H 2O【3Fe 2++4H ++13NO -===3Fe 3++1NO ↑+2H 2O 】 3.FeCl 2溶液与酸性KMnO 4溶液反应:【5Fe 2++8H ++14MnO -===5Fe 3++1Mn 2++4H 2O 】 4.FeCl 3溶液与铁粉反应:2FeCl 3+1Fe===3FeCl 2 【2Fe 3++1Fe===3Fe 2+】5.FeCl 3溶液与铜粉反应:2FeCl 3+1Cu===2FeCl 2+1CuCl 2【2Fe 3++1Cu===2Fe 2++1Cu 2+】6.FeCl 3溶液与H 2S 气体反应:1H 2S+2FeCl 3===2FeCl 2+1S ↓+2HCl【2Fe 3++1H 2S===1Fe 2++1S ↓+2H +】7.FeCl 3溶液与SO 2气体反应:1SO 2+2FeCl 3+2H 2O===1H 2SO 4+2FeCl 2+2HCl【2Fe 3++1SO 2+2H 2O===2Fe 2++4H ++12-4SO 】8.FeCl 3溶液与KSCN 溶液反应:1FeCl 3+3KSCN===1Fe(SCN)3+3KCl【1Fe 3++3SCN -===1Fe(SCN)3】9.将饱和FeCl 3溶液滴加到沸水中制取Fe(OH)3胶体:【1Fe 3++3H 2O ∆===1Fe(OH)3(胶体)+3H +】三·铝及其化合物有关反应方程式(一)与铝单质有关的反应方程式1.铝在氧气中燃烧:4Al+3O 2点燃===2Al 2O 32.铝在氯气中燃烧:2Al+3Cl 2点燃===2AlCl 33.铝与Fe 2O 3反应:2Al+1Fe 2O 3高温===1Al 2O 3+2Fe4.铝与稀硫酸反应:2Al+3H 2SO 4===1Al 2(SO 4)3+3H 2↑ 【2Al+6H +===2Al 3++3H 2↑】5.铝与NaOH 溶液反应:2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑【2Al+2OH -+2H 2O===22AlO -+3H 2↑】(二)与氧化铝有关的反应方程式1.Al 2O 3与稀硫酸反应:1Al 2O 3+3H 2SO 4===1Al 2(SO 4)3+3H 2O【1Al 2O 3+6H +===2Al 3++3H 2O 】2.Al 2O 3与NaOH 溶液反应:1Al 2O 3+2NaOH===2 NaAlO 2+1H 2O【1Al 2O 3+2OH -===22AlO -+1H 2O 】 3.Al 2O 3熔融电解制备金属铝:2Al 2O 3(熔融)====通电冰晶石 4Al+3O 2↑ (三)与氢氧化铝有关的反应方程式1.Al(OH)3与稀盐酸反应:1Al(OH)3+3HCl===1AlCl 3+3H 2O【1Al(OH)3+3H +===1Al 3++3H 2O 】2.Al(OH)3与NaOH 溶液反应:1Al(OH)3+1NaOH===1NaAlO 2+2H 2O【1Al(OH)3+1OH -===12AlO -+2H 2O 】3.Al(OH)3受热分解:2Al(OH)3∆===1Al 2O 3+3H 2O(四)与铝盐有关的反应方程式1.AlCl 3与少量NaOH 溶液反应:1AlCl 3+3NaOH===1Al(OH)3↓+3NaCl【1Al 3++3OH -===1Al(OH)3↓】AlCl 3与过量NaOH 溶液反应:1AlCl 3+4NaOH=== 1NaAlO 2+3NaCl+2H 2O【1Al 3++4OH -===12AlO -+2H 2O 】 2.AlCl 3与过量的氨水反应:【1Al 3++3NH 3·H 2O===1Al(OH)3↓+34NH +】 3.AlCl 3与NaHCO 3溶液反应:【1Al 3++33HCO -===1Al(OH)3↓+3CO 2↑】 (五)与偏铝酸盐有关的反应方程式1. NaAlO 2溶液与少量稀盐酸反应:1NaAlO 2+1HCl+1H 2O===1Al(OH)3↓+1NaCl【12AlO -+1H ++1H 2O===1Al(OH)3↓】NaAlO 2溶液与过量稀盐酸反应:1NaAlO 2+4HCl=== 1AlCl 3+1NaCl+2H 2O【12AlO -+4H +===1Al 3++2H 2O 】2.NaAlO 2溶液与少量CO 2反应:2 NaAlO 2+1CO 2+3H 2O===2Al(OH)3↓+1Na 2CO 3【22AlO -+1CO 2+3H 2O===2Al(OH)3↓+123CO -】NaAlO 2溶液与过量CO 2反应:1NaAlO 2+1CO 2+2H 2O ===1Al(OH)3↓+1NaHCO 3【12AlO -+1CO 2+2H 2O ===1Al(OH)3↓+13HCO -】 3.NaAlO 2溶液与AlCl 3溶液反应:【32AlO -+1Al 3++6H 2O===4Al(OH)3↓】四·镁及其化合物有关反应方程式(一)与镁单质有关的反应方程式1.镁在氧气中燃烧:2Mg+1O 2点燃===2MgO2.镁在氯气中燃烧:1Mg+1Cl 2点燃===1MgCl 23.镁与沸水反应:1Mg+2H 2O ∆===1Mg(OH)2+1H 2↑4.镁在CO 2中燃烧:2Mg+1CO 2点燃===2MgO+1C5.镁与稀硫酸反应:1Mg+1H 2SO 4===1MgSO 4+1H 2↑【1Mg+2H +===1Mg 2++1H 2↑】.镁与浓硫酸反应:1Mg+2H 2SO 4(浓)===1MgSO 4+1SO 2↑+2H 2O【1Mg+4H ++124SO - ===1Mg 2++1SO 2↑+2H 2O 】 6. 镁与稀硝酸反应:3Mg+8HNO 3===3Mg(NO 3)2+2NO ↑+4H 2O【3Mg+8H ++23NO - ===3Mg 2++2NO ↑+4H 2O 】7.镁与CuSO 4溶液反应:【1Mg+1Cu 2+===1Mg 2++1Cu 】(二)与氧化镁有关的反应方程式1.MgO 与稀盐酸反应:1MgO+2HCl===1MgCl 2+1H 2O 【1MgO+2H +===1Mg 2++1H 2O 】(三)与氢氧化镁有关的反应方程式1.Mg(OH)2与稀盐酸反应:1Mg(OH)2+2HCl===1MgCl 2+2H 2O【1Mg(OH)2+2H +===1Mg 2++2H 2O 】2.Mg(OH)2受热分解:1Mg(OH)2∆===1MgO+1H 2O(四)与镁盐有关的反应方程式1.MgCl 2与NaOH 溶液反应:1MgCl 2+2NaOH===1Mg(OH)2↓+2NaCl【1Mg 2++2OH -===1Mg(OH)2↓】2.MgCl 2与氨水反应:1MgCl 2+2NH 3·H 2O===1Mg(OH)2↓+2NH 4Cl【1Mg 2++232NH H O g ===1Mg(OH)2↓+24NH +】 五·铜及其化合物有关反应方程式(一)与铜单质有关的反应方程式1.铜与氧气反应:2Cu+1O 2∆===2CuO2.铜在氯气中燃烧:1Cu+1Cl 2点燃===1CuCl 23.铜与硫粉共热反应:2Cu+1S∆===1Cu2S4.铜在潮湿空气中锈蚀变为铜绿:2Cu+1O2+1H2O+1CO2===1Cu2(OH)2CO35.铜与浓硫酸反应:1Cu+2H2SO4(浓)∆===1CuSO4+1SO2↑+2H2O6.铜与浓硝酸反应:1Cu+4HNO3(浓)===1Cu(NO3)2+2NO2↑+2H2O【1Cu+4H++2NO-===1Cu2++2NO2↑+2H2O】3铜与稀硝酸反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O【3Cu+8H++2NO-===3Cu2++2NO↑+4H2O】37.铜与AgNO3溶液反应:1Cu+2AgNO3===1Cu(NO3)2+2Ag【1Cu+2Ag+===1Cu2++2Ag】8.铜与FeCl3溶液反应:1Cu+2FeCl3===2FeCl2+1CuCl2【1Cu+2Fe3+===2Fe2++1Cu2+】(二)与氧化铜有关的反应方程式1.CuO与氢气共热反应:1CuO+1H2∆===1Cu+1H2O2.CuO与铝粉共热反应:3CuO+2Al∆===3Cu+1Al2O33.CuO与CO共热反应:1CuO+1CO∆===1Cu+1CO24.CuO与稀硫酸反应:1CuO+1H2SO4===1CuSO4+1H2O(三)与氢氧化铜有关的反应方程式1.Cu(OH)2与稀硫酸反应:1Cu(OH)2+1H2SO4===1CuSO4+2H2O2.Cu(OH)2受热分解:1Cu(OH)2∆===1CuO+1H2O(四)与铜盐有关的反应方程式1.CuCl2与NaOH溶液反应:1CuCl2+2NaOH===1Cu(OH)2↓+2NaCl【1Cu2++2OH-===1Cu(OH)2↓】2.CuSO4溶液与H2S气体反应:1CuSO4+1H2S===1CuS↓+1H2SO4【1Cu2++1H2S===1CuS↓+2H+】3.CuCl2溶液与铁粉反应:1CuCl2+1Fe===1Cu+1FeCl2 【1Cu2++1Fe===1Cu+1Fe2+】六·氯及其化合物有关反应方程式(一)与氯气有关的反应方程式1.铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl32.铜丝在氯气中燃烧:1Cu+1Cl2点燃===1CuCl23.氢气在氯气中燃烧:1H2+1Cl2点燃===2HCl4.红磷在少量氯气中燃烧:2P+3Cl2点燃===2PCl3.红磷在过量氯气中燃烧:2P+5Cl2点燃===2PCl55.氯气与水反应1Cl2+1H2O垐?噲?1HCl+1HClO 【1Cl2+1H2O垐?噲?1H++1Cl-+1HClO】6.氯水与SO2反应:1Cl2+1SO2+2H2O===1H2SO4+2HCl【1Cl2+1SO2+2H2O===4H++2Cl-+124SO-】7.氯气与NaOH溶液反应:1Cl2+2NaOH===1NaCl+1NaClO+1H2O【1Cl2+2OH-===1Cl-+1ClO-+1H2O】8.氯气与澄清石灰水反应:2Cl2+2Ca(OH)2===1CaCl2+1Ca(ClO)2+2H2O【1Cl2+2OH-===1Cl-+1ClO-+1H2O】9.氯气与KI溶液反应:1Cl2+2KI===2KCl+1I2【1Cl2+2I-===2Cl-+1I2】10.氯气与NaBr溶液反应:1Cl2+2NaBr===2NaCl+1Br2【1Cl2+2Br-===2Cl-+1Br2】11.氯气与Na2S溶液反应:1Cl2+1Na2S===2NaCl+1S↓【1Cl2+1S2-===2Cl-+1S↓】12.氯气与FeCl2溶液反应:1Cl2+2FeCl2===2FeCl3 【1Cl2+2Fe2+===2Fe3++2Cl-】13.氯气与Na2SO3溶液反应:1Cl2+1Na2SO3+1H2O===1Na2SO4+2HCl【1Cl2+123SO-+1H2O===124SO-+2H++2Cl-】(二)与含氯化合物有关的反应方程式1.稀盐酸与AgNO3溶液反应:1HCl+1AgNO3===1AgCl↓+1HNO3【1Ag++1Cl-===1AgCl↓】2.稀盐酸与铁粉溶液反应:2HCl+1Fe===1FeCl 2+1H 2↑【2H ++1Fe===1Fe 2++1H 2↑】3.稀盐酸与NaHCO 3溶液反应:1HCl+1NaHCO 3===1NaCl+1H 2O+1CO 2↑【1H ++13HCO - ===1H 2O+1CO 2↑】4.Na 2CO 3与少量稀盐酸溶液反应:1Na 2CO 3+1HCl===1NaCl+1NaHCO 3【123CO - +1H +===13HCO -】.Na 2CO 3与过量稀盐酸溶液反应:1Na 2CO 3+2HCl===2NaCl+1H 2O+1CO 2↑【1CO 32-+2H +===1H 2O+1CO 2↑】5.稀盐酸与Ca(ClO)2溶液反应:2HCl+1Ca(ClO)2===1CaCl 2+2HClO【1H ++1ClO -===1HClO 】6.Ca(ClO)2溶液与少量CO 2反应:1Ca(ClO)2+1CO 2+1H 2O===1CaCO 3↓+2HClO【1Ca 2++2ClO -+1CO 2+1H 2O===1CaCO 3↓+2HClO 】 .Ca(ClO)2溶液与过量CO 2反应:1Ca(ClO)2+2CO 2+2H 2O===1Ca(HCO 3)2+2HClO【1ClO -+1CO 2+1H 2O===1HCO 3-+1HClO 】 七·溴及其化合物有关反应方程式(一)与溴单质有关的反应方程式1.溴与铁粉反应:3Br 2+2Fe===2FeBr 32.溴与NaOH 溶液反应:1Br 2+2NaOH===1NaBr+1NaBrO+1H 2O【1Br 2+2OH -===1Br -+1BrO -+1H 2O 】3.溴与氢硫酸反应:1Br 2+1H 2S===2HBr+1S ↓ 【1Br 2+1H 2S===2H ++2Br -+1S ↓】4.溴水与SO 2反应:1Br 2+1SO 2+2H 2O===1H 2SO 4+2HBr【1Br 2+1SO 2+2H 2O===2Br -+124SO - +4H +】5.溴与Na 2SO 3溶液反应:1Br 2+1Na 2SO 3+1H 2O===1Na 2SO 4+2HBr【1Br 2+123SO - +1H 2O===2Br -+124SO - +2H +】(二)与溴化物有关的反应方程式1.NaBr 溶液与氯气反应:2NaBr+1Cl 2===2NaCl+1Br 2 【2Br -+1Cl 2===2Cl -+1Br 2】2.NaBr 溶液与AgNO 3溶液反应:1NaBr+1AgNO 3===1AgBr ↓+1NaNO 3【1Br -+1Ag +===1AgBr ↓】八·碘及其化合物有关反应方程式(一)与碘单质有关的反应方程式1.碘与铁粉反应:1Fe+1I 2===V1FeI 22.碘与氢硫酸溶液反应:1I 2+1H 2S===2HI+1S ↓ 【1I 2+1H 2S===2H ++2I -+1S ↓】3.碘水与SO 2反应:1I 2+1SO 2+2H 2O===1H 2SO 4+2HI【1I 2+1SO 2+2H 2O===2I -+124SO - +4H +】 4.碘与亚硫酸钠溶液反应:1I 2+1Na 2SO 3+1H 2O===1Na 2SO 4+2HI【1I 2+123SO -+1H 2O===2I -+124SO -+2H +】(二)与碘化物有关的反应方程式1.NaI 溶液与氯气反应:2NaI+1Cl 2===2NaCl+1I 2 【2I -+1Cl 2===2Cl -+1I 2】2.NaI 溶液与溴水反应:1NaI+1Br 2===2NaBr+1I 2 【2I -+1Br 2===2Br -+1I 2】3.NaI 溶液与AgNO 3溶液反应:1NaI+1AgNO 3===1AgI ↓+1NaNO 3【1I -+1Ag +===1AgI ↓】九·碳及其化合物有关反应方程式(一)与碳单质有关的反应方程式1.碳在氧气中燃烧:2C+1O 2(少量)点燃===2CO1C+1O 2(足量)点燃===1CO 2 2.碳与CO 2在高温下反应:1C+1CO 2高温===2CO3.碳与水蒸气在高温下反应:1C+1H 2O 高温===1CO+1H 2 (水煤气)4.碳与SiO 2在高温下反应:2C+1SiO 2高温===1Si+2CO ↑5.碳与CuO 在高温下反应:1C+2CuO 高温===2Cu+1CO 2↑ 6.碳与Fe 2O 3在高温下反应:3C+2Fe 2O 3高温===4Fe+3CO 2↑7.碳与浓硫酸在加热时反应:1C+2H 2SO 4(浓)∆===1CO 2↑+2SO 2↑+2H 2O 8.碳与浓硝酸在加热时反应:1C+4HNO 3(浓)∆===1CO 2↑+4NO 2↑+2H 2O (二)与碳的氧化物有关的反应方程式 1.CO 在氧气中燃烧:2CO+1O 2点燃===2CO 22.CO 与Fe 2O 3在高温下反应:3CO+1Fe 2O 3高温===2Fe+3CO 2 3.CO 与CuO 在高温下反应:1CO+1CuO 高温===1Cu+1CO 2 4.CO 2与Na 2O 反应:1CO 2+1Na 2O===1Na 2CO 3 5.CO 2与Na 2O 2反应:2CO 2+2Na 2O 2===2Na 2CO 3+1O 26.CO 2与Na 2CO 3溶液反应:1Na 2CO 3+1CO 2+1H 2O===2NaHCO 3【123CO - +1CO 2+1H 2O===23HCO -】7.少量CO 2与澄清石灰水反应:1CO 2+1Ca(OH)2===1CaCO 3↓+1H 2O【1CO 2+1Ca 2++2OH -===1CaCO 3↓+1H 2O 】过量CO 2与澄清石灰水反应:2CO 2+1Ca(OH)2===1Ca(HCO 3)2【1CO 2+1OH -===13HCO -】8.少量CO 2与Na 2SiO 3溶液反应:1CO 2+1H 2O+1Na 2SiO 3===1H 2SiO 3↓+1Na 2CO 3【1CO 2+1H 2O+123SiO -===1H 2SiO 3↓+123CO -】过量CO 2与Na 2SiO 3溶液反应:2CO 2+2H 2O+1Na 2SiO 3===1H 2SiO 3↓+2NaHCO 3【2CO 2+2H 2O+123SiO -===1H 2SiO 3↓+23HCO - 】9.少量CO 2与NaAlO 2溶液反应:1CO 2+2NaAlO 2+3H 2O===2Al(OH)3↓+1Na 2CO 3【1CO 2+22AlO -+3H 2O===2Al(OH)3↓+123CO -】.过量CO 2与NaAlO 2溶液反应:1CO 2+1NaAlO 2+2H 2O ===1Al(OH)3↓+1NaHCO 3【1CO 2+12AlO -+2H 2O===1Al(OH)3↓+13HCO - 】(三)与碳酸盐有关的反应方程式 1.Na 2CO 3溶液与过量醋酸溶液反应:1Na 2CO 3+2CH 3COOH===2CH 3COONa+1H 2O+1CO 2↑【123CO -+2CH 3COOH===2CH 3COO -+1H 2O+1CO 2↑】2.CaCO 3与过量醋酸溶液反应:1CaCO 3+2CH 3COOH===1Ca(CH 3COO)2+1H 2O+1CO 2↑【1CaCO 3+2CH 3COOH===1Ca 2++2CH 3COO -+1H 2O+1CO 2↑】 3.Na 2CO 3溶液与澄清石灰水反应:1Na 2CO 3+1Ca(OH)2===1CaCO 3↓+2NaOH【123CO -+1Ca 2+===1CaCO 3↓】4.Na 2CO 3溶液与BaCl 2溶液反应:1Na 2CO 3+1BaCl 2===1BaCO 3↓+2NaCl【123CO -+1Ba 2+===1BaCO 3↓】5.Na 2CO 3溶液与过量SO 2反应:1Na 2CO 3+2SO 2+1H 2O===2NaHSO 3+1CO 2【123CO -+2SO 2+1H 2O===23HSO -+1CO 2】6.NaHCO 3溶液与醋酸溶液反应:1NaHCO 3+1CH 3COOH===1CH 3COONa+1H 2O+1CO 2↑【13HCO -+1CH 3COOH===1CH 3COO -+1H 2O+1CO 2↑】7.NaHCO 3溶液与NaOH 溶液反应:1NaHCO 3+1NaOH===1Na 2CO 3+1H 2O【13HCO -+1OH -===123CO -+1H 2O 】8.NaHCO 3溶液与少量澄清石灰水反应:2NaHCO 3+1Ca(OH)2===1CaCO 3↓+1Na 2CO 3+1H 2ONaHCO 3溶液与过量澄清石灰水反应:1NaHCO 3+1Ca(OH)2===1CaCO 3↓+1NaOH+1H 2O9.NaHCO 3加热分解:2NaHCO 3∆===1Na 2CO 3+1H 2O+1CO 2↑十·氮及其化合物有关反应方程式 (一)与N 2有关的反应方程式1.镁条在N 2中燃烧:1N 2+3Mg 点燃===1Mg 3N 22.工业上合成氨:1N 2+3H 2垐垐垐?噲垐垐?高温、高压催化剂2NH 3 3.N 2与O 2在放电时反应:1N 2+1O 2放电===2NO (二)与NO 有关的反应方程式 1.NO 与O 2反应:2NO+1O 2===2NO 22.NO 2与水反应:3NO 2+1H 2O===2HNO 3+1NO3.NO 2与NaOH 溶液反应:2NO 2+2NaOH===1NaNO 2+1NaNO 3+1H 2O【2NO 2+2OH -===12NO -+13NO -+1H 2O 】4.NO 、NO 2混合气体与NaOH 溶液反应:1NO+1NO 2+2NaOH===2NaNO 2+1H 2O 【1NO+1NO 2+2OH -===22NO -+1H 2O 】 (三)与NH 3有关的反应方程式1.NH 3与O 2催化氧化反应:4NH 3+5O 2====高温催化剂 4NO+6H 2O2.少量NH 3与氯气反应:2NH 3+3Cl 2===6HCl+1N 2 过量NH 3与氯气反应:8NH 3+3Cl 2===6NH 4Cl+1N 23.NH 3与水反应:1NH 3+1H 2O 垐?噲? 1NH 3·H 2O 垐?噲? 14NH + +1OH -4.NH 3与CuO 反应:2NH 3+ 3CuO ∆===3Cu+1N 2+3H 2O 5.NH 3与浓盐酸反应:1NH 3+1HCl===1NH 4Cl(白烟) 6.NH 3与浓硫酸反应:2NH 3+1H 2SO 4===1(NH 4)2SO 4 (四)与硝酸有关的反应方程式1.硝酸见光或受热分解:4HNO 3受热或见光======4NO 2↑+1O 2↑+2H 2O2.铜与浓硝酸反应:1Cu+4HNO 3(浓) ===V1Cu(NO 3)2+2NO 2↑+2H 2O【1Cu+4H ++23NO -==1Cu 2++2NO 2↑+2H 2O 】3.铜与稀硝酸反应:3Cu+8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O【3Cu+8H ++23NO -===3Cu 2++2NO ↑+4H 2O 】4.碳与浓硝酸反应:1C+4HNO 3(浓)∆===1CO 2↑+4NO 2↑+2H 2O 5.硫与浓硝酸反应:1S+6HNO 3(浓)∆===1H 2SO 4+6NO 2↑+2H 2O 6.FeO 与稀硝酸反应:3FeO+10HNO 3===3Fe(NO 3)3+1NO ↑+5H 2O【3FeO+13NO -+10H +===3Fe 3++1NO ↑+5H 2O 】7.SO 2与稀硝酸反应:3SO 2+2HNO 3+2H 2O===2NO ↑+3H 2SO 4【3SO 2+23NO -+2H 2O===2NO ↑+4H ++324SO - 】 8.Fe(OH)2与稀硝酸反应:3Fe(OH)2+10HNO 3===3Fe(NO 3)3+1NO ↑+8H 2O【3Fe(OH)2+10H ++13NO -===3Fe 3++1NO ↑+8H 2O 】9.FeCl 2与稀硝酸反应:3FeCl 2+4HNO 3===3Fe(NO 3)3+1NO ↑+2H 2O+2FeCl 3【3Fe 2++4H ++13NO -===3Fe 3++1NO ↑+2H 2O 】10.Na 2S 与稀硝酸反应:3Na 2S+8HNO 3===2NO ↑+3S ↓+4H 2O+6NaNO 3【3S 2-+8H ++23NO -===2NO ↑+3S ↓+4H 2O 】11.Na 2SO 3与稀硝酸反应:3Na 2SO 3+2HNO 3===3Na 2SO 4+2NO ↑+1H 2O【323SO - +2H ++23NO -===324SO -+2NO ↑+1H 2O 】(五)与铵盐有关的反应方程式1.NH 3HCO 3加热分解:1NH 4HCO 3∆===1NH 3↑+1H 2O+1CO 2↑ 2.NH 4Cl 加热分解:1NH 4Cl ∆===1NH 3↑+1HCl ↑3.NH 4Cl 固体与消石灰加热反应:2NH 4Cl+1Ca(OH)2∆===1CaCl 2+2NH 3↑+2H 2O 4.NH 4Cl溶液与NaOH 浓溶液反应:1NH 4Cl+1NaOH ∆===1NH 3↑+1NaCl+1H 2O【14NH ++1OH -∆===1NH 3↑+1H 2O 】5. NH 4HCO 3溶液与过量NaOH 溶液加热时反应:1NH 4HCO 3+2NaOH ∆===1NH 3↑+1Na 2CO 3+2H 2O【14NH ++13HCO - +2OH-∆===1NH 3↑+123CO -+2H 2O 】十一·硫及其化合物有关反应方程式 (一)与硫单质有关的反应方程式 1.硫粉与铁粉加热反应:1S+1Fe ∆===1FeS 2.硫粉与铜粉加热反应:1S+2Cu ∆===1Cu 2S 3.硫与氢气加热反应:1S+1H 2∆===1H 2S 4.硫在氧气中燃烧:1S+1O 2点燃===1SO 25.硫与浓硝酸加热反应:1S+6HNO 3(浓)∆===1H 2SO 4+6NO 2↑+2H 2O 6.硫与浓硫酸加热反应:1S+2H 2SO 4(浓)∆===3SO 2↑+2H 2O7.硫与NaOH 溶液加热反应:3S+6NaOH ∆===2Na 2S+1Na 2SO 3+3H 2O【3S+6OH-∆===2S 2-+123SO -+3H 2O 】(二)与SO 2有关的反应方程式1.SO 2与氧气反应:2SO 2+1O 2V垐垐?噲垐?催化剂2SO 3 2.SO 2与氯水反应:1SO 2+1Cl 2+2H 2O===1H 2SO 4+2HCl【1SO 2+1Cl 2+2H 2O===4H ++124SO -+2Cl -】3.SO 2与水反应:1SO 2+1H 2O 垐?噲? 1H 2SO 34.SO 2与CaO 反应:1SO 2+1CaO ∆===1CaSO 35.少量SO 2与澄清石灰水反应:1SO 2+1Ca(OH)2===1CaSO 3↓+1H 2O 过量SO 2与澄清石灰水反应:2SO 2+1Ca(OH)2===1Ca(HSO 3)2【1SO 2+1OH -===13HSO -】6.SO 2与稀硝酸反应:3SO 2+2HNO 3+2H 2O===2NO ↑+3H 2SO 4【3SO 2+23NO -+2H 2O===2NO ↑+4H ++324SO -】7.SO 2与FeCl 3溶液反应:1SO 2+2FeCl 3+2H 2O===1H 2SO 4+2FeCl 2+2HCl【1SO 2+2Fe 3++2H 2O===4H ++124SO -+2Fe 2+】8.SO 2与酸性KMnO 4溶液反应:5SO 2+2KMnO 4+2H 2O===1K 2SO 4+2MnSO 4+2H 2SO 4 【5SO 2+24MnO -+2H 2O===524SO -+2Mn 2++4H +】9.SO 2与H 2S 反应:1SO 2+2H 2S===3S ↓+2H 2O 10.SO 2与H 2O 2溶液反应:1SO 2+1H 2O 2===1H 2SO 4 (三)与硫化物有关的反应方程式1.H 2S 在氧气中燃烧:2H 2S+3O 2(过量)点燃===2SO 2+2H 2O2H 2S+1O 2(少量)点燃===1 S ↓+2H 2O2.H 2S 与氯气反应:1H 2S+1Cl 2===1S ↓+2HCl3.H 2S 与SO 2反应:1SO 2+2H 2S===3S ↓+2H 2O4.H 2S 与稀硝酸反应:3H 2S+2HNO 3(稀)===4H 2O+3S ↓+2NO ↑【3H 2S+13NO -+2H ++2H 2O===4H 2O+3S ↓+2NO ↑】5.H 2S 与FeCl 3溶液反应:1H 2S+2FeCl 3===2FeCl 2+1S ↓+2HCl【2Fe 3++1H 2S===1Fe 2++1S ↓+2H +】6.FeS 与稀硫酸反应:1FeS+1H 2SO 4===1H 2S ↑+1FeSO 4【1FeS+2H +===1H 2S ↑+1Fe 2+】7.FeS 与稀硝酸反应:1FeS+4HNO 3===1Fe(NO 3)3+1S ↓+1NO ↑+2H 2O 【1FeS+4H ++13NO -===1Fe 3++1S ↓+1NO ↑+2H 2O 】 (四)与浓硫酸有关的反应方程式1.氨气与浓硫酸反应:2NH 3+1H 2SO 4(浓)===1(NH 4)2SO 42.H 2S 与浓硫酸反应:1H 2S+1H 2SO 4(浓)===1S ↓+1SO 2↑+2H 2O3.HI 与浓硫酸反应:2HI+1H 2SO 4(浓)===1I 2+1SO 2↑+2H 2O4.铜与浓硫酸加热反应:1Cu+2H 2SO 4(浓)∆===1CuSO 4+1SO 2↑+2H 2O 5.铁与浓硫酸加热反应:2Fe+6H 2SO 4(浓)∆===1Fe 2(SO 4)3+3SO 2↑+6H 2O 6.锌与浓硫酸常温下反应:1Zn+2H 2SO 4(浓)===1ZnSO 4+1SO 2↑+2H 2O7.碳与浓硫酸加热反应:1C+2H2SO4∆===1CO2↑+2SO2↑+2H2O8.硫与浓硫酸加热反应:1S+2H2SO4∆===3SO2↑+2H2O9.Na2SO3粉末与浓硫酸反应:1Na2SO3+1H2SO4(浓)===1Na2SO4+1SO2↑+1H2O (五)与硫酸盐有关的反应方程式1.CuSO4溶液与Ba(OH)2溶液反应:1CuSO4+1Ba(OH)2===1Cu(OH)2↓+1BaSO4↓2.NaHSO4溶液与Ba(OH)2溶液混合呈中性:2H++12SO-+2OH-+1Ba2+===1BaSO4↓+2H2O4向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:1H++12SO-+1OH-+1Ba2+===1BaSO4↓+1H2O4十二·硅及其化合物有关反应方程式(一)与硅单质有关的反应方程式1.硅与氧气反应:1Si+1O2∆===1SiO22.硅与氯气反应:1Si+2Cl2==高温1SiCl43.硅与碳反应:1Si+1C==高温1SiC4.硅与氢氟酸反应:1Si+4HF===1SiF4↑+2H2↑5.硅与NaOH溶液反应:1Si+2NaOH+1H2O===1Na2SiO3+2H2↑【1Si+2OH-+1H2O===12SiO-+2H2↑】3(二)与SiO2有关的反应方程式1.SiO2与碳反应:1SiO2+2C==高温1Si+2CO↑2.SiO2与CaO反应:1SiO2+1CaO高温===1CaSiO33.SiO2与氢氟酸反应:1SiO2+4HF===1SiF4↑+2H2O4.SiO2与NaOH溶液反应:1SiO2+2NaOH===1Na2SiO3+1H2O【1SiO2+2OH-===12SiO-+1H2O】35.SiO2与Na2CO3高温反应:1SiO2+1Na2CO3高温===1Na2SiO3+1CO2↑6.SiO 2与CaCO 3高温反应:1SiO 2+1CaCO 3高温===1CaSiO 3+1CO 2↑ (三)与硅酸盐有关的反应方程式1.Na 2SiO 3溶液与少量CO 2反应:1Na 2SiO 3+1CO 2+1H 2O===1H 2SiO 3↓+1Na 2CO 3 【123SiO -+1CO 2+1H 2O===1H 2SiO 3↓+123CO -】2.Na 2SiO 3溶液与过量CO 2反应:1Na 2SiO 3+2CO 2+2H 2O===1H 2SiO 3↓+2NaHCO 3 【123SiO -+2CO 2+2H 2O===1H 2SiO 3↓+23HCO -】十三·陌生反应方程式配平1. 3Mn 2++24MnO - +2H 2O ===5MnO 2↓+4H +2. 24MnO -+5224C O -+16H +=2 Mn 2++10CO 2↑+8H 2O3. 14HNO 3+3Cu 2O==2NO↑+7H 2O +6Cu(NO 3)24. 224FeO -+8H 2O+3Zn====2Fe(OH)3+ 3Zn(OH)2+4OH- 5.9MnO 2+2FeS +10H 2SO 4====9MnSO 4+1Fe 2(SO 4)3+10H 2O6.2KClO 3+1H 2C 2O 4+2H 2SO 4∆===2ClO 2↑+2CO 2↑+2KHSO 4+2H 2O。
金属及其化合物重要化学方程式总结Na、Na2O、Na2O2钠与非金属反应4Na+O2====2Na2O 2Na+O2点燃Na2O2Cl2 +2Na点燃2NaCl 2Na+H2△2NaH2Na+S====Na2S(爆炸)钠与化合物反应2Na+2H2O====2NaOH+H2↑4Na+TiCl4(熔融)====4NaCl+Ti氧化钠和过氧化钠Na2O+H2O====2NaOH 2Na2O+O2△2Na2O2Na2O+CO2====Na2CO3Na2O+2HCl====2NaCl+H2O2Na2O2+2H2O====4NaOH+O2↑(此反应分两步Na2O2+2H2O====2NaOH+H2O2;2H2O2====2H2O+O2↑。
H2O2的制备可利用类似的反应)2Na2O2+2CO2====2Na2CO3+O2NaOH2NaOH+2Al+2H2O====2NaAlO2+3H2↑2NaOH(过量) +CO2====Na2CO3+H2ONaOH +CO2(过量)====NaHCO32NaOH +SiO2====Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)2NaOH+Al2O3====2NaAlO2+H2O2NaOH+Cl2====NaCl+NaClO+H2ONaOH+HCl====NaCl+H2ONaOH+H2S(足量)====NaHS+H2O2NaOH+H2S(少量)====Na2S+2H2O3NaOH+AlCl3====A l(O H)3↓+3NaClNaOH+Al(OH)3====NaAlO2+2H2ONaOH+NH4Cl△NaCl+NH3↑+H2O4NaOH + AlCl3====NaAlO2+ 3NaCl+2H2ONaAlO22NaAlO2+CO2+3H2O====2Al(OH)3↓+Na2CO33NaAlO2+AlCl3+6H2O====4Al(OH)3↓+3NaClNa2CO3、NaHCO3Na2CO3+SiO2高温Na2SiO3+CO2↑Na2CO3+HCl====NaHCO3+NaClNa2CO3 + CO2+ H2O====2NaHCO3NaHCO3+HCl====NaCl+H2O+CO2↑2NaHCO3△Na2CO3 + CO2↑+ H2OAl铝和非金属反应:4Al+3O2点燃2Al2O3(纯氧) 2Al+3S△Al2S3 2Al+3Cl2△2AlCl3铝热反应:2Al+Fe2O3高温Al2O3+2Fe铝和酸反应2Al + 6HCl====2AlCl 3 + 3H 2↑ 2Al+3H 2SO 4====Al 2(SO 4)3+3H 2↑ 2Al+6H 2SO 4(浓)△Al 2(SO 4)3+3SO 2↑+6H 2OAl+4HNO 3(稀)====Al(NO 3)3+NO↑+2H 2O (Al 、Fe 在冷、浓的硫酸、硝酸中钝化) 铝和强碱反应2Al+2NaOH+2H 2O====2NaAlO 2+3H 2↑Al 2O 3、Al(OH)3()232424232322Al O 3H SO Al SO 3H O A l O 2NaOH 2NaAlO H O +====+⎫⎬+====+⎭(Al 2O 3是两性氧化物) 2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3HCl====AlCl 3+3H 2O 2Al(OH)3+3H 2SO 4====Al 2(SO 4)3+6H 2O Al(OH)3+NaOH====NaAlO 2+2H 2O铝盐AlCl 3+3NaOH====A l (O H )3↓+3NaCl AlCl 3+3NH 3·H 2O====Al(OH)3↓+3NH 4Cl2AlCl 3+3Na 2CO 3+3H 2O====2Al(OH)3↓+3CO 2↑+6NaCl AlCl 3+3NaHCO 3====Al(OH)3↓+3CO 2↑+3NaCl AlCl 3+3NaAlO 2+6H 2O====4Al(OH)3↓+3NaCl AlCl 3+4NaOH====NaAlO 2 + 3NaCl +2H 2OAl 2(SO 4)3+3Na 2S+6H 2O====2Al(OH)3↓+3H 2S ↑+3 Na 2SO 4以下为铝及其化合物常见的离子方程式2Al + 6H +===2Al 3+ + 3H 2↑2Al + 2OH- + 2H2O====2AlO2- + 3H2↑Al3+ + 3OH-====Al(OH)3↓Al3+ + 4OH-====AlO2- + 2H2OAl3+ + 3NH3·H2O====Al(OH)3↓+ 3NH4+2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑ Al3+ + 3HCO3-==== Al(OH)3↓ + 3CO2↑Al3+ + 3HS- + 3H2O ====Al(OH)3↓ + 3H2S↑2Al3+ + 3S2- + 6H2O ====2Al(OH)3↓ + 3H2S↑Al3+ + 3AlO2- + 6H2O====4Al(OH)3↓AlO2- + H+ + H2O ====Al(OH)3↓AlO2- + 4H+ ====Al3+ + 2H2OAlO2- + CO2 + 2H2O====Al(OH)3↓+ HCO3-Al2O3 + 6H+====2Al3+ + 3H2OAl2O3 + 2OH-====2AlO2- + H2OAl(OH)3 + 3H+====Al3+ + 3H2OAl(OH)3 + OH-====AlO2- + 2H2O铁及其化合物2Fe+ 3Cl2点燃2FeCl33Fe+2O2点燃Fe3O4Fe+S △FeS 2Fe+3Br2====2FeBr3Fe+I2△FeI23Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl====FeCl2+H2↑ Fe+CuCl2====FeCl2+CuFe+SnCl4====FeCl2+SnCl2Fe + H2S====FeS+H2↑2Fe +6H2SO4(浓)====Fe2(SO4)3+3SO2↑+6H2OFe +H2SO4(稀)====FeSO4+H2↑Fe +6HNO3====Fe(NO3)3+3NO2↑+3H2OFe +4HNO3====Fe(NO3)3+NO↑+2H2O8Fe +30HNO3====8Fe(NO3)3+3N2O↑+15H2O10Fe +36HNO3====10Fe(NO3)3+3N2↑+18H2O8Fe +30HNO3====8Fe(NO3)3+3NH4NO3+9H2OFe(Al) +H2SO4(浓)室温下钝化Fe +(CH3COO)2Cu====Cu+(CH3COO)2FeFeO3FeO + 2Al高温Al2O3+3Fe 6FeO+O2△2Fe3O4FeO+4HNO3====Fe(NO3)3+NO2↑+2H2OFe2O3Fe2O3+2Al高温Al2O3+2Fe Fe2O3+3CO高温2Fe+3CO2Fe2O3+3H2△2Fe+3H2O (制还原铁粉) Fe2O3+6HCl====2FeCl3+3H2OFe3O4Fe3O4+4H2△3Fe+4H2O Fe3O4+8HCl(浓)△FeCl2+2FeCl3+4H2OFe(OH)2、Fe(OH)34Fe(OH)2 +O2+2H2O====4 Fe(OH)32Fe(OH)3△Fe2O3+3H2OFeCl22FeCl2 + Cl2====2FeCl3FeCl2+Mg====Fe+MgCl2FeCl32FeCl3+Fe====3FeCl22FeCl3+Cu====2FeCl2+CuCl2(用于雕刻铜线路板)2FeCl3+H2SO3+H2O====H2SO4+2FeCl2+2HCl2FeCl3+Zn====2FeCl2+ZnCl22FeCl3+H2S====2FeCl2+2HCl+S↓2FeCl3+2KI====2FeCl2+2KCl+I2FeCl3+3NH3·H2O====Fe(OH)3↓+3NH4Cl2FeCl3+3Na2CO3+3H2O====2Fe(OH)3↓+3CO2↑+6NaClFeCl3+3NaHCO3====Fe(OH)3↓+3CO2↑+3NaCl2FeCl3+ SO2+ 2H2O ==== 2FeCl2+ H2SO4+ 2HClFeCl3 + 3KSCN ====Fe(SCN)3+ 3KClFeSFeS + 2HCl====FeCl2 + H2S↑ FeS + H2SO4====FeSO4+ H2S↑其它Fe化合物4FeS2 + 11O2点燃2Fe2O3+ 8SO2Fe2(SO4)3+2Ag====2FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应。
化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
化学方程式及离子方程式总汇一·钠及其化合物有关反应方程式(一)与金属钠有关的反应方程式1.钠与氧气在常温下反应:4Na+O2===2Na2O钠在氧气中燃烧:2Na+O2点燃===Na2O22.钠在氯气中燃烧:2Na+Cl2点燃===2NaCl3.钠与硫粉研磨发生轻微爆炸:2Na+S研磨===Na2S4.钠与水反应:2Na+2H2O===2NaOH+H2↑【2Na+2H2O===2Na++2OH-+H2↑】5.钠与稀盐酸反应:2Na+2HCl===2NaCl+H2↑【2Na+2H+===2Na++H2↑】6.钠与CuSO4溶液反应:2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑【2Na+Cu2++2H2O===2Na++Cu(OH)2↓+H2↑】(二)与钠的氧化物有关的反应方程式1.Na2O2与水反应:2Na2O2+2H2O===4NaOH+O2↑【2Na2O2+2H2O===4Na++4OH-+O2↑】2.Na2O2与CO2反应:2Na2O2+2CO2===Na2CO3+O23.Na2O2与稀盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑【2Na2O2+4H+===4Na++2H2O+O2↑】4. Na2O2与SO2反应:Na2O2+SO2===Na2SO45.Na2O与水反应:Na2O+H2O===2NaOH6.Na2O与CO2反应:Na2O+CO2===Na2CO37.Na2O与SO2反应:Na2O+SO2===Na2SO38.Na2O与稀盐酸反应:Na2O+2HCl===2NaCl+H2O 【Na2O+2H+===2Na++H2O 】(三)与氢氧化钠有关的反应方程式1.NaOH溶液与少量CO2反应:2NaOH+ CO2(少量)= Na2CO3+H2O 【2OH-+ CO2(少量)= CO32-+H2O】2. NaOH溶液与足量CO2反应:NaOH+ CO2(足量)= NaHCO3【OH-+ CO2(足量)= HCO3-】3. NaOH溶液中通入少量SO2:2NaOH+ SO2(少量)= Na2SO3+H2O 【2OH-+ SO2(少量)= SO32-+H2O】4. NaOH溶液中通入足量SO2:NaOH+ SO2(足量)= NaHSO3【OH-+ SO2(足量)= HSO3-】5. NaOH溶液与NH4Cl溶液加热反应:NaOH + NH4Cl= NaCl+H2O+NH3【OH-+NH4+= H2O+NH3↑】6. NaOH溶液和CuSO4溶液反应:2NaOH+CuSO4=Cu(OH)2↓+ Na2SO4【2OH-+Cu2+=Cu(OH)2 ↓】7. NaOH溶液和FeCl3溶液反应:3NaOH+FeCl3=Fe(OH)3↓+ 3NaCl 【3OH-+Fe3+=Fe(OH)3 ↓】(四)与钠盐有关的反应方程式1. NaHCO3固体受热分解:2NaHCO3∆===Na2CO3+H2O+CO2↑2. Na2CO3和足量盐酸反应:Na2CO3+2 HCl===2NaCl + CO2↑+H2O 【CO32-+2H+ = CO2↑+H2O】3. Na2CO3和少量盐酸反应:Na2CO3+ HCl===2NaHCO3 + NaCl 【CO32-+H+ = HCO3-】4. NaHCO3和盐酸反应:NaHCO3+ HCl===NaCl + CO2 +H2O 【HCO3-+H+ = CO2↑+H2O】5.Na2CO3溶液与过量醋酸溶液反应:Na2CO3+2CH3COOH===2CH3COONa+H2O+CO2↑【CO32-+2CH3COOH===2CH3COO-+H2O+CO2↑】6.NaHCO3溶液与醋酸溶液反应:NaHCO3+CH3COOH===CH3COONa+H2O+CO2↑【HCO3-+CH3COOH===CH3COO-+H2O+CO2↑】7.向Na2CO3溶液中通入CO2:Na2CO3+CO2+H2O===2NaHCO3【CO32-+CO2+H2O===2HCO3-】8.Na2CO3溶液与过量SO2反应:Na2CO3+2SO2+H2O===2NaHSO3+CO2【CO32-+2SO2+H2O===2HSO3-+CO2】9.碳酸钠溶液和氢氧化钙溶液反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 【CO32-+Ca2+===CaCO3↓】10. NaHCO3溶液与NaOH溶液反应:NaHCO3+NaOH===Na2CO3+H2O 【HCO3-+OH-===CO32-+H2O】11. NaHCO3溶液与少量澄清石灰水反应:2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O【2HCO3-+Ca2++2OH-===CaCO3↓+ CO32- + 2H2O】NaHCO3溶液与过量澄清石灰水反应:NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O【HCO3-+Ca2++OH-===CaCO3↓+ H2O】12.碳酸钠溶液和钡化钙溶液反应:Na2CO3+BaCl2===BaCO3↓+2NaCl 【CO32-+Ba2+===BaCO3↓】二·铁及其化合物有关反应方程式(一)与金属铁有关的反应方程式1.铁在氯气中燃烧:2Fe+3Cl2点燃===2Fe2Cl32.铁在氧气中燃烧:3Fe+3O2点燃===Fe3O43.铁与硫粉反应:Fe+S∆===FeS4.铁与水蒸气反应:3Fe+4H2O(g)高温===Fe3O4+4H25.铁与稀硫酸反应:Fe+H2SO4===FeSO4+H2↑【Fe+2H+===Fe2++H2↑】6.铁与CuSO4溶液反应:Fe+CuSO4===FeSO4+Cu 【Fe+Cu2+===Fe2++Cu】7.少量铁与稀硝酸反应:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O 【Fe+4H++NO3-===Fe3++NO↑+2H2O】8.过量铁与稀硝酸反应:3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O 【3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O】(二)与铁的氧化物有关的反应方程式1.Fe3O4与稀盐酸反应:Fe3O4+8HCl===FeCl2+2FeCl3+4H2O 【Fe3O4+8H+===Fe2++2Fe3++4H2O】2.FeO与稀硝酸反应:3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O 【3FeO+10H++NO3-===3Fe3++NO↑+5H2O】3.Fe3O4与稀硝酸反应:【3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O】4.FeO与酸性KMnO4溶液反应:【5FeO+18H++MnO4-===5Fe3++Mn2++9H2O】5.Fe3O4与酸性KMnO4溶液反应:【5Fe3O4+48H++MnO4-===15Fe3++Mn2++24H2O】(三)与铁的氢氧化物有关的反应方程式1.Fe(OH)2与稀盐酸反应:Fe(OH)2+2HCl===FeCl2+2H2O 【Fe(OH)2+2H+===Fe2++2H2O】2.Fe(OH)2与稀硝酸反应:3Fe(OH)2+10HNO3===3Fe(NO3)3+NO↑+8H2O【3Fe(OH)2+10H++NO3-===3Fe3++NO↑+8H2O】3.Fe(OH)2在空气中久置:4Fe(OH)2+O2+2H2O===4Fe(OH)34.Fe(OH)3受热分解:2Fe(OH)3∆===Fe2O3+3H2O(四)与亚铁盐或铁盐有关的反应方程式1.FeCl2溶液与氯气反应:2FeCl2+Cl2===2FeCl3 【2Fe2++Cl2===2Fe3++2Cl-】2.FeCl2溶液与稀硝酸反应:3FeCl2+4HNO3===3Fe(NO3)3+NO↑+2H2O【3Fe2++4H++NO3-===3Fe3++NO↑+2H2O】3.FeCl2溶液与酸性KMnO4溶液反应:【5Fe2++8H++MnO4-===5Fe3++Mn2++4H2O】4.FeCl3溶液与铁粉反应:2FeCl3+Fe===3FeCl2 【2Fe3++Fe===3Fe2+】5.FeCl3溶液与铜粉反应:2FeCl3+Cu===2FeCl2+CuCl2 【2Fe3++Cu===2Fe2++Cu2+】6.FeCl3溶液与H2S气体反应:H2S+2FeCl3===2FeCl2+S↓+2HCl 【2Fe3++H2S===2Fe2++S↓+2H+】7.FeCl3溶液与SO2气体反应:SO2+2FeCl3+2H2O===H2SO4+2FeCl2+2HCl【2Fe3++SO2+2H2O===2Fe2++4H++SO42-】8.FeCl3溶液与KSCN溶液反应:FeCl3+3KSCN===Fe(SCN)3+3KCl 【Fe3++3SCN-===Fe(SCN)3】9.将饱和FeCl3溶液滴加到沸水中制取Fe(OH)3胶体:【Fe3++3H2O∆===Fe(OH)3(胶体)+3H+】三·铝及其化合物有关反应方程式(一)与铝单质有关的反应方程式1.铝在氧气中燃烧:4Al+3O2点燃===2Al2O32.铝在氯气中燃烧:2Al+3Cl2点燃===2AlCl33.铝与Fe2O3反应(铝热反应):2Al+Fe2O3高温===Al2O3+2Fe4.铝与NaOH溶液反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑【2Al+2OH-+2H2O===2AlO2-+3H2↑】1.Al2O3与稀硫酸反应:Al2O3+3H2SO4===Al2(SO4)3+3H2O 【Al2O3+6H+===2Al3++3H2O】2.Al2O3与NaOH溶液反应:Al2O3+2NaOH===2 NaAlO2+H2O 【Al2O3+2OH-===2AlO2-+H2O】(三)与氢氧化铝有关的反应方程式1.Al(OH)3与NaOH溶液反应:Al(OH)3+NaOH=== NaAlO2+2H2O 【Al(OH)3+OH-===AlO2-+2H2O】2.Al(OH)3受热分解:2Al(OH)3∆===Al2O3+3H2O(四)与铝盐有关的反应方程式1.AlCl3与少量NaOH溶液反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl【Al3++3OH-===Al(OH)3↓】AlCl3与过量NaOH溶液反应:AlCl3+4NaOH=== NaAlO2+2H2O +3NaCl【Al3++4OH-=== AlO2-+2H2O】2.AlCl3与过量的氨水反应:【Al3++3NH3·H2O===Al(OH)3↓+3NH4+】3.AlCl3与NaHCO3溶液反应:【Al3++3HCO3-===Al(OH)3↓+3CO2 】(五)与偏铝酸盐有关的反应方程式1. NaAlO2溶液与少量稀盐酸反应:NaAlO2+HCl+H2O ===Al(OH)3↓+NaCl【AlO2-+H++H2O ===Al(OH)3↓】NaAlO2溶液与过量稀盐酸反应:NaAlO2+4HCl=== AlCl3+NaCl+2H2O 【AlO2-+4H+===Al3++4H2O】2. NaAlO2溶液与少量CO2反应:2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3【2AlO2-+CO2+3H2O ===2Al(OH)3↓+CO32-】NaAlO2溶液与过量CO2反应:NaAlO2+CO2+2H2O ===Al(OH)3↓+NaHCO3【AlO2-+CO2+2H2O ===Al(OH)3↓+HCO3-】3. NaAlO2溶液与AlCl3溶液反应:【3AlO2-+Al3++6H2O ===4Al(OH)3↓】四·镁及其化合物有关反应方程式(一)与镁单质有关的反应方程式1.镁在氧气中燃烧:2Mg+O2点燃===2MgO2.镁在氧气中燃烧:Mg+Cl2点燃===MgCl23.镁在CO2中燃烧:Mg+CO2点燃===2MgO+C4.镁与稀硫酸反应:Mg+H2SO4===MgSO4+H2↑【Mg+2H+===Mg2++H2↑】镁与浓硫酸反应:Mg+2H2SO4(浓)===MgSO4+SO2↑+2H2O5.镁与稀硝酸反应:3Mg+8HNO3===3Mg(NO3)2+2NO↑+4H2O 【3Mg+8H++2NO3-===3Mg2++2NO↑+4H2O】6.镁与CuSO4溶液反应:【Mg+Cu2+===Mg2++Cu】(二)与氢氧化镁有关的反应方程式Mg(OH)2受热分解:Mg(OH)2∆===MgO+H2O1.电解MgCl2溶液:MgCl2+2 H2O =通电= Mg(OH)2↓+ H2↑+ Cl2↑【Mg2++2Cl- +2 H2O =通电=Mg(OH)2↓+ H2↑+ Cl2↑】2.电解熔融MgCl2:MgCl2(熔融)=通电= Mg + Cl2↑五·铜及其化合物有关反应方程式(一)与铜单质有关的反应方程式1.铜与氧气反应:2Cu+O2∆===2CuO2.铜在氯气中燃烧:Cu+Cl2点燃===CuCl23.铜与硫粉共热反应:2Cu+S∆===Cu2S4.铜在潮湿空气中锈蚀变为铜绿:2Cu+O2+H2O+CO2===Cu2(OH)2CO35.铜与浓硫酸反应:Cu+2H2SO4(浓)∆===CuSO4+SO2↑+2H2O6.铜与浓硝酸反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 【Cu+4H++2NO3-===Cu2++2NO2↑+2H2O】铜与稀硝酸反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O【3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O】(二)与铜盐有关的反应方程式CuSO4溶液与H2S气体反应:CuSO4+H2S===CuS↓+H2SO4 【Cu2++H2S===CuS↓+2H+】(可用于H2S的检验与吸收)【金属的冶炼】1.钠的冶炼:2NaCl(熔融)电解===2Na + Cl2↑2.镁的冶炼:MgCl2(熔融)电解===Mg + Cl2↑3.铝的冶炼:2Al2O3(熔融)电解===4Al+3O2↑4.铁的冶炼:Fe2O3 + 3CO == 2 Fe+3 CO25.火法炼铜:O2+ Cu2S =高温= 2Cu+SO2湿法炼铜:Fe+ CuSO4== Cu+ FeSO4六·氯及其化合物有关反应方程式(一)与氯气有关的反应方程式1.铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl32.铜丝在氯气中燃烧:Cu+Cl2点燃===CuCl23.氢气在氯气中燃烧:H2+Cl2点燃===2HCl4.红磷在少量氯气中燃烧:2P+3Cl2点燃===2PCl3红磷在过量氯气中燃烧:2P+5Cl2点燃===2PCl55.氯气与水反应:Cl2+H2O HCl+HClO 【Cl2+H2O H++Cl-+HClO】6.氯水与SO2反应:Cl2+SO2+2H2O===H2SO4+2HCl 【Cl2+SO2+2H2O===4H++2Cl-+SO42-】7.氯气与Na2SO3溶液反应:Cl2+Na2SO3+H2O===Na2SO4+2HCl 【Cl2+SO32-+H2O===SO42-+2H++2Cl-】8.氯气与NaOH溶液反应:Cl2+2NaOH===NaCl+NaClO+H2O 【Cl2+2OH-===Cl-+ClO-+H2O】9.氯气与澄清石灰水反应:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 【Cl2+2OH-===Cl-+ClO-+H2O】10.氯气与KI溶液反应:Cl2+2KI===2KCl+I2【Cl2+2I-===2Cl-+I2】11.氯气与NaBr溶液反应:Cl2+2NaBr===2NaCl+Br2【Cl2+2Br-===2Cl-+Br2】12.氯气与Na2S溶液反应:Cl2+Na2S===2NaCl+S↓【Cl2+S2-===2Cl-+S↓】(二)与含氯化合物有关的反应方程式1.稀盐酸与Ca(ClO)2溶液反应:2HCl+Ca(ClO)2===CaCl2+2HClO 【H++ClO-===HClO】2.Ca(ClO)2溶液与少量CO2反应:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO【Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO】七·溴及其化合物有关反应方程式1.溴与铁粉反应:3Br2+2Fe===2FeBr32.溴与NaOH溶液反应:Br2+2NaOH===NaBr+NaBrO+H2O 【Br2+2OH-===Br-+BrO-+H2O】3.溴与氢硫酸反应:Br2+H2S===2HBr+S↓【Br2+H2S===2H++2Br-+S↓】4.溴水与SO2反应:Br2+SO2+2H2O===H2SO4+2HBr 【Br2+SO2+2H2O===2Br-+SO42-+4H+】5.溴与Na2SO3溶液反应:Br2+Na2SO3+H2O===Na2SO4+2HBr 【Br2+SO32-+H2O===2Br-+SO42-+2H+】八·碘及其化合物有关反应方程式(一)与碘单质有关的反应方程式1.碘与铁粉反应:Fe+I2=== FeI22.碘与氢硫酸溶液反应:I2+H2S===2HI+S↓【I2+H2S===2H++2I-+S↓】3.碘水与SO2反应:I2++SO2+2H2O===H2SO4+2HI 【I2++SO2+2H2O===2I-+SO42-+4H+】4.碘与亚硫酸钠溶液反应:I2+Na2SO3+H2O===Na2SO4+2HI 【I2+SO32-+H2O===2I-+SO42-+2H+】(二)与碘化物有关的反应方程式NaI溶液与FeCl3溶液反应:【2I-+ 2Fe3+===2 Fe2++I2】九·碳及其化合物有关反应方程式(一)与碳单质有关的反应方程式1.碳与水蒸气在高温下反应:C+H2O高温===CO+H2(水煤气)2.碳与SiO2在高温下反应:2C+SiO2高温===Si+2CO↑3.碳与CuO在高温下反应:C+2CuO高温===2Cu+CO2↑4.碳与Fe2O3在高温下反应:3C+2Fe2O3高温===4Fe+3CO2↑5.碳与浓硫酸在加热时反应:C+2H2SO4(浓)∆===CO2↑+2SO2↑+2H2O6.碳与浓硝酸在加热时反应:C+4HNO3(浓)∆===CO2↑+4NO2↑+2H2O(二)与碳的氧化物有关的反应方程式1.CO在氧气中燃烧:2CO+O2点燃===2CO22.CO与Fe2O3在高温下反应:3CO+Fe2O3高温===2Fe+3CO23.CO与CuO在高温下反应:CO+CuO高温===Cu+CO24.CO2与Na2CO3溶液反应:Na2CO3+CO2+H2O===2NaHCO3【CO32-+CO2+H2O===2HCO3-】5.少量CO2与Na2SiO3溶液反应:CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3【CO2+H2O+SiO32-===H2SiO3↓+CO32-】过量CO2与Na2SiO3溶液反应:2CO2+2H2O+Na2SiO3===H2SiO3↓+2NaHCO3【2CO2+2H2O+SiO32-===H2SiO3↓+2HCO3-】十·氮及其化合物有关反应方程式(一)与N2有关的反应方程式1.镁条在N2中燃烧:N2+3Mg点燃===Ng3N22.工业上合成氨:N2+3H2=====2NH33.N2与O2在放电时反应:N2+O2放电===2NO(二)与NO有关的反应方程式1.NO与O2反应:2NO+O2===2NO22.NO2与水反应:3NO2+H2O===2HNO3+NO3.NO2与NaOH溶液反应:2NO2+2NaOH===NaNO2+NaNO3+H2O 【2NO2+2OH-===NO2-+NO3-+H2O】4.NO、NO2混合气体与NaOH溶液反应:NO+NO2+2NaOH===2NaNO2+H2O【NO+NO2+2OH-===2NO2-+H2O】(三)与NH3有关的反应方程式1.NH3与O2催化氧化反应:4NH3+5O2催化剂===4NO+6H2O2.少量NH3与氯气反应:2NH3+3Cl2===6HCl+N2过量NH3与氯气反应:8NH3+3Cl2===6NH4Cl+N23.NH3与水反应:NH3+H2O===NH3·H2O===NH4++OH-4.NH3与浓盐酸反应:NH3+HCl===NH4Cl(白烟)(四)与硝酸有关的反应方程式1.硝酸见光或受热分解:4HNO3受热或见光======4NO2↑+O2↑+2H2O2.铜与浓硝酸反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 【Cu+4H++2NO3-===Cu2++2NO2↑+2H2O】3.铜与稀硝酸反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 【3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O】4.碳与浓硝酸反应:C+4HNO3(浓)∆===CO2↑+4NO2↑+2H2O5.FeCl2与稀硝酸反应:3FeCl2+4HNO3===3Fe(NO3)3+NO↑+2H2O【3Fe2++4H++NO3-===3Fe3++NO↑+2H2O】6.Na2S与稀硝酸反应:3Na2S+8HNO3===2NO↑+3S↓+4H2O+6 NaNO3【3S2-+8H++2NO3-===2NO↑+3S↓+4H2O】7.Na2SO3与稀硝酸反应:3Na2SO3+2HNO3===3Na2SO4+2NO↑+H2O【3SO32-+2H++2NO3-===3SO42-+2NO↑+H2O】(五)与铵盐有关的反应方程式1.NH4Cl加热分解:NH4Cl∆===NH3↑+HCl↑2. 实验室制氨气:2NH4Cl+Ca(OH)2∆===CaCl2+2NH3↑+2H2O3.NH4Cl溶液与NaOH溶液反应:NH4Cl+NaOH===NH3·H2O+NaCl 【NH4++OH-===NH3·H2O】4.NH4HCO3溶液与过量NaOH溶液加热时反应:NH4HCO3+2NaOH∆===NH3↑+Na2CO3+2H2O【NH4++HCO3-+2OH-∆===NH3↑+CO32-+2H2O】十一·硫及其化合物有关反应方程式(一)与硫单质有关的反应方程式1.硫粉与铁粉加热反应:S+Fe∆===FeS2.硫与氢气加热反应:S+H2∆===H2S3.硫在氧气中燃烧:S+O2点燃===SO24.硫与NaOH溶液加热反应:3S+6NaOH∆===2Na2S+Na2SO3+3H2O 【3S+6OH-∆===2S2-+SO32-+3H2O】(二)与SO2有关的反应方程式1.SO2与氧气反应:2SO2+O2===2SO32.SO2与氯水反应:SO2+Cl2+2H2O===H2SO4+2HCl 【SO2+Cl2+2H2O===4H++SO42-+Cl-】3.SO2与水反应:SO2+H2O===H2SO34.SO2与CaO反应:SO2+CaO∆===CaSO35.少量SO2与澄清石灰水反应:SO2+Ca(OH)2===CaSO3↓+H2O过量SO2与澄清石灰水反应:2SO2+Ca(OH)2===Ca(HSO3)2 【SO2+OH-===HSO3-】6.SO2与FeCl3溶液反应:SO2+2FeCl3+2H2O===H2SO4+2FeCl2+2HCl【SO2+2Fe3++2H2O===4H++SO42-+2Fe2+】7.SO2与酸性KMnO4溶液反应:5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4【5SO2+2MnO4-+2H2O===5SO42-+2Mn2++4H+】8.SO2与H2S反应:SO2+2H2S===3S↓+2H2O9.SO2与H2O2溶液反应:SO2+H2O2===H2SO4(三)与硫化物有关的反应方程式1.H2S在氧气中燃烧:2H2S+5O2(过量)点燃===4SO2+2H2O 2H2S+O2(少量)点燃===4S+2H2O2.H2S与氯气反应:H2S+Cl2===S+2HCl3.H2S与SO2反应:SO2+2H2S===3S↓+2H2O4.FeS与稀硫酸反应:FeS+H2SO4===H2S↑+FeSO4 【FeS+2H+===H2S↑+Fe2+】(四)与浓硫酸有关的反应方程式1.H2S与浓硫酸反应:H2S+H2SO4(浓)===S↓+SO2↑+2H2O2.HI与浓硫酸反应:2HI+H2SO4(浓)===I2+SO2↑+2H2O3.铜与浓硫酸加热反应:Cu+2H2SO4(浓)∆===CuSO4+SO2↑+2H2O4.铁与浓硫酸加热反应:2Fe+6H2SO4(浓)∆===Fe2(SO4)3+3SO2↑+6H2O5.锌与浓硫酸常温下反应:Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O6.碳与浓硫酸加热反应:C+2H2SO4(浓)∆===CO2↑+2SO2↑+2H2O7.硫与浓硫酸加热反应:S+2H2SO4(浓)∆===3SO2↑+2H2O8.Na2SO3粉末与浓硫酸反应:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O(五)与硫酸盐有关的反应方程式1.CuSO4溶液与Ba(OH)2溶液反应:CuSO4+Ba(OH)2===Cu(OH)2↓+BaSO4↓2.NaHSO4溶液与Ba(OH)2溶液混合呈中性:2H++SO42-+2OH-+Ba2+===BaSO4↓+2H2O向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:H++SO42-+OH-+Ba2+===BaSO4↓+H2O 十二·硅及其化合物有关反应方程式(一)与硅单质有关的反应方程式1.硅与氧气反应:Si+O2∆===SiO22.硅与氯气反应:Si+2Cl2∆===SiCl43.硅与碳反应:Si+C∆===SiC4.硅与氢氟酸反应:Si+4HF===SiF4↑+2H2↑5.硅与NaOH溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑【Si+2OH-+H2O===SiO32-+2H2↑】(二)与SiO2有关的反应方程式1.SiO2与碳反应:SiO2+2C∆===Si+2CO↑2.SiO2与CaO反应:SiO2+CaO高温===CaSiO33.SiO2与氢氟酸反应:SiO2+4HI===SiF4↑+2H2O4.SiO2与NaOH溶液反应:SiO2+2NaOH===Na2SiO3+H2O 【SiO2+2OH-===SiO32-+H2O】5.SiO2与Na2CO3高温反应:SiO2+Na2CO3高温===Na2SiO3+CO2↑6.SiO2与CaCO3高温反应:SiO2+CaCO3高温===CaSiO3+CO2↑(三)与硅酸盐有关的反应方程式1.Na2SiO3溶液与少量CO2反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3【SiO32-+CO2+H2O===H2SiO3↓+CO32-】2.Na2SiO3溶液与过量CO2反应:Na2SiO3+2CO2+2H2O===H2SiO3↓+2NaHCO3【SiO32-+2CO2+2H2O===H2SiO3↓+2HCO3-】。
钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO45、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO311、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO324、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaCl27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOH4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaCl5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO39、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOH2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O铝及其化合物的化学方程式 一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3S Al 2S 34、铝与稀硫酸反应:2Al +3H 2SO4Al 2(SO 4)3 +3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O2NaAlO 2+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO3Al(NO 3)3 +NO ↑+2H 2O8、铝和硝酸银溶液反应:Al +3AgNO3Al(NO 3)3 +3Ag 9、铝与硫酸铜溶液反应:2Al +3CuSO4Al 2(SO 4)3 +3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOHNaAlO 2+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝冰晶石电解1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3·H2O]4、高温条件铁与氧气反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2(SO4)3+3SO2↑+6H2O9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O10、少量的铁与浓硝酸共热:Fe+6HNO3Fe(NO3)3+3NO2↑+3H2O11、过量的铁与浓硝酸共热:Fe+4HNO3Fe(NO3)2+2NO2↑+2H2O12、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑+2H2O13、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3Fe(NO3)3+NO2↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO43Fe2(SO4)3+SO2↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO33Fe(NO3)3+NO2↑+5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O6、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4Fe2(SO4)3+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3Fe(NO3)3+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O2、氢氧化铁溶于氢碘酸:2Fe(OH)3+6HI2FeI2+I2+6H2O3、加热氢氧化铁:2Fe(OH)3Fe2O3+3H2O七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl36、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr37、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaCl9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl2+2NaAlO2+4H2O Fe(OH)2↓+2Al(OH)3↓+2NaCl11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3Fe(NO3)3+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl22、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3、铁与氯化铁溶液反应:Fe+2FeCl33FeCl24、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl25、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O Fe(OH)3↓+3Al(OH)3↓+3NaCl12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClO学习必备欢迎下载13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+Fe(NO3)319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl20、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)321、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)3。
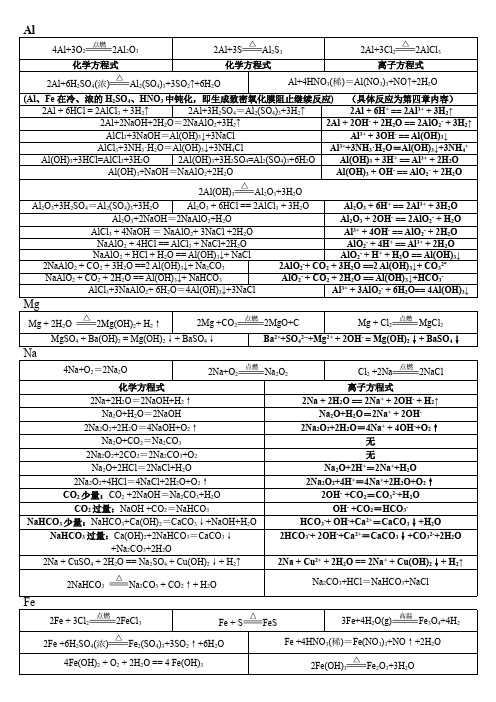
Na 、Mg 、Al 、Fe 及其化合物的化学方程式和离子方程式一、Na 及其化合物的化学方程式和离子方程式 (1)Na 的反应 1、钠和水反应:方程式: 2Na+2H 2O=2NaOH+H 2↑ 离子方程式: 2Na+2H 2O=2Na +2OH -+H 2↑ 2.钠分别和氧气、硫、氯气:2Na+O 2Na 2O 2 (或加热) 4Na+O 2 = 2Na 2O 2Na+S =Na 2S 2Na+Cl 22NaCl 3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式: 2Na+H 2SO 4=Na 2SO 4+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑方程式:2Na+2CH 3COOH=2CH 3COONa+H 2↑ 离子方程式: 2Na+2CH 3COOH=2CH 3COO -+2Na ++H 2↑ 4.钠分别和硫酸铜溶液、氯化铁溶液方程式: 2Na +2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 离子方程式: 2Na +2H 2O+Cu 2+=Cu(OH)2↓+2Na ++H 2↑ 方程式: 6Na +6H 2O+2FeCl 3=2Fe(OH)3↓+6NaCl+3H 2↑ 离子方程式: 6Na +6H 2O+2Fe 3+=2Fe(OH)3↓+6Na ++3H 2↑(2)Na 的氧化物反应 1.氧化钠分别与水、盐酸方程式: Na 2O+H 2O=2NaOH 离子方程式: Na 2O+H 2O=2Na ++2OH - 方程式: Na 2O+2HCl=2NaCl+H 2O 离子方程式: Na 2O+2H +=2Na ++H 2O 2.过氧化钠分别与盐酸、水方程式: 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 离子方程式: 2Na 2O 2+4H + =4Na ++2H 2O+O 2↑ 方程式: 2Na 2O 2+2H 2O=4NaOH+O 2↑ 离子方程式: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ 3.过氧化钠分别与二氧化碳:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (3)Na 2CO 3、NaHCO 3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na 2CO 3、NaHCO 3的方法)碳酸钠受热不分解 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ 2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na 2CO 3+HCl =NaHCO 3 +NaCl CO 32-+H +=HCO 3-NaHCO 3+HCl =NaCl+CO 2↑+H 2O HCO 3-+H +=CO 2↑+H 2O过量的盐酸时:Na 2CO 3+2HCl =2NaCl+CO 2↑+H 2O CO 32-+2H +=CO 2↑+H 2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+ Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或 CO2+ Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合 (类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH 2Cl-+2H2OCl2↑+H2↑+2OH- 9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3+ OH-溶液呈碱性二、Mg、Al及其化合物的化学方程式和离子方程式(1)Mg的反应1.镁在空气中燃烧2Mg + O2 2MgO 3Mg +N2 Mg3N2 2Mg + CO2 2MgO + C2.镁能溶解在氯化铵溶液中Mg + 2NH4Cl = MgCl2 + H2↑+ NH3↑ Mg + 2NH4+= Mg2+ + H2↑+ NH3↑(2) Al的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O2=2Al2O3在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
4.铝与盐酸反应、铝与氢氧化钠溶液反应2Al+6HCl = 2AlCl3+3H2↑ 2Al+6H+= 2Al3++3H2↑2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑5.铝在高温条件下与氧化铁(或FeO、Fe3O4、Fe2O3、MnO2、Cr2O3)反应2Al+Fe2O3 Al2O3 + 2Fe(3)Al2O3的反应6.氧化铝分别与盐酸、氢氧化钠溶液反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2OAl2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O(一般金属氧化物都不与碱反应,Al2O3特别,应引起注意)(4) Al(OH)3的反应1.氢氧化铝分别与盐酸、氢氧化钠溶液反应Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al++3H2OAl(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O2.加热氢氧化铝:2Al(OH)3 Al2O3+3H2O(4) Al3+的反应1.氯化铝(硫酸铝)溶液中加入少量(或过量)的氢氧化钠溶液少量NaOH :AlCl3+3NaOH =Al(OH)3↓+3NaCl Al3++3OH-=Al(OH)3↓过量NaOH :AlCl3+4NaOH =NaAlO2+3NaCl +2H2O Al3++4OH-=AlO2-+2H2O 2.氯化铝(硫酸铝)溶液中加入少量(或过量)的氨水AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)3↓+3NH4+(5) AlO2-的反应1.偏铝酸钠溶液中加入少量(或过量)的盐酸(Al(OH)3制备方法之一)少量盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl AlO2-+H++H2O=Al(OH)3↓过量盐酸:NaAlO2+4HCl=AlCl3+NaCl+2H2O AlO2-+4H+=Al3++2H2O2.偏铝酸钠溶液中通入少量(或过量)的二氧化碳(Al(OH)3制备方法之一)少量CO2:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-过量CO2:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(6) Al3+与AlO2-的反应及双水解6.氯化铝溶液和偏铝酸钠溶液(Al3+与HCO3-、CO32-、S2-、HS-) (Al(OH)3制备方法之一) AlCl3 + 3NaAlO2 + 6H2O = 4 Al(OH)3↓+3NaCl Al3++ 3AlO2-+ 6H2O = 4Al(OH)3↓7.偏铝酸钠溶液和碳酸氢钠溶液混合NaAlO2+NaHCO3+H2O=Al(OH)3↓+Na2CO3 AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-8.用简单的文字说明和离子方程式描述明矾可以净水的理由明矾溶于水后电离出Al3+发生水解生成吸附性很强的Al(OH)3胶体,吸附杂质达到净水目的:Al3++3H2OAl(OH)3胶体+3H+(6) Al与Mg的制取工业上生产Mg和Al金属MgCl2(熔融)Mg+Cl2↑ 2Al2O3(熔融)4Al+3O2↑三、Fe及其化合物的化学方程式和离子方程式(1) Fe的反应1.铁分别在氧气、氯气中燃烧、铁和硫混合加热(氧气、氯气和硫的氧化性:)3Fe+2O2Fe3O4 2Fe+3Cl22FeCl3 Fe+SFeS 氧化性:Cl2>O2>S2.铁加入盐酸(或硫酸)中Fe+2HCl=FeCl2+H2↑ Fe+2H+=Fe2++H2↑Fe+H2SO4=FeSO4+H2↑ Fe+2H+=Fe2++H2↑3.铁加入过量..的稀(或浓)硝酸中稀:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O Fe+4H++NO3-=Fe3++NO↑+2H2O浓:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O Fe+6H++3NO3-=Fe3++3NO2↑+3H2O4.铁加入少量..的稀(或浓)硝酸中稀:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O浓:Fe+4HNO3=Fe(NO3)2+2NO2↑+2H2O Fe+4H++2NO3-=Fe3++2NO2↑+2H2O5.铁在高温条件下与水蒸气反应3Fe+4H2O(g)Fe3O4+4H26.铁粉加入到氯化铜(或氯化铁)溶液中Fe+CuCl2=FeCl2+Cu Fe+Cu2+=Fe2++CuFe+2FeCl3=3FeCl2 Fe+2Fe3+=3Fe2+(2) Fe的氧化物的反应1.FeO、Fe3O4、Fe2O3分别与盐酸反应FeO+2HCl=FeCl2+H2O FeO+2H+=Fe2++H2OFe3O4+8HCl=FeCl2+2FeCl3+4H2O Fe3O4+8H+=Fe2++ 2Fe3++4H2OFe2O3+6HCl=2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O2.FeO、Fe3O4、Fe2O3分别与稀硝酸反应3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O 3FeO+10H++NO3-=3Fe3++NO↑+5H2O3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O Fe2O3+6HNO3=2Fe(NO3)3+3H2O Fe2O3+6H+=2Fe3++3H2O 3.FeO、Fe3O4、Fe2O3分别与氢碘酸反应FeO+2HI=Fel2+H2O FeO+2H+=Fe2++H2OFe3O4+8HI=3Fel2+I2+4H2O Fe3O4+8H++2I-=3Fe2++I2+4H2OFe2O3+6HI=2FeI2+I2+3H2O Fe2O3+6H++2I-=2Fe2++I2+3H2O 4.FeO、Fe3O4、Fe2O3分别与氢气反应FeO+H2Fe+H2O Fe3O4+4H23Fe+4H2O Fe2O3+3H22Fe+3H2O 5.FeO、Fe3O4、Fe2O3分别与CO反应FeO+COFe+CO2 Fe3O4+4CO3Fe+4CO2 Fe2O3+3CO2Fe+3CO26.FeO、Fe3O4、Fe2O3分别与Al反应3FeO+2Al3Fe+Al2O3 2Fe3O4+6Al6Fe+4Al2O3 Fe2O3+2Al2Fe+ Al2O3(3) Fe的氢氧化物的反应1.Fe(OH)2、Fe(OH)3、C u(O H)2分别与盐酸(稀硫酸)反应Fe(OH)2+2HCl=FeCl2+H2O Fe(OH)2+2H+=Fe2++H2OFe(OH)3+3HCl=FeCl3+3H2O Fe(OH)3+3H+=Fe3++3H2OC u(O H)2+2HCl=CuCl2+2H2O C u(O H)2+2H+=Cu2++2H2O2.Fe(OH)2、Fe(OH)3、C u(O H)2分别与稀硝酸反应3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O 3Fe(OH)2+10H++NO3-=3Fe3++NO↑+H2OFe(OH)3+3HNO3=FeCl3+3H2O Fe(OH)3+3H+=Fe3++3H2OC u(O H)2+2HNO3=CuCl2+2H2O C u(O H)2+2H+=Cu2++2H2O3.Fe(OH)2、Fe(OH)3、C u(O H)2分别与氢碘酸(或氢硫酸)反应Fe(OH)2+2HI=Fel2+H2O Fe(OH)2+2H+=Fe2++H2O2Fe(OH)3+6Hl=2Fel2+I2+6H2O 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2OC u(O H)2+2Hl=Cul2+2H2O C u(O H)2+2H+=Cu2++2H2O4.Fe(OH)2不稳定,在空气中易被氧化,由白色迅速变成灰绿色,最终变成红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)35.Fe(OH)3、C u(O H)2受热均易分解2Fe(OH)3Fe2O3+3H2O Cu(OH)2CuO+H2O(4) Fe的氢氧化物的制备1.F e(O H)2制备(注意防氧化措施)FeSO4+2NaOH=F e(O H)2↓+Na2SO4 Fe2++2OH-=F e(O H)2↓2.F e(O H)3制备、C u(O H)2制备Fe2(SO4)3+6NaOH=2F e(O H)3↓+3Na2SO4 Fe3++3OH-=F e(O H)3↓CuSO4+2NaOH=C u(O H)2↓+Na2SO4 Cu2++2OH-=C u(O H)2↓(5) Fe2+与Fe3+的转化1.Fe2+盐(绿矾:FeSO4·7H2O)溶液与稀硝酸、O3、H2O2、酸性KMnO4、Cl2水、Br2水、Na2S溶液等3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 6Fe2++O3+6H+=6Fe3++3H2O2Fe2++H2O2+2H+=2Fe3++2H2O 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O2Fe2++Cl2=2Fe3++2Cl- 2Fe2++Br2=2Fe3++2Br- Fe2++S2-=FeS↓2.用FeCl3溶液腐蚀印刷电路铜板2FeCl3+Cu=2FeCl2+ CuCl2 2Fe3++Cu=2Fe2++ Cu2+3.FeCl3溶液中加入Fe粉、通入H2S气体、加入Na2S溶液、加入氢碘酸等2Fe3++Fe=3Fe2+ 2Fe3++H2S=2Fe2++S↓+2H+ 2Fe3++S2-=2Fe2++S↓ 2Fe3++2I-=2Fe2++I2 4.FeCl3溶液与少量(或过量)的Zn粉反应少量Zn粉:2Fe3++Zn=2Fe2++ Zn2+过量Zn粉:先发生2Fe3++Zn=2Fe2++ Zn2+然后发生Zn+Fe2+= Zn2++ Fe所以过量Zn粉时总反应为:2Fe3++3Zn=2Fe+ 3Zn2+(6) Fe3+的检验1.FeCl3溶液与KSCN溶液混合Fe3++nSCN-=Fe(SCN)n(3-n) 经常写成:Fe3++3SCN-=Fe(SCN)3(血红色,不是沉淀,不标“↓”)。