各温度下30~300氢氧化钠溶液的密度、粘度和比焓
- 格式:xls
- 大小:40.50 KB
- 文档页数:8

氢氧化钠溶解度表溶解度简介溶解度是指特定温度、压力下,某种物质在溶液中可以溶解的量。
溶解度通常用质量浓度或摩尔浓度表示,其单位为 g/L 或 mol/L。
氢氧化钠溶解度简介氢氧化钠是一种强碱性物质,其溶解度与温度密切相关。
在常温下,氢氧化钠溶解度较小。
但随着温度升高,溶解度也随之增大。
氢氧化钠的溶解度常常用于实验室中的化学反应,也广泛应用于金属表面处理等工业领域。
氢氧化钠溶解度表以下是氢氧化钠在不同温度下的溶解度表:温度(℃)溶解度(g/L)0 69.910 80.020 91.225 96.030 105.040 126.050 150.060 177.070 208.080 241.090 280.0100 323.0从表中可以看出,随着温度的升高,氢氧化钠的溶解度呈现递增趋势。
特别地,当氢氧化钠溶解温度达到100℃时,溶解度可达到323.0 g/L,同时生成的溶液呈现出透明、无色、高度腐蚀性等性质。
氢氧化钠溶解度与pH值的关系氢氧化钠属于强碱,其溶液pH值随着浓度的增加而增大,同时具有腐蚀性。
如果将氢氧化钠溶解到一定浓度时,溶液的pH值将超过14,这时会产生很大的腐蚀和感觉刺激。
氢氧化钠应用领域除了在化学实验室中广泛应用外,氢氧化钠在实际应用领域中也具有重要意义。
比如,在金属表面处理领域,氢氧化钠可用于金属的脱脂和清洗;在化工生产领域,氢氧化钠可作为制造肥料、塑料、纤维等的原料。
在医疗领域,氢氧化钠也有一定的应用。
例如,将氢氧化钠溶液浸染于纱布,然后涂盖于烧伤表面,可以快速去除坏死的组织,促进健康组织恢复。
总结氢氧化钠作为一种广泛应用的物质,在实验室、工业领域、金属表面处理和医疗领域都具有不同形式的应用。
而氢氧化钠的溶解度,在基础实验和应用研究中都居于重要地位,对于理解其化学反应机理和掌握化学实验操作也具有极大帮助。

氧化钠溶液的浓度、溶质的质量分数和密度氢氧化钠溶液的浓度、溶质的质量分数和密度密度20℃克/ 毫升物质的量浓度(mol/L)密度20℃克/毫升物质的量浓度(mol/L)密度20℃克/毫升物质的量浓度(mol/L)密度20℃克/毫升物质的量浓度(mol/L)克/100克溶液质量×0.01摩尔/升克/100克溶液质量×0.01摩尔/升克/100克溶液质量×0.01摩尔/升克/100克溶液质量×0.01摩尔/升1.000 0.159 0.039 1.135 12.373.510 1.2724.645 7.824 1.405 37.49 13.17 1.005 0.602 0.151 1.140 12.83 3.655 1.2725.10 8.000 1.410 37.99 13.30 1.010 1.045 0.264 1.145 13.28 3.801 1.2825.56 8.178 1.415 38.49 13.61 1.015 1.49 0.378 1.150 13.73 3.947 1.2826.02 8.357 1.420 38.99 13.84 1.020 1.94 0.494 1.155 14.18 4.095 1.2926.48 8.0539 1.425 39.495 14.07 1.025 2.39 0.611 1.160 14.64 4.244 1.2926.94 8.722 1.430 40.00 14.30 1.030 2.84 0.731 1.165 15.09 4.395 1.3027.418.906 1.435 40.515 14.53 1.035 3.29 0.851 1.170 15.54 4.545 1.3027.879.092 1.440 41.03 14.77 1.040 3.745 0.971 1.175 15.99 4.697 1.3128.33 9.278 1.445 41.55 15.01 1.045 4.20 1.097 1.180 16.44 4.850 1.3128.80 9.466 1.450 42.07 15.25 1.050 4.655 1.222 1.185 16.89 5.004 1.3229.26 9.656 1.455 42.59 15.49 1.055 5.11 1.347 1.190 17.345 5.160 1.3229.73 9.847 1.460 43.12 15.74 1.060 5.56 1.474 1.195 17.80 5.317 1.3330.20 10.04 1.465 43.64 15.98 1.065 6.02 1.602 1.200 18.255 5.476 1.3330.67 10.23 1.470 44.17 16.23 1.070 6.47 1.731 1.205 18.71 5.636 1.3431.14 10.43 1.475 44.695 16.48 1.075 6.93 1.862 1.210 19.16 5.796 1.3431.62 10.63 1.480 45.22 16.73 1.080 7.38 1.992 1.215 19.62 5.958 1.3532.10 10.83 1.485 45.75 16.98 1.085 7.83 2.123 1.220 20.07 6.122 1.3532.58 11.03 1.490 46.27 17.28 1.090 8.28 2.257 1.225 20.53 6.286 1.3633.06 11.24 1.495 46.80 17.49 1.095 8.74 2.391 1.230 20.98 6.451 1.3633.54 11.45 1.500 47.23 17.75 1.100 9.19 2.527 1.235 21.44 6.619 1.3734.03 11.65 1.505 47.85 18.00 1.105 9.645 2.664 1.240 21.90 6.788 1.3734.52 11.86 1.510 48.88 18.2 1.110 10.10 2.802 1.245 22.30 6.958 1.3835.01 12.08 1.515 48.905 18.52 1.115 10.555 2.942 1.250 22.82 7.129 1.3835.50 12.29 1.520 49.44 18.78 1.120 11.01 3.082 1.255 23.275 7.302 1.3936.00 12.51 1.525 49.97 19.05 1.125 11.46 3.224 1.260 23.73 7.475 1.3936.495 12.73 1.530 50.50 19.31 1.130 11.92 3.367 1.265 24.19 7.650 1.4036.99 12.95HCl溶液的浓度和密度密度20℃克/毫升HCl浓度密度20℃克//毫升HCl浓度密度20℃克/毫升HCl浓度克/100克溶液质量×10-2摩尔/升克/100克溶液质量×10-2摩尔/升克/100克溶液质量×10-2摩尔/升1.000 0.3600 0.0981.070 14.495 4.2531.140 28.18 8.8091.005 1.360 0.3741.075 15.485 4.5651.145 29.17 9.1591.0102.364 0.6541.080 16.47 4.8781.150 30.14 9.5051.015 3.374 0.9391.085 17.45 5.1921.155 31.14 9.8631.020 4.388 1.2271.090 18.43 5.50951.160 32.14 10.2251.025 5.408 1.5201.095 19.41 5.8291.165 33.16 10.5951.030 6.433 1.8171.100 20.39 6.151.170 34.18 10.971.035 7.464 2.1181.105 21.36 6.4721.175 35.20 11.341.040 8.490 2.4211.110 22.33 6.7961.180 36.23 11.731.045 9.510 2.7251.115 23.29 7.1221.185 37.27 12.111.050 10.52 3.029 1.120 24.25 7.4491.190 38.32 12.501.055 11.52 3.333 1.125 25.22 7.7821.195 39.37 12.901.060 12.513.638 1.130 26.20 8.1181.198 40.00 13.141.065 13.50 3.944 1.135 27.18 8.459 大气的组成气体在干空气中的气体在干空气中的N2 78.09 He 0.00052 O2 20.95 Kr 0.00011 Ar 0.93 H2 0.00005CO2 0.03 Xe 0.000009 Ne 0.0018 Ra 6×10-13常见气体在标准状况下的摩尔体积气体名称摩尔体积(升/摩尔)气体名称摩尔体积(升/摩尔)甲烷22.36 3-甲基丁烯-[1] 22.33 乙烷22.16 戊烯(顺和反异构体混合物)22.38 丙烷22.0 2-甲基丁烯-[1] 22.33 正丁烷21.5 2-甲基丁烯-[2] 22.33 异丁烷21.78 丁二烯-[1,3] 21.6 确戊烷20.87 2-甲基丁二烯22.34 乙烯22.24 乙炔22.22 丙烯21.96 丁炔-[2] 21.8 丁烯(混合物)21.57 氢22.43 氧22.39 一氧化氮22.39氮 22.40 氨 22.09 空气中的氮 22.40氯 22.02 空气 22.40氯化氢 22.24 一氧化碳22.40 氦 22.42 二氧化碳22.26 氖 22.43 硫化氢 22.14 氩 22.39 二氧化硫21.89 氪 22.38 二氧化氮 22.09 氙22.29标准溶液浓度的一升量值温度不正值表补 正 值 (毫 升)水 及 0.05 N 以下的各种水溶液0.1N 和0.2 N 各种水溶液1/2H 2SO 4 0.5N HNO 3 NaOH水溶液0.5N HCL 水溶液1/2H 2SO 41 N HNO 3NaOH 水溶液1N HCL 水溶液0.1N KOH 乙醇(95%)溶液. 1N亚砷酸钠溶液备 注5 6 7 8 9 10 11+1.38 +1.38 +1.36 +1.33 +1.29 +1.23 +1.17+1.7 +1.7 +1.6 +1.6 +1.5 +1.5 +1.4+2.4 +2.3 +2.2 +2.2 +2.1 +2.0 +1.8+1.9 +1.9 +1.8 +1.8 +1.7 +1.6 +1.5+3.6 +3.4 +3.2 +3.0 +2.7 +2.5 +2.3+2.3 +2.2 +2.2 +2.1 +2.0 +1.9 +1.8+10.8 +9.6+1.8 +1.7(1)本表数值是以20℃为标准温度,以实测法测出;温度(℃) 标准溶液种类12131415161718192021222324252627282930313233343536+1.10+0.99+0.88+0.77+0.64+0.50+0.34+0.180.00-0.18-0.38-0.58-0.80-1.03-1.26-1.51-1.76-2.01-2.30-2.58-2.86-3.04-3.47-3.78-4.10+1.3+1.1+1.0+0.9+0.7+0.6+0.4+0.20.0-0.2-0.4-0.6-0.9-1.1-1.4-1.7-2.0-2.3-2.5-2.7-3.0-3.2-3.7-4.0-4.3+1.7+1.5+1.3+1.1+0.9+0.7+0.5+0.20.0-0.2-0.5-0.8-1.0-1.3-1.5-1.8-2.1-2.4-2.8-3.1-3.4-3.7-4.1-4.4-4.7+1.4+1.2+1.1+0.9+0.8+0.6+0.4+0.20.0-0.2-0.4-0.7-0.9-1.1-1.4-1.7-2.0-2.3-2.5-2.7-3.0-3.3-3.6-4.0-4.3+2.0+1.8+1.6+1.3+1.1+0.8+0.6+0.30.0-0.3-0.6-0.9-1.2-1.5-1.8-2.1-2.4-2.8-3.2-3.5-3.9-4.2-4.6-5.0-5.3+1.6+1.4+1.2+1.0+0.8+0.6+0.4+0.20.0-0.2-0.5-0.7-1.0-1.2-1.4-1.7-2.0-2.3-2.6-2.9-3.2-3.5-3.8-4.1-4.4+8.5+7.4+6.5+5.2+4.2+3.1+2.1+1.00.0-1.1-2.2-3.3-4.2-5.3-6.4-7.5-8.5-9.6-10.6-11.6-12.6-13.7-14.8-16.0-17.0+1.5+1.4+1.2+1.0+0.9+0.7+0.4+0.20.0-0.2-0.4-0.6-0.8-1.1-1.4-1.7-2.0-2.3-2.5-2.8-3.1-3.5-3.8-4.2(2)表中带有“+”、“-”号数值是以20℃为分界,室温低于20℃的补正值均为“+”,高于20℃的补正值均为“-”;(3)本表的用法:如1N硫酸1升由25℃换算为20℃时,其体积修正值为-1.5毫升,故40.00毫升换算为20℃时的体积为:V20=40.00=39.94毫升水的体积和质量分数换算表(供校准玻璃容量仪器体积用)温度℃1升水在真空中质量1000×dt(克)1升水在空气中质量wt(克)1克水所占的体积V(毫升)校正项1000-Wt10 999.70 998.39 1.00161 1.6111121314151617181920212223242526272829303132 999.60999.49999.38999.26999.13998.97998.8998.62998.43998.23998.02997.80997.56997.32997.07996.81996.54996.26995.97995.67995.37995.05998.31998.23998.14998.04997.93997.80997.65997.51997.34997.18997.00996.80996.60996.38996.17996.53995.69995.44995.18994.91994.64994.341.001691.001771.001861.001961.002071.002201.002361.002501.002671.002831.003011.003211.003411.003631.003841.004091.004331.004581.004841.005111.005391.005691.691.771.861.962.072.202.352.492.662.823.003.203.403.623.834.074.314.564.825.095.365.66333435 994.73994.40994.06994.06993.85993.451.005981.006291.006595.946.256.55在t℃称得水重W克,则量取W克水的玻璃仪器容积:V20=W×v(ml)或V20=W/Wt=1000(ml)(式中V20是指玻璃容器在20℃时所具有的容积)滴定液的温度校正值本表列出水和稀的水溶液在t℃时的观测体积换算为20℃时的体积校正值(单位毫升)。

naoh水溶液密度NaOH是化学中常见的强碱之一,其水溶液在实验室和工业生产中被广泛应用。
本文将从NaOH水溶液的密度出发,探讨其相关的性质、制备方法以及应用领域。
一、NaOH的基本性质NaOH,全称氢氧化钠,化学式为NaOH,是一种无机化合物。
NaOH是固体时,形成白色结晶,常温下为固体。
NaOH具有强碱性,可与酸反应,产生中和反应。
其水溶液呈碱性,能够与酸中和。
二、NaOH水溶液的密度NaOH水溶液的密度与其浓度有关。
一般情况下,NaOH水溶液的密度随着浓度的增加而增加。
在常温下,NaOH水溶液的密度约为1.02 g/cm³。
三、NaOH水溶液的制备方法制备NaOH水溶液的方法有多种,常见的方法包括以下几种:1. 固体法:将固体NaOH加入一定量的水中,搅拌溶解即可得到NaOH水溶液。
需要注意的是,在制备过程中要注意安全,避免溶液溅溢。
2. 稀释法:将浓度较高的NaOH水溶液逐渐加入一定量的水中,搅拌均匀即可得到所需浓度的NaOH水溶液。
3. 气相法:通过电解氯化钠溶液,产生氯气和氢气的同时,在阳极生成NaOH水溶液。
四、NaOH水溶液的应用领域由于NaOH水溶液具有强碱性,因此在实验室和工业生产中有着广泛的应用。
1. 实验室中,NaOH水溶液常用于中和实验、制备其他化合物等。
2. 工业上,NaOH水溶液广泛应用于纺织、造纸、皮革、化肥、玻璃等行业。
例如,在纺织行业中,NaOH水溶液可用于脱色、漂白、脱酸等工艺。
3. 医学领域,NaOH水溶液可用于清洗和消毒器械。
总结:本文从NaOH水溶液的密度出发,对NaOH的基本性质、制备方法以及应用领域进行了介绍。
NaOH水溶液是一种常见的强碱溶液,在实验室和工业生产中发挥着重要的作用。
希望通过本文的介绍,能够增加对NaOH水溶液的了解。

氢氧化钠溶解度是多少?氢氧化钠的性质
想要了解氢氧化钠的小伙伴快来瞧瞧吧!,下面由小编为你精心准备了“氢氧化钠溶解度是多少?氢氧化钠的性质”,持续关注本站将可以持续获取更多的考试资讯!
氢氧化钠溶解度是多少?氢氧化钠的性质
氢氧化钠溶解度
氢氧化钠在100g的水中的溶解度随温度升高而上升,氢氧化钠在0度水中的溶解度是42g,在10度水中的溶解度是51g,在20度水中的溶解度是51g,在30度水中的溶解度是119g,在100度水中的溶解度是347g。
氢氧化钠的性质
氢氧化钠有很强的吸湿性,易溶于水,具有强碱性,与金属铝和锌、非金属硼和硅等反应放出氢。
氢氧化钠的水溶液呈碱性,有滑腻感;腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。
氢氧化钠的应用
因为氢氧化钠具有强碱性,腐蚀性极强,因此可以用作显色剂、皂化剂、去皮剂、洗涤剂、合掩蔽剂、沉淀剂、沉淀掩蔽剂。
工业生产氢氧化钠的方法有苛化法和电解法两种。
苛化法按原料不同分为纯碱苛化法和天然碱苛化法;电解法可分为隔膜电解法和离子交换膜法。
氢氧化钠简介
氢氧化钠的化学式写为NaOH。
纯品是无色透明的晶体。
密度2.130g/cm³。
熔点318.4℃。
沸点1390℃。
工业品含有少量的氯化钠和碳酸钠,是白色不透明的晶体。
有块状,片状,粒状和棒状等。
式量39.997。
氢氧化钠在水处理中可作为碱性清洗剂,溶于乙醇和甘油;不溶于丙醇、乙醚。
与氯、溴、碘等卤素发生歧化反应。
与酸类起中和作用而生成盐和水。

6.下面的表格中列出了氢氧化钠在不同温度下的溶解度:
温度(℃)20 40 60 80
溶解度(g)85 138 203 285
请问:(1)在如图的甲、乙两条溶解度曲线中,其中表示氢氧化钠溶解度曲线的是甲.
(2)在20℃时,向100g水中加100g氢氧化钠,形成氢氧化钠的饱和(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为200g,该溶液中溶质与溶剂的质量比为1:1.
分析根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;由表格信息可知,氢氧化钠的溶解度受温度的影响变化比较大,因此曲线甲表示氢氧化钠的溶解度曲线;在20℃时,向100g水中加100g氢氧化钠,形成氢氧化钠的饱和溶液,因为在该温度下氢氧化钠的溶解度小于100g;将其温度升高至60℃时,溶液的质量为200g,并且是不饱和溶液;该溶液中溶质与溶剂的质量比=100g:100g=1:1.
解答解:(1)由表格信息可知,氢氧化钠的溶解度受温度的影响变化比较大,因此曲线甲表示氢氧化钠的溶解度曲线;故答案为:甲
(2)在20℃时,向100g水中加100g氢氧化钠,形成氢氧化钠的饱和溶液,因为在该温度下氢氧化钠的溶解度小于100g;将其温度升高至60℃时,溶液的质量为200g,并且是不饱和溶液;该溶液中溶质与溶剂的质量比=100g:100g=1:1;故答案为:饱和;200; 1:1;
点评本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.。
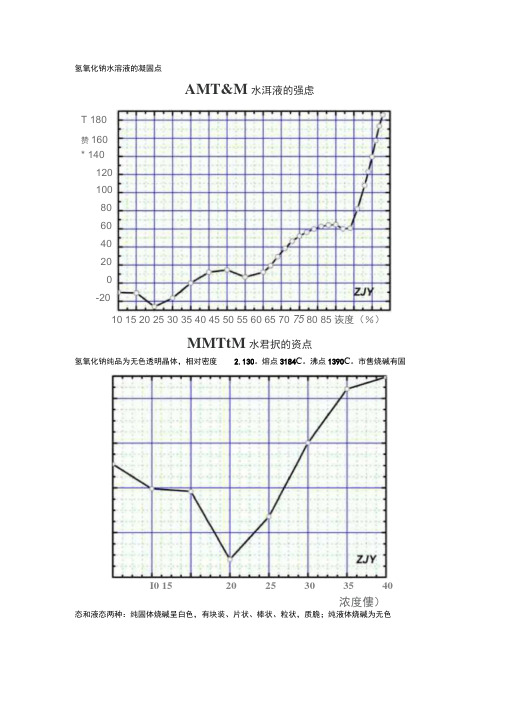
氢氧化钠水溶液的凝固点
AMT&M水洱液的强虑
T 180
赞160
* 140
120
100
80
60
40
20
-20
10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 诙度(%)
MMTtM水君択的资点
氢氧化钠纯品为无色透明晶体,相对密度 2.130。
熔点3184C。
沸点1390C。
市售烧碱有固
I0 15 20 25 30 35 40
浓度僂)
态和液态两种:纯固体烧碱呈白色,有块装、片状、棒状、粒状,质脆;纯液体烧碱为无色
透明液体。
固体烧碱有很强的吸湿性。
易溶于水,溶解时放热,水溶液呈碱性,有滑腻感;溶于乙醇和甘油;不溶于丙酮、乙醚。
腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。
与金属铝和锌、非金属硼和硅等反应放出氢;与氯、漠、碘等卤素发生歧化反应;与酸类起中和作用而生成盐和水。
30%配碱时的散热温度
在空气中,碱类溶液在配制过程中会发生热溶反应,释放出热量。
30%配碱时的散热温度取决于具体的碱物质和溶液的体积等因素。
以氢氧化钠(NaOH)为例,当配制30%的氢氧化钠溶液时,碱和溶剂(水)会发生剧烈的放热反应。
由于该过程是放热反应,散热温度会较高。
具体的散热温度可以通过实验测量获得。
实验操作中,通常会将水和碱物质慢慢混合,并同时测量溶液的温度变化。
通过观察变化过程和测量温度,可以得到散热温度的大致范围。
一般来说,30%氢氧化钠溶液的散热温度可能在80-100摄氏度左右。
但是具体数值还会受到实验条件和实验操作的影响,因此需要通过实际实验来确认。
同时,在操作过程中应注意安全,避免发生烫伤等事故。