最新11工作曲线法测定水中微量铁
- 格式:ppt
- 大小:929.50 KB
- 文档页数:12

水中微量铁的测定实验报告水中微量铁的测定实验报告摘要:本实验旨在通过分光光度法测定水中微量铁的含量。
首先,通过标准曲线法建立了铁离子的吸光度与浓度之间的关系。
然后,通过对未知水样的测定,得出了其铁离子的浓度为0.023 mg/L。
实验结果表明,分光光度法是一种简便、快速、准确的方法,适用于水中微量铁的测定。
引言:水是人类生活中不可或缺的资源,而水中微量金属离子的含量对水的质量有着重要的影响。
其中,铁是一种常见的微量金属离子,其含量的测定对于水质监测和环境保护具有重要意义。
本实验旨在通过分光光度法测定水中微量铁的含量,并探讨该方法的准确性和适用性。
实验方法:1. 准备工作:清洗实验器材,制备一系列不同浓度的标准溶液。
2. 建立标准曲线:将不同浓度的铁标准溶液分别置于分光光度计中,测定其吸光度,并记录下吸光度与浓度的对应关系。
3. 测定未知水样:将未知水样置于分光光度计中,测定其吸光度,并利用标准曲线计算出其铁离子的浓度。
实验结果:通过建立标准曲线,我们得到了铁离子的吸光度与浓度之间的线性关系。
利用该标准曲线,我们测定了未知水样的吸光度为0.345。
根据标准曲线的拟合方程,计算得出该未知水样中铁离子的浓度为0.023 mg/L。
讨论与分析:本实验采用的分光光度法是一种常用的分析方法,其原理是利用物质对特定波长光的吸收来测定其浓度。
通过建立标准曲线,我们可以根据待测样品的吸光度,推算出其浓度。
在实验过程中,我们注意到了一些实验误差的可能来源。
首先,实验中使用的试剂可能存在一定的误差。
其次,实验操作中的人为因素也可能对结果产生影响。
为了减小误差,我们在实验过程中进行了多次重复测定,并取平均值作为最终结果。
此外,本实验的结果还受到了水样的采集和保存条件的影响。
水样的采集应尽量避免污染,并在采集后尽快进行测定,以减小铁离子的损失和变化。
结论:通过本实验的测定,我们成功地利用分光光度法测定了水中微量铁的含量。

项目十一、使用分光光度计-绘制工作曲线及测定微量铁【概述】工作曲线法是目前实际生产中经常使用的一种定量分析方法,特别是在分光光度法的定量分析中,由于其操作方便、简单实用、对仪器的要求不高、测定结果准确度较高而成为最常用的分析方法。
因此,它是操作和使用分光光度计从事定量分析的工作人员必须掌握的一项专业技能。
经过此专项能力的培养,能使你熟悉和掌握工作曲线的绘制方法以及样品分析的各项步骤。
【学习途径】〖知识部分〗1.单组分定量分析的三种基本方法2.工作曲线法进行定量分析的基本原理及方法〖能力部分〗1.分光光度计的构造及使用方法2.正确配制铁标准溶液3.准确绘制工作曲线【评价标准】2h内完成配制标准系列显色溶液,分别测定其吸光度,绘制工作曲线,测定样品中微量铁含量。
【评定方法】〖应知自测〗当您通过学习后,应能熟练掌握本专项能力所需的知识要求,并能正确完成学习包中的自测题(也可根据指导教师要求进行测试)。
〖应会测试〗(操作考核)在您参加考试之前,应先检查自己是否完成了下列学习任务:复习与本专项能力相关的模块。
学习并掌握本专项能力所需的知识,并通过自测。
能熟练使用本专项能力所需的仪器、试剂、设备,并能完成规定的测试任务。
您认为已能达到本专项能力的培训要求,即可参加专项能力的技能操作考核,考核成绩由监考教师认定。
【工作曲线的意义和作用】当我们用分光光度法对某个样品进行定量测定时,工作曲线法通常是人们的首选方法。
首先我们要配制几个已知浓度的标准系列样品(与待测样品相同的物质),并在选定的温度、波长、溶剂、显色剂等条件下测定其吸光度,从而就可以得到若干组浓度与吸光度相对应的数据。
将这若干组数据在坐标纸上作图(一般总是以浓度为横坐标,以吸光度为纵坐标),我们就得到了一条曲线。
这条曲线所反映的就是浓度与吸光度的对应关系。
很显然,这条曲线上有无数个点,每一个点都对应一组数据。
对于需要测定的未知样品来说,只要在等同的条件下测得其吸光度,我们就能利用这条曲线迅速而准确地计算出待测样品的浓度或含量。


水中微量铁的测定实验报告水中微量铁的测定实验报告引言:水是人类生活中必不可少的资源,而水中微量铁的浓度对于水质的评估和处理具有重要意义。
本实验旨在通过一系列实验手段,测定水中微量铁的浓度,并探讨其对水质的影响。
实验材料和方法:1. 实验仪器:分光光度计、比色皿、移液管等。
2. 实验试剂:硫酸亚铁、硫酸铵、硝酸、硫酸、硫酸铵铁、硫酸铁、硫酸亚铁铵、硫酸铵铁(III)等。
实验步骤:1. 样品制备:收集不同来源的水样,使用滤纸过滤去除悬浮物,得到清澈的水样。
2. 铁离子还原:将水样加入硫酸亚铁溶液,使其中的三价铁离子还原为二价铁离子。
3. 铁离子络合:加入硫酸铵溶液,使铁离子与硫酸铵形成络合物,增加铁离子的稳定性。
4. 比色测定:将样品转移到比色皿中,使用分光光度计测定其吸光度。
根据比色试剂的吸光度与铁离子浓度的标准曲线,计算出水样中微量铁的浓度。
实验结果和讨论:通过实验,我们得到了不同来源水样中微量铁的浓度数据。
进一步分析发现,自然水源中的微量铁浓度普遍较低,而工业废水或受污染的水源中的微量铁浓度较高。
这说明微量铁的浓度与水源的质量密切相关,可以作为评估水质的重要指标之一。
此外,我们还发现不同水样中微量铁的浓度存在一定的差异。
这可能是由于水源的不同地质条件、水体的pH值、氧化还原环境等因素导致的。
因此,在评估水质时,应综合考虑这些因素,以准确判断水源的健康状况。
实验中使用的比色试剂是硫酸铵铁(III),它能与铁离子形成显色络合物。
通过测定比色试剂吸光度与铁离子浓度的标准曲线,我们可以准确地计算出水样中微量铁的浓度。
这种方法简单、快速,适用于大批量水样的测定。
然而,这种测定方法也存在一定的局限性。
首先,比色试剂的选择可能会影响测定结果的准确性。
其次,该方法只能测定水样中微量铁的总浓度,无法区分不同形态的铁离子,如铁离子的氧化态。
因此,在实际应用中,还需要结合其他分析手段,综合评估水质。
结论:通过本实验,我们成功测定了不同来源水样中微量铁的浓度,并探讨了其对水质的影响。

28天然水中都含有铁元素。
铁元素在水中的存在形式是多样的。
水磨沟水库作为阿拉善盟左旗重要的生活生产饮用水水源地之一,其水质品质的好坏直接关乎居民生活和生产用水的安全使用。
GB5749—2006生活饮用水标准中对铁含量的要求是不高于0.3mg/L.分光光度法测量水中微量铁的含量是一种常见的分析方法[1],也是一种比较使用和具有一定推广价值的方法。
1 实验仪器与试剂50ml容量瓶若干,722型分光光度计,1cm比色皿,10mL移液管2支,洗耳球,10mL量筒2支。
Fe 2+标准溶液(10.00μg/ml),乙酸铵缓冲溶液(pH4.2),邻菲啰啉溶液(0.15%),盐酸羟胺溶液(10%)。
样品水:采自水磨沟水库。
2 实验步骤2.1 用移液管分别依次加入0.00mL,1.00mL,2.00mL,4.00mL,6.00mL,8.00mL,10.00mL的标准Fe 2+溶液(10.00ug/ml)于7个50mL容量瓶中,另取50mL容量瓶一支,加入样品水3.00mL。
在上述标准溶液及样品中依次分别加入2.5mL盐酸羟胺溶液,5.00mL乙酸铵缓冲溶液2.5ml 邻菲啰啉溶液,定容至50ml,摇匀,静止待用。
2.2 在最大吸收波长510nm处[2],用1cm比色皿,在722型分光光度计上依次测定上述标准溶液的吸光度。
以吸光度为纵坐标,以浓度为横坐标,绘制标准曲线。
具体数值见表1及图1。
表1 Fe 2+标液体积与吸光度值样品编号1234567V Fe2+/ml 0.001 2.00 4.00 6.008.0010.00吸光度/A0.0000.0430.0760.1580.2410.3210.402图1 微量铁标准曲线由图可得,标准曲线方程y =0.0401x ,相关系数R 2=0.99992.3 在510nm处用相同的方法测定样品水的吸光度为0.006,由标准曲线计算式(y=0.0401x)计算出试样中微量铁的质量浓度为0.153mg/ml。


第1篇一、实验目的1. 熟悉火焰原子吸收分光光度法测定水样中铁的原理和操作方法。
2. 掌握水样中铁含量的测定方法,为水质监测提供技术支持。
二、实验原理火焰原子吸收分光光度法是一种基于原子吸收原理的定量分析方法。
该方法利用特定波长的光照射到含有被测元素的样品溶液上,当光通过溶液时,被测元素原子对特定波长的光产生吸收,根据吸光度的大小可以计算出样品中该元素的含量。
本实验采用标准曲线法测定水样中铁的含量。
首先,配制一系列已知浓度的铁标准溶液,在相同条件下测定其吸光度,绘制标准曲线。
然后,将待测水样进行处理,使其中的铁元素转化为可以被原子吸收的光谱线所吸收的形式,再测定其吸光度,根据标准曲线计算出待测水样中铁的含量。
三、实验仪器与试剂1. 仪器原子吸收分光光度计、空心阴极灯(铁空心阴极灯)、无油空气压缩机、乙炔钢瓶、通风设备、移液管、容量瓶、烧杯、玻璃棒、滴定管等。
2. 试剂金属铁(优级纯)、浓盐酸(优级纯)、浓硝酸(优级纯)、蒸馏水、铁标准贮备液(1000mg/L)、锰标准贮备液(1000mg/L)、铁、锰混合标准操作液(50.0mg/L 和25.0mg/L)、硝酸溶液(199)、磺基水杨酸、氨水、盐酸等。
四、实验步骤1. 标准曲线的绘制(1)配制一系列已知浓度的铁标准溶液,分别移取适量标准溶液于容量瓶中,用蒸馏水定容至刻度。
(2)将标准溶液依次倒入原子吸收分光光度计中,测定其吸光度。
(3)以铁的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 待测水样的处理(1)采集待测水样,置于烧杯中。
(2)加入适量的浓盐酸,煮沸溶解水样中的铁。
(3)待溶液冷却后,用玻璃棒搅拌均匀。
(4)用移液管移取适量处理后的水样于容量瓶中,用蒸馏水定容至刻度。
3. 待测水样中铁含量的测定(1)将待测水样倒入原子吸收分光光度计中,测定其吸光度。
(2)根据标准曲线,计算出待测水样中铁的含量。
五、实验结果与分析1. 标准曲线的绘制根据实验数据,绘制标准曲线,如图所示。

水中微量铁的测定实验报告一、实验目的1、掌握分光光度法测定水中微量铁的原理和方法。
2、学会使用分光光度计进行定量分析。
3、熟悉实验操作过程中的注意事项,提高实验技能和数据处理能力。
二、实验原理在 pH 值为 4~5 的条件下,二价铁离子与邻菲啰啉(1,10-二氮杂菲)反应生成橙红色的络合物,其吸光度与铁离子的浓度成正比。
通过测定络合物在 510nm 波长处的吸光度,可计算出水中微量铁的含量。
三、实验仪器与试剂1、仪器分光光度计容量瓶(50mL、100mL)移液管(1mL、5mL、10mL)比色皿烧杯(50mL、100mL)玻璃棒电子天平2、试剂硫酸亚铁铵(NH₄)₂Fe(SO₄)₂·6H₂O盐酸羟胺(NH₂OH·HCl)邻菲啰啉醋酸醋酸钠缓冲溶液(pH=45)1:1 盐酸溶液四、实验步骤1、标准溶液的配制准确称取 03507g 硫酸亚铁铵(NH₄)₂Fe(SO₄)₂·6H₂O于 100mL 烧杯中,加入 20mL 1:1 盐酸溶液溶解,转移至 100mL 容量瓶中,用蒸馏水定容至刻度,摇匀。
此溶液中含铁离子浓度为100μg/mL。
用移液管准确吸取上述溶液 1000mL 于 100mL 容量瓶中,用蒸馏水定容至刻度,摇匀。
此溶液中含铁离子浓度为100μg/mL。
2、标准曲线的绘制分别吸取 000、100、200、300、400、500mL 浓度为100μg/mL 的铁标准溶液于 50mL 容量瓶中。
依次向各容量瓶中加入1mL 10%盐酸羟胺溶液,摇匀,静置2min。
加入 2mL 01%邻菲啰啉溶液和 5mL 醋酸醋酸钠缓冲溶液,用蒸馏水定容至刻度,摇匀。
静置 10min。
以试剂空白(即 000mL 铁标准溶液)为参比,在 510nm 波长处,用 1cm 比色皿,测定各溶液的吸光度。
以铁离子的浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
3、水样的预处理若水样中含有氧化性物质(如氯),应先加入适量的盐酸羟胺溶液将其还原。

工作曲线法测定水中的铁思考题答案1.为什么以试剂为空白而不以蒸馏水作空白2.工作曲线法和标准对比法分别适用于何种情况?1、因为水和试剂间的析光度存在一定的差别。
为了尽可能的减小误差,我们以试剂为空白而不以蒸馏水作空白。
2、工作曲线法:适合大量样品的分析,因为可以十分便捷的从图上读数,但这种方法容易产生较大误差。
而标准对比法可以在实验要求精确度高的情况下使用。
1、原理在pH=9~11.5时,三价铁离子能与磺基水杨酸形成比聚磷酸铁络合物更为稳定的黄色络离子,以分光光度法测定铁离子含量。
2、仪器与试剂(1)磺基水杨酸:100g/L;(2)氨水:1+1;(3)浓硝酸;(4)分光光度计。
3、标准曲线的绘制(1)铁标准溶液:称取0.7020g硫酸亚铁铵,溶于50ml水中。
加20ml浓硫酸,转移入1L容量瓶中稀释至刻度,此溶液含亚铁离子为0.1mg。
用移液管吸此溶液10ml于100ml容量瓶中,用水稀释至刻度,得亚铁离子0.01mg/ml溶液。
(2)分别吸取0.0,0.5,1.0,1.5,2.0,3.0,4.0,5.0铁标准溶液(0.01mg/ml)于50m烧杯中,各加浓硝酸3滴,再加水15ml,加热煮沸约1分钟,冷却后转入50ml容量瓶中,加5ml10%磺基水杨酸,-5ml1+1氢氧化铵,以水稀释至刻度,用试剂空白溶液作对照,在分光光度计420nm波长处,3cm比色皿测定吸光度,以吸光度为纵坐标,铁离子含量为横坐标,绘制标准曲线。
4、操作步骤吸取25mL水样于50mL烧杯中,加浓硝酸6滴,加热煮沸10分钟,冷却后转入50mL容量瓶中,加5mL 100g/L磺基水杨酸,5mL 1+1氨水,以水稀释至刻度,用试剂空白溶液作对照,在分光光度计420nm波长处,用3cm比色皿测定吸光度。
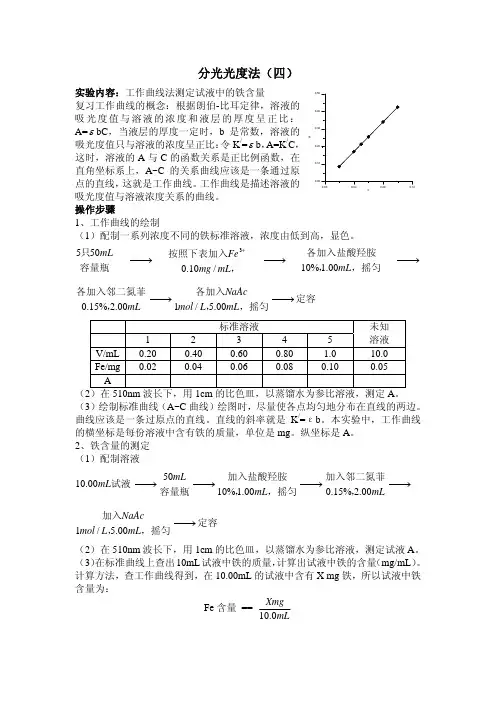
分光光度法(四)实验内容:工作曲线法测定试液中的铁含量复习工作曲线的概念:根据朗伯-比耳定律,溶液的吸光度值与溶液的浓度和液层的厚度呈正比:A=εbC ,当液层的厚度一定时,b 是常数,溶液的吸光度值只与溶液的浓度呈正比:令K /=εb ,A=K /C ,这时,溶液的A 与C 的函数关系是正比例函数,在直角坐标系上,A~C 的关系曲线应该是一条通过原点的直线,这就是工作曲线。
工作曲线是描述溶液的吸光度值与溶液浓度关系的曲线。
操作步骤1、工作曲线的绘制(1)配制一系列浓度不同的铁标准溶液,浓度由低到高,显色。
容量瓶只mL505⎯→⎯,按照下表加入mL mg Fe /10.03+⎯→⎯,摇匀,各加入盐酸羟胺mL 00.1%10⎯→⎯mL 00.2%15.0,各加入邻二氮菲⎯→⎯,摇匀,各加入mL L mol NaAc 00.5/1⎯→⎯定容 标准溶液 未知溶液 1 2 3 4 5V/mL 0.20 0.40 0.60 0.80 1.0 10.0 Fe/mg 0.02 0.04 0.06 0.08 0.10 0.05 A(2)在510nm 波长下,用1cm 的比色皿,以蒸馏水为参比溶液,测定A 。
(3)绘制标准曲线(A~C 曲线)绘图时,尽量使各点均匀地分布在直线的两边。
曲线应该是一条过原点的直线。
直线的斜率就是K /=εb 。
本实验中,工作曲线的横坐标是每份溶液中含有铁的质量,单位是mg 。
纵坐标是A 。
2、铁含量的测定(1)配制溶液试液mL 00.10⎯→⎯容量瓶mL50⎯→⎯,摇匀,加入盐酸羟胺mL 00.1%10⎯→⎯mL00.2%15.0,加入邻二氮菲⎯→⎯,摇匀,加入mL L mol NaAc 00.5/1⎯→⎯定容 (2)在510nm 波长下,用1cm 的比色皿,以蒸馏水为参比溶液,测定试液A 。
(3)在标准曲线上查出10mL 试液中铁的质量,计算出试液中铁的含量(mg/mL )。
计算方法,查工作曲线得到,在10.00mL 的试液中含有X mg 铁,所以试液中铁含量为:Fe 含量 == mLXmg 0.10cA。

11工作曲线法测定水中微量铁铁是一种极其重要的元素,它不仅对身体健康有极大的作用,对于水质也有着举足轻重的影响。
因此,对于水中微量铁的检测和分析也变得愈发重要。
工作曲线法是一种常见的测定水中微量元素浓度的方法,下文将介绍如何利用工作曲线法来测定水中微量铁。
1.实验基本原理工作曲线法的基本思路是,首先准备一系列已知浓度的标准溶液。
通过检测这些标准溶液的吸光度和浓度的关系,建立出一条标准曲线。
然后测定待检样品的吸光度,通过标准曲线可以算出待检样品的浓度。
在铁的测定中,我们将利用硫巴比妥酸(ferroin)对铁离子的选择性作用。
硫巴比妥酸在pH=1时呈黄色,随着pH值的升高到2.5时则变成带红色的铁络合物。
因此,当我们向含铁样品中加入硫巴比妥酸后,红色络合物的浓度与铁离子的浓度成正比关系。
2.实验步骤(1)制备标准溶液:分别取0.1mL、0.2mL、0.4mL、0.6mL、0.8mL和1.0mL的1.000mg/L标准铁溶液,加入10mL的去离子水中,定容至50mL。
这样就获得了浓度分别为0.02mg/L、0.04mg/L、0.08mg/L、0.12mg/L、0.16mg/L和0.20mg/L的标准溶液。
(2)准备样品:取一定量的待检水样,通过过滤和调节pH的方式,使其符合检测条件。
(3)测定吸光度:分别对标准溶液和待检样品进行测定,记录其吸光度值(需注意的是,由于转换为络合物后红色色度较深,因此需要选用波长较大的紫外可见分光光度计进行测定)。
(4)建立标准曲线:将上述各浓度的标准溶液分别测定吸光度,绘制出标准曲线(浓度为横坐标,吸光度为纵坐标)。
(5)测定待检样品浓度:通过待检样品的吸光度值,结合标准曲线,可以计算出待检样品中铁离子的浓度。
3.实验注意事项(1)实验中使用的各种仪器和试剂应尽量符合标准,并在使用之前进行必要的校准和检查。
(2)在铁的测定中,需要选用硫巴比妥酸及其盐酸盐的纯度较高的试剂。
微量铁的测定方法微量铁的测定,这可真是个有趣的事儿啊!你想想,那小小的微量铁,就像个调皮的小精灵,藏在各种物质里,得想办法把它给揪出来呢!咱先说最简单的一种方法,比色法。
就好像我们在一堆颜色里找特定的那一抹色彩一样。
把样品处理一下,加入一些特定的试剂,然后这微量铁就会和试剂发生反应,变出一种独特的颜色。
嘿,这时候你就可以通过和标准颜色进行比较,来确定铁的含量啦!是不是挺神奇的?就好像你能一眼看穿那小精灵躲在哪里一样。
还有原子吸收光谱法呢!这就像是给微量铁拍了一张超级清晰的“照片”。
用特定的光线去照射样品,铁原子会吸收特定波长的光,根据吸收的程度,就能知道铁有多少啦!这感觉就像是拿着个神奇的“相机”,一下子就把微量铁给抓住了。
分光光度法也不错呀!它就像是给微量铁穿上了一件特别的“衣服”,这件“衣服”会让它在特定的光线下闪闪发光,然后我们就能根据这光芒来判断它的存在和数量啦。
你说这微量铁的测定是不是很有意思?就像我们在玩一个找宝藏的游戏,只不过这个宝藏是小小的微量铁。
那我们怎么才能玩好这个游戏呢?首先得细心呀,不能放过任何一个细节。
然后要有耐心,可不能着急,慢慢去探索。
在实际操作中,可不能马虎哦!每一步都要认真对待,就像做饭一样,调料放错了或者火候不对,那味道可就差远啦!样品的处理要恰到好处,试剂的选择和使用要准确无误,这样才能得到准确的结果呀。
想想看,如果我们能准确地测定微量铁的含量,那能解决多少问题呀!比如在食品检测中,能确保我们吃的东西安全可靠;在环境监测中,能了解环境的状况。
这可不是小事儿呢!所以啊,大家可别小瞧了这微量铁的测定,它虽然小,但作用可大着呢!就像一颗小小的螺丝钉,看似不起眼,但在整个机器中却有着不可或缺的作用。
让我们都认真对待这个小小的微量铁吧,把它的秘密都给挖出来!让我们在这个探索微量铁的世界里,尽情享受发现的乐趣吧!原创不易,请尊重原创,谢谢!。
项目十一、使用分光光度计-绘制工作曲线及测定微量铁【概述】工作曲线法是目前实际生产中经常使用的一种定量分析方法,特别是在分光光度法的定量分析中,由于其操作方便、简单实用、对仪器的要求不高、测定结果准确度较高而成为最常用的分析方法。
因此,它是操作和使用分光光度计从事定量分析的工作人员必须掌握的一项专业技能。
经过此专项能力的培养,能使你熟悉和掌握工作曲线的绘制方法以及样品分析的各项步骤。
【学习途径】〖知识部分〗1.单组分定量分析的三种基本方法2.工作曲线法进行定量分析的基本原理及方法〖能力部分〗1.分光光度计的构造及使用方法2.正确配制铁标准溶液3.准确绘制工作曲线【评价标准】2h内完成配制标准系列显色溶液,分别测定其吸光度,绘制工作曲线,测定样品中微量铁含量。
【评定方法】〖应知自测〗当您通过学习后,应能熟练掌握本专项能力所需的知识要求,并能正确完成学习包中的自测题(也可根据指导教师要求进行测试)。
〖应会测试〗(操作考核)在您参加考试之前,应先检查自己是否完成了下列学习任务:复习与本专项能力相关的模块。
学习并掌握本专项能力所需的知识,并通过自测。
能熟练使用本专项能力所需的仪器、试剂、设备,并能完成规定的测试任务。
您认为已能达到本专项能力的培训要求,即可参加专项能力的技能操作考核,考核成绩由监考教师认定。
【工作曲线的意义和作用】当我们用分光光度法对某个样品进行定量测定时,工作曲线法通常是人们的首选方法。
首先我们要配制几个已知浓度的标准系列样品(与待测样品相同的物质),并在选定的温度、波长、溶剂、显色剂等条件下测定其吸光度,从而就可以得到若干组浓度与吸光度相对应的数据。
将这若干组数据在坐标纸上作图(一般总是以浓度为横坐标,以吸光度为纵坐标),我们就得到了一条曲线。
这条曲线所反映的就是浓度与吸光度的对应关系。
很显然,这条曲线上有无数个点,每一个点都对应一组数据。
对于需要测定的未知样品来说,只要在等同的条件下测得其吸光度,我们就能利用这条曲线迅速而准确地计算出待测样品的浓度或含量。
常州工程职业技术学院《仪器分析》教案紫外可见分光光度法单元技能训练 2工作曲线法测定水中微量铁学生进实验室后,先开机,并将仪器调试至正常工作状态。
问题n 目视比色法通过眼睛观察颜色进行分析测定,那如何精确地进行分析测定?可见分光光度法可见分光光度法是利用测量有色物质对某一单色光吸收程度来进行 测定的。
建立单组分样品的定量分析方法分析流程配制溶液,开机预热,波长校正与吸收池成套性检验,设定工作波长,选择波长, 测定。
问题水中微量铁,如何进行分光光度法的测定?显色条件、测量条件显色剂:邻二氮菲;盐酸羟胺:还原剂;醋酸钠溶液:缓冲溶 液;工作波长:510nm;参比溶液:试剂参比工作曲线法工作曲线法又称标准曲线法,它是实际工作中使用最多的一种定量方法。
工作曲线 的绘制方法是:配制四个以上浓度不同的待测组分的标准溶液,以空白溶液为参比溶液, 在选定的波长下,分别测定各标准溶液的吸光度。
以标准溶液浓度为横坐标,吸光度为 纵坐标,在坐标纸上绘制曲线。
在测定样品时,应按相同的方法制备待测试液(为了保证显色条件一致,操作时一 般是试样与标样同时显色),在相同测量条件下测量试液的吸光度,然后在工作曲线上 查出待测试液浓度。
为了保证测定准确度,要求标样与试样溶液的组成保持一致,待测 试液的浓度应在工作曲线线性范围内,最好在工作曲线中部。
y=a+bx 211 )( ))( ( x x y y x x b ini iini - - - =å å = =x b y nxb y a ini in i - = × - = å å = =112121)( ) ( y y x x b ini ini - - ×= å å = =g 学生实验操作准备工作,于6个洁净的50mL 比色管中,各加入10.00μg ·mL 1铁标准溶液0.00、 2.00、4.00、6.00、8.00、10.00mL ,1mL100 g ·L 1盐酸羟胺溶液,摇匀后再分别加入 2mL1.5 g ·L 1 邻二氮菲,5mL 醋酸钠溶液,用蒸馏水稀释至标线,摇匀。
第1篇一、实验目的1. 了解水中铁离子测定的原理和方法;2. 掌握使用邻菲罗啉分光光度法测定水中铁离子的操作步骤;3. 分析实验数据,得出水中铁离子的含量。
二、实验原理水中铁离子主要以Fe2+和Fe3+的形式存在,其中Fe2+为低价态,Fe3+为高价态。
邻菲罗啉分光光度法是一种测定微量铁离子的方法,其原理是亚铁离子(Fe2+)在pH3~9的条件下与邻菲罗啉生成稳定的橙红色络合物。
该络合物的吸光度与铁离子的浓度成正比,根据吸光度可以计算出水中铁离子的含量。
三、实验仪器与试剂1. 仪器:721型分光光度计、1cm比色皿、具塞比色管(50ml)、移液管、吸量管、容量瓶等;2. 试剂:铁贮备液(100g/mL)、铁标准使用液(20g/mL)、0.5%邻菲罗啉水溶液、盐酸、氢氧化钠、pH计等。
四、实验步骤1. 准备工作:将实验仪器和试剂准备好,调节分光光度计至波长510nm;2. 标准曲线绘制:准确移取一定量的铁标准使用液,加入适量盐酸和氢氧化钠,调节pH至3~9,再加入邻菲罗啉水溶液,混匀后静置5分钟,用分光光度计测定吸光度,以铁离子浓度为横坐标,吸光度为纵坐标绘制标准曲线;3. 水样测定:准确移取一定量的水样,加入适量盐酸和氢氧化钠,调节pH至3~9,再加入邻菲罗啉水溶液,混匀后静置5分钟,用分光光度计测定吸光度;4. 数据处理:根据标准曲线和测得的吸光度,计算水样中铁离子的含量。
五、实验结果与分析1. 标准曲线:绘制标准曲线,得到铁离子浓度与吸光度之间的关系;2. 水样测定:根据标准曲线和测得的吸光度,计算水样中铁离子的含量;3. 结果分析:分析实验数据,判断水中铁离子的含量是否符合国家标准。
六、实验结论通过本次实验,掌握了使用邻菲罗啉分光光度法测定水中铁离子的原理和操作步骤。
实验结果表明,该方法可以准确测定水中铁离子的含量,为水质监测提供了技术支持。
七、实验注意事项1. 操作过程中注意避免样品和试剂的污染;2. 严格控制实验条件,如pH值、温度等;3. 选用合适的仪器和试剂,保证实验结果的准确性;4. 实验数据应进行多次重复,以提高实验结果的可靠性。
一、实验目的1. 掌握分光光度法测定水中微量铁的原理和方法。
2. 熟悉邻菲啰啉分光光度法测定水中铁的实验步骤。
3. 学会使用分光光度计和绘制标准曲线。
4. 了解水中铁的存在形态及对水质的影响。
二、实验原理水中铁主要以二价铁(Fe2+)和三价铁(Fe3+)的形式存在。
在酸性条件下,二价铁与邻菲啰啉生成稳定的橙红色络合物,其吸光度与铁浓度成正比。
通过测定吸光度,可以计算出水中铁的浓度。
三、实验仪器与试剂1. 仪器:分光光度计、1cm比色皿、具塞比色管(50ml)、移液管、吸量管、容量瓶等。
2. 试剂:(1)铁贮备液(100g/mL):准确称取0.7020克分析纯硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O],加50毫升11 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为100.0g/mL。
(2)铁标准使用液(20g/mL):准确移取铁贮备液20.00ml于100ml容量瓶中,用水稀释至刻度,摇匀。
此溶液中Fe2的质量浓度为20.0g/mL。
(3)0.5%邻菲啰啉水溶液:配制时加适量无水乙醇,溶解后用水稀释至100mL。
(4)盐酸羟胺溶液:称取1g盐酸羟胺,加适量水溶解后,移入100mL容量瓶中,用水稀释至刻度,摇匀。
(5)盐酸溶液:浓盐酸,稀释至1mol/L。
四、实验步骤1. 标准曲线的绘制(1)取7支50ml具塞比色管,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0ml铁标准使用液,用水稀释至刻度,摇匀。
(2)向各比色管中加入1ml盐酸羟胺溶液,2ml邻菲啰啉溶液,混匀。
(3)室温下放置10分钟。
(4)以空白溶液为参比,用1cm比色皿在波长510nm处测定吸光度。
(5)以铁浓度(mg/L)为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 水样中铁的测定(1)取水样50ml于50ml具塞比色管中。
(2)按标准曲线绘制步骤,测定吸光度。