铜与浓硝酸反应溶液颜色探究
- 格式:ppt
- 大小:192.50 KB
- 文档页数:13

第2课时 硝酸课程标准课标解读1.掌握浓、稀硝酸的强氧化性,了解硝酸的重要用途。
2.通过比较浓硝酸与稀硝酸性质的差异,认识硝酸浓度对反应产物的影响。
1.通过硝酸中氮元素的化合价分析硝酸的化学性质。
(宏观辨识与微观探析)2.通过对实现现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力,提高学生的化学素养。
(证据推理与模型认知)3.能依据实验目的,设计并优化实验方案,对硝酸相关性质进行探讨。
(科学探究与创新意识)知识点01 硝酸1.物理性质硝酸是一种无色,易挥发,具有刺激性气味的液体。
能与水以任意比互溶。
2.化学性质(1)硝酸是一元强酸,具有酸的通性。
能使紫色的石蕊试液变红、与某些金属氧化物反应、与某些盐反应、与碱反应。
但硝酸与金属反应一般不产生H 2。
硝酸与CaCO 3反应的化学方程式为:CaCO 3+2HNO 3=Ca(NO 3)2+CO 2↑+H 2O 。
(2)不稳定性硝酸不稳定,见光或受热易分解,化学方程式为:4HNO 3========受热或光照2H 2O +4NO 2↑+O 2↑。
硝酸的保存方法:密封贮存在低温、避光处。
市售硝酸常因溶有少量NO 2略显黄色。
(3)【实验探究】硝酸的强氧化性 【实验1】铜与浓硝酸反应实验现象:试管中铜片溶解,有红棕色气体产生,溶液变蓝色,集气瓶中收集到无色气体。
实验结论:铜与浓硝酸反应生成了硝酸铜和NO 2气体。
【实验2】铜与稀硝酸反应目标导航知识精讲实验现象:试管中铜片溶解,有无色气体产生,溶液变蓝色,集气瓶中收集到无色气体。
实验结论:铜与浓硝酸反应生成了硝酸铜和NO 气体。
(4)硝酸的强氧化性硝酸是一种氧化性很强的酸,能与大多数金属(除Au 、Pt 等少数金属以外)、许多非金属以及有机物发生氧化还原反应。
①HNO 3与金属反应分别写出浓硝酸、稀硝酸分别与Cu 的反应方程式: Cu +4HNO 3(浓)===Cu(NO 3)2+2NO 2↑+2H 2O 3Cu +8HNO 3(稀)===3Cu(NO 3)2+2NO↑+4H 2O ②硝酸与非金属的反应写出C 与浓硝酸反应的方程式:C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O 。


铜与浓硝酸的化学反应方程式
今天我在学校做了一个好玩的实验!老师拿出了好多东西,其中就有一块铜和一瓶浓硝酸。
哇哦,好神奇啊,老师告诉我们这两样东西一加在一起就会发生化学反应哦!
老师先把铜块放进了浓硝酸里,哇——铜块好像一下子被吞进去了一样,冒起了好多黄色的烟雾,呲呲呲,真的好大声呀!我看到铜块渐渐变小了,颜色也变了,像是变成了溶液一样。
老师说,这就是铜与浓硝酸的反应,它会生成硝酸铜和氮的氧化物,还会释放出一些气体。
老师写下了反应方程式:
Cu+2HNO₃→Cu(NO₃)₂+H₂O+NO₂↑
我看得眼睛瞪得大大的,好像铜变魔术一样,变成了蓝蓝的溶液。
还闻到了一股怪怪的味道,呛得我有点咳嗽。
老师笑着说,这就是反应中释放的气体。
嘿嘿,好神奇呀!
虽然有点吓人,但我觉得这个实验真有趣!以后我一定要多学学化学,做更多有意思的实验!
—— 1 —1 —。


在上面的三组实验中提供的硝酸的体积均一样,仅仅是铜的质量不相同。
A组中,铜的质量相同,即反响后溶液中Cu2+的浓度相同,而浓硝酸反响后溶液为绿色,稀硝酸为蓝色;B组中,与浓硝酸反响的铜的质量要小一些,即反响后Cu2+浓度低一些,然而溶液仍然为绿色;C组中Cu2+的浓度大,溶液仍然是绿色。
可见,Cu(NO3)2溶液为绿色不是由Cu2+浓度引起的。
猜测二、可能是硝酸铜溶于浓硝酸引起的。
将Cu(NO3)2晶体溶于浓硝酸,溶液仍然为蓝色。
可见此假设不成立猜测三、可能是温度不同引起的方案1:将绿色的Cu(NO3)2溶液加热。
溶液仍然为绿色,且在试管中产生大量的红棕色气体。
原因是在加热的时候,浓硝酸不断的分解,致使NO2源源不断的生成,因此不可能将NO2和Cu(NO3)2分开,因此溶液仍为绿色。
方案2:将正在反响的试管壁不断地用流水冲,溶液颜色为蓝色。
这个改变的核心因素是降低温度。
因为Cu+4HNO3〔浓〕==Cu〔NO3〕2+2NO2+2H2O的反响是放热反响,降温反响速度减慢,产生的NO2减少;而2NO2==N2O4〔正反响为放热反响〕,因此降温平衡向右移动,生成无色的N2O4,NO2的量逐渐减少,故溶液很快变成蓝色。
猜测四、可能是NO2溶于Cu(NO3)2溶液形成的。
方案1:将Cu和浓硝酸反响后的溶液迅速倒入枯燥的烧杯中,再转移到另一个枯燥的烧杯中,溶液迅速变蓝。
方案2:在Cu和浓硝酸反响后的试管口上塞一团沾有NaOH溶液的棉花,放置半天后,溶液为蓝色。
其原因是随着时间的推移,反响后的溶液温度降低,NO2慢慢从溶液中逸出被棉花中的NaOH吸收,溶液的颜色仅仅由Cu(NO3)2呈现出来。
由此可见,Cu(NO3)2溶液的绿色是由蓝色的Cu(NO3)2溶液和黄色的HNO3溶液〔溶有NO2〕的两者混合而成的。
二、原型拓展1方案评价型[例1]某化学课外兴趣小组在做铜与浓硝酸、稀硝酸反响实验时发现:“相同质量的铜分别与等体积且足量的浓硝酸、稀硝酸充分反响后,前者溶液颜色是绿色的,后者溶液的颜色是蓝色的。

2021年第2期 (总第536期)H实验N 地“铜与浓硝酸孩应”创新实骝*张光良(徐州市铜山区大许中学江苏徐州221124)文章编号:1002-2201 (2021) 024X )564M中图分类号:G 633.8文献标识码:B化学实验是化学课程的重要特征之一,对于全面发 展学生的化学核心素养有着极为重要的作用。
化学实 验能够激发学习兴趣,启迪科学思维,训练科学方法,培 养科学态度,是化学教学中最重要的教学内容。
在化学实验操作过程中经常会产生有毒有害气体, 任意排放这些有毒气体会污染大气、影响人们的身心健 康。
如何有效处理实验中的有毒气体、实现尾气的绿色 化处理日益成为化学教育工作者的首要任务。
绿色化 实验就是借助新型的化学工业技术及化学基本原理,从 根本上杜绝或者降低制造及使用诸多对自然环境、社会 稳定与人类健康有害的物质[1]。
实现绿色化实验的措 施很多,对于不同实验需采用不同的处理策略。
化学实验中容易造成倒吸,操作者一般都会竭力避 免。
然而,某些实验恰恰可以利用倒吸原理,实现尾气的 绿色化处理。
铜与浓硝酸反应正是这样一个典型例子。
—、实验来源苏教版(2014年)《化学1》专题四第二单元生活中 的含氮化合物“硝酸的性质”中[观察与思考]图4 - 15 所示的实验装置(见图1),在教学过程中,发现该实验 存在以下几处不足:1. 不够严谨会使学生误解红棕色N 02气 体是反应生成的NO 与具支试管 内空气中氧气反应的产物。
2. 尾气处理不够绿色化产生有毒的N 02、N 0不能够图1教材实验装置完全绿色化处理,在具支试管和集气瓶内最终还残存 N 02、N 0 气体。
3. 缺乏可控性无法及时、有效地控制铜与浓硝酸的反应进程。
为了使实验更加严谨科学、绿色化、可控,进行了如 下创新设计。
二、实验用品药品:浓硝酸(10. 〇 m o l /L )、稀盐酸(1.0 m ol /L )、氢氧化钠溶液(2. 0 m o l /L )、铜条、碳酸钙(碎石子)。

铜与硝酸反应所得溶液呈绿色的实证研究摘要:在Cu与HNO3溶液反应体系中,当HNO3浓度较高时产物主要为NO2,浓度较低时产物主要为NO,实验认为Cu与浓HNO3反应后一般得到绿色溶液,但实验发现铜与稀HNO3作用时也能得到绿色溶液。
通过对绿色溶液组成的探究,发现Cu与HNO3溶液反应之所以会变绿色的主要原因是因为反应产物中存在HNO2或NO2-,同时提出中间产物HNO2可以认为Cu与硝酸反应的催化剂,Cu与HNO3反应是自催化的化学过程。
关键词:铜硝酸绿色溶液实验探究反应机理1 问题提出硝酸在一般情况下都能与Cu发生反应,其产物都有Cu(NO3)2溶液,理论上,Cu(NO3)2溶液由于存在Cu2+(aq)而呈蓝色,但Cu和浓HNO3反应后的溶液往往呈绿色,夏立先、吴思杰老等老师认为溶液显绿色是由Cu2+和NO2相互作用引起的[1],也有人认为是还原产物NO2溶解在Cu(NO3)2溶液中引起的[2]。
为了验证上述文献所述的结论,笔者做了以下实验。
[实验1]在有足量的铜丝的烧杯中滴加适量的浓HNO3后,发现反应剧烈、产生红棕色气体,溶液先变为蓝色,然后逐渐变为绿色,随着反应的进行,溶液最终又得到了蓝色溶液。
[结论]Cu和浓HNO3反应后的溶液的确有时呈绿色,但当得到的Cu(NO3)2溶液较大时,溶液转化为蓝色。
[实验2]取少量蓝色的Cu(NO3)2溶液于小烧杯中,往烧杯中不断通入NO2,发现蓝色的Cu(NO3)2溶液转化为绿色。
以上2个实验说明文献[1、2]的结论是正确的,但是当我们进行[实验3]时发现,Cu和稀硝酸反应也得到了绿色溶液。
[实验3]取50mL0.6mol/LHNO3和过量的铜丝置于250mL的烧瓶中,在铜丝与硝酸混合后几小时内几乎无明显现象,而后溶液逐渐变为浅蓝色,再变为蓝色,反应3天多时间后溶液为绿色。
假如上述文献的结论是正确的,那么铜丝与0.6mol/L稀HNO3反应最终是不会得到绿色溶液呢,因为Cu 与稀HNO3反应的还原产物是NO而不是NO2。
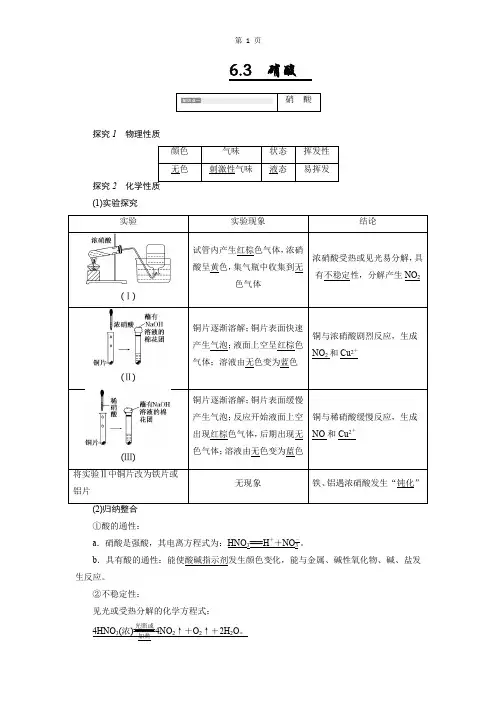
6.3 硝酸探究1 物理性质探究2 (1)实验探究(Ⅰ)试管内产生红棕色气体,酸呈黄色,(Ⅱ)铜片逐渐溶解;产生气泡;气体;溶液由无色变为蓝色(Ⅲ)铜片逐渐溶解;产生气泡;出现红棕色气体,色气体;将实验Ⅱ中铜片改为铁片或①酸的通性:a .硝酸是强酸,其电离方程式为:HNO 3===H ++NO -3。
b .具有酸的通性:能使酸碱指示剂发生颜色变化,能与金属、碱性氧化物、碱、盐发生反应。
②不稳定性:见光或受热分解的化学方程式: 4HNO 3(浓)=====光照或加热4NO 2↑+O 2↑+2H 2O 。
③强氧化性:[必记结论](1)纯硝酸为无色液体,由于HNO3分解产生的NO2又溶于其中,浓硝酸一般呈黄色;质量分数为95%以上的硝酸为发烟硝酸。
(2)硝酸具有强氧化性,除Pt、Au之外,硝酸几乎能与所有金属反应,硝酸与金属反应不产生H2。
(3)常温下,Fe、Al遇浓硝酸钝化是在金属表面形成一层致密的氧化膜,阻止反应进一步进行,并非不反应。
(4)硝酸与金属反应一般显酸性和氧化性;与非金属反应一般显示氧化性。
(5)用棕色细口玻璃瓶保存硝酸,不能用橡胶塞,原因是硝酸腐蚀橡胶。
[成功体验]1.将浓HNO3与下列“物质(或方法)”的“反应情况”和“表现性质”用短线连接。
解析:浓HNO3具有酸性能使指示剂变色,并能氧化指示剂。
浓HNO3具有强氧化性,常温下使Fe、Al钝化,与Cu反应生成Cu(NO3)2,与非金属C加热生成CO2气体,但不能与Pt、Au反应。
在加热或见光时易分解。
答案:①-c-Ⅲ,②-d-Ⅱ、Ⅲ③-b-Ⅱ、Ⅲ,④-f-Ⅰ⑤-a,⑥-e-Ⅲ探究1 含氮物质的来源及其危害(1)pH <5.6的雨水称为酸雨:酸雨分硫酸型和硝酸型,我国酸雨类型为硫酸型,主要原因是大量含硫化石燃料的燃烧造成的。
(2)“赤潮”和“水华”均是水体富营养化造成污染的结果。
探究2 减少人类活动对氮循环和环境的影响措施 (1)控制进入大气、陆地和海洋的有害物质的数量。

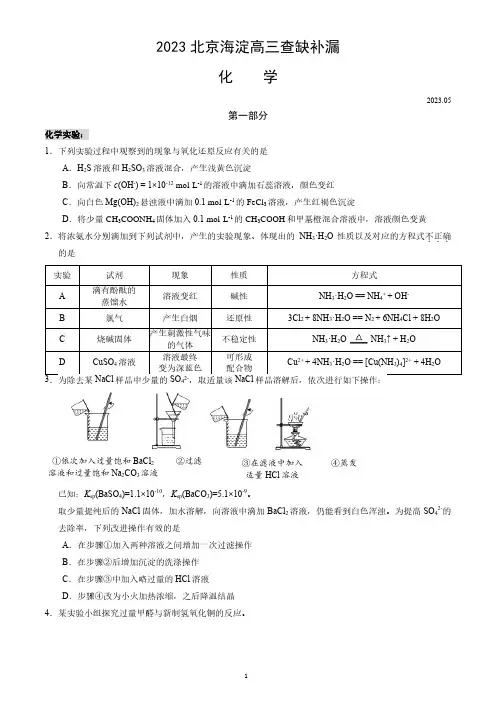
2023北京海淀高三查缺补漏化 学2023.05第一部分化学实验:1.下列实验过程中观察到的现象与氧化还原反应有关的是A .H 2S 溶液和H 2SO 3溶液混合,产生浅黄色沉淀B .向常温下c (OH -) = 1×10-12 mol·L -1的溶液中滴加石蕊溶液,颜色变红C .向白色Mg(OH)2悬浊液中滴加0.1 mol·L -1的FeCl 3溶液,产生红褐色沉淀D .将少量CH 3COONH 4固体加入0.1 mol·L -1的CH 3COOH 和甲基橙混合溶液中,溶液颜色变黄 2.将浓氨水分别滴加到下列试剂中,产生的实验现象、体现出的NH 3·H 2O 性质以及对应的方程式不正确...的是O已知:K sp (BaSO 4)=1.1×10-10,K sp (BaCO 3)=5.1×10-9。
取少量提纯后的NaCl 固体,加水溶解,向溶液中滴加BaCl 2溶液,仍能看到白色浑浊。
为提高SO 42-的去除率,下列改进操作有效的是A .在步骤①加入两种溶液之间增加一次过滤操作B .在步骤②后增加沉淀的洗涤操作C .在步骤③中加入略过量的HCl 溶液D .步骤④改为小火加热浓缩,之后降温结晶 4.某实验小组探究过量甲醛与新制氢氧化铜的反应。
①依次加入过量饱和BaCl 2溶液和过量饱和Na 2CO 3溶液 ②过滤③在滤液中加入适量HCl 溶液④蒸发提出猜想:HCHO + Cu(OH)2Cu + CO↑ + 2H 2O已知:ⅰ.CO + 2Ag(NH 3)2OH === 2Ag↓+ (NH 4)2CO 3 + 2NH 3ⅱ.Cu 2O + H 2SO 4 === Cu + CuSO 4 + H 2O实验步骤实验装置及内容实验现象 步骤1反应结束后,A 中生成红色固体,C 无明显变化步骤2将A 中混合物过滤,洗涤所得固体,取少量固体于试管中,加入稀硫酸,振荡无明显现象步骤3 取步骤2中的滤液于试管中,加入足量稀盐酸 无明显现象 下列说法不正确...的是 A .配制银氨溶液时,应向稀AgNO 3溶液中加入稀氨水,至产生的沉淀恰好溶解 B .装置B 的主要作用是除去挥发的甲酸,防止干扰CO 的检验 C .步骤3目的是检验反应后溶液中是否存在CO 32-D .该实验中,过量甲醛与新制氢氧化铜可能发生的反应为:HCHO + Cu(OH)2 + NaOH Cu↓ + HCOONa + 2H 2O 有机化学:5.肾上腺素具有提高心脏收缩力、扩张气管的功能,其结构如图所示。
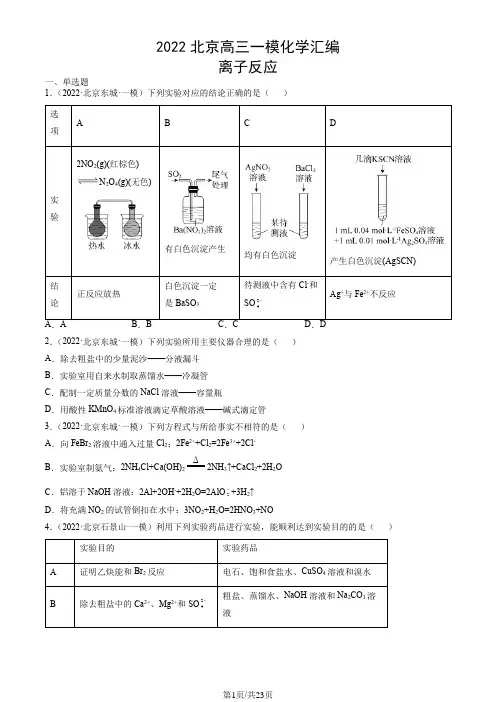
2022北京高三一模化学汇编离子反应一、单选题1.(2022·北京东城·一模)下列实验对应的结论正确的是()选项A B C D实验2NO 2(g)(红棕色)N2O4(g)(无色)有白色沉淀产生均有白色沉淀产生白色沉淀(AgSCN)结论正反应放热白色沉淀一定是BaSO3待测液中含有Cl-和SO24-Ag+与Fe2+不反应2.(2022·北京东城·一模)下列实验所用主要仪器合理的是()A.除去粗盐中的少量泥沙——分液漏斗B.实验室用自来水制取蒸馏水——冷凝管C.配制一定质量分数的NaCl溶液——容量瓶D.用酸性KMnO4标准溶液滴定草酸溶液——碱式滴定管3.(2022·北京东城·一模)下列方程式与所给事实不相符的是()A.向FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-B.实验室制氨气:2NH4Cl+Ca(OH)2Δ2NH3↑+CaCl2+2H2OC.铝溶于NaOH溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑D.将充满NO2的试管倒扣在水中:3NO2+H2O=2HNO3+NO4.(2022·北京石景山·一模)利用下列实验药品进行实验,能顺利达到实验目的的是()实验目的实验药品A证明乙炔能和Br2反应电石、饱和食盐水、CuSO4溶液和溴水B除去粗盐中的Ca2+、Mg2+和SO24-粗盐、蒸馏水、NaOH溶液和Na2CO3溶液C 检验溴乙烷中的溴原子 溴乙烷、NaOH 溶液和AgNO 3溶液D 验证乙醇消去产物有乙烯乙醇、浓硫酸和溴水 5.(2022·北京朝阳·一模)下列做法或实验(图中部分夹持略),不能达到目的的是( ) 防止铁管道被腐蚀检验产生的2SO制备并收集3NH精炼粗铜A B CD6.(2022·北京石景山·一模)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )气体 试剂 制备装置收集方法A NO Cu+稀HNO 3 b cB NH 3 NH 4Cla d C O 2 过氧化氢溶液+MnO 2b e D Cl 2MnO 2+浓盐酸 b c7.(2022·北京海淀·一模)实验小组用双指示剂法准确测定NaOH 样品(杂质为23Na CO )的纯度。
铜与浓硝酸离子方程式1. 简介铜与浓硝酸之间的反应是一种常见的实验现象,也是化学学习中的基础实验之一。
铜是一种常见的金属元素,而浓硝酸是一种常用的强氧化剂。
当铜与浓硝酸发生反应时,会产生一系列有趣的化学变化,并伴随着明显的观察结果,这为我们研究化学反应提供了实验基础。
2. 浓硝酸的性质在讨论铜与浓硝酸的反应之前,我们先来了解一下浓硝酸的性质。
浓硝酸化学式为HNO₃,是一种无色液体,具有强氧化性。
浓硝酸分子内包含一个氢离子(H+)和一个硝酸根离子(NO₃-)。
硝酸根离子本身具有较高的氧化能力,而浓硝酸中的氢离子则会加剧其氧化性能。
浓硝酸能够与多种物质反应,其中与金属元素的反应是一种常见的反应类型。
浓硝酸能够氧化金属元素,并形成相应的金属离子。
3. 铜与浓硝酸的反应铜与浓硝酸发生反应,会有明显的观察结果。
实验中我们通常会将铜片放入浓硝酸溶液中,并观察其反应过程。
步骤:1.取一块铜片(Cu);2.将铜片放入装有浓硝酸(HNO₃)的容器中;3.观察铜与浓硝酸的反应。
4. 观察结果在反应过程中,我们会观察到以下现象:1.浓硝酸逐渐变为淡黄色;2.瓶口上会产生红褐色的气体,并伴有强烈刺激性的刺鼻气味。
这些观察结果表明铜与浓硝酸发生了反应,产生了新的物质,并释放出气体。
5. 反应方程式根据观察结果,我们可以推测铜与浓硝酸的反应方程式如下:Cu + 4HNO₃ → Cu(NO₃)₂ + 2NO₂↑ + 2H₂O在这个方程式中,Cu代表铜,HNO₃代表浓硝酸,Cu(NO₃)₂代表硝酸铜,NO₂代表二氧化氮,↑表示气体的产生,H₂O表示水的生成。
根据这个方程式,铜与浓硝酸反应生成了硝酸铜和二氧化氮,并伴随着气体的产生。
6. 反应机理铜与浓硝酸的反应过程涉及多个步骤。
下面是一个可能的反应机理:步骤1:浓硝酸中的氢离子(H+)与铜表面的金属铜反应,生成铜离子(Cu2+)和氢气(H₂):2H^+ + Cu → Cu^2+ + H₂步骤2:铜离子(Cu2+)与硝酸根离子(NO₃-)发生反应,生成硝酸铜(Cu(NO₃)₂):Cu^2+ + 2NO₃^- → Cu(NO₃)₂步骤3:硝酸根离子(NO₃-)与未完全氧化的硝酸根离子(NO₃-),形成二氧化氮(NO₂):2NO₃^- → 2NO₂ + O₂步骤4:反应中产生的氢气和未反应的硝酸则可以反应生成水和二氧化氮:3H₂ + 2NO₃⁻ → 4H₂O + 2NO₂以上步骤综合起来,就是铜与浓硝酸的反应机理。
铜与浓硫酸反应的各种现象及其原因答铜逐渐溶解,有气泡生成,产生的气体能使紫色石蕊变红或品红溶液褪色.溶液冷却后稀释呈蓝色.说明:实际铜与浓硫酸反应现象非常复杂,至今学术界仍在讨论.对于中学生来说,掌握上面叙述就完全可以了.如果感兴趣,可以阅读下面内容(警告:对高考来说全无用处)铜与浓硫酸反应实验现象的探究与分析[摘要]铜与浓硫酸共热反应因两者的量不同,反应时的最终现象不同。
若浓硫酸过量时,主要现象有:铜表面先变黑,形成黑色浊液,随后又变成白色浊液。
铜全部反应完后,静置,灰白色物质沉于管底,所得溶液呈淡蓝色,冷却至室温呈无色。
反应中还伴有白色烟雾,并有淡黄色物质冷凝在管壁。
若铜过量,最终得灰白色固体物质。
由此说明铜与浓硫酸共热的反应是很复杂的,且反应后所得溶液颜色随温度变化而变化。
[关键词] 铜浓硫酸共热反应现象原因高一新教材P131页关于铜与浓硫酸反应的实验叙述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。
说明铜与浓硫酸反应时被氧化为Cu2+”。
然而该实验的现象并非这么简单,且实验有两种情况:一种情况是浓硫酸过量。
用下列“实验装置图1”(固定仪器和加热酒精灯均未画出)来完成此实验。
其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。
随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。
在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。
在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢消失了。
此间导气管导出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。
当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。
cu与浓硝酸反应溶液呈绿色加热后消失的原因cu与浓硝酸反应溶液呈绿色加热后消失的原因1. 引言cu与浓硝酸反应溶液呈绿色加热后消失,这是一种现象,背后隐藏着许多有趣和复杂的化学反应机制。
本文将从深度和广度的角度探讨cu 与浓硝酸反应溶液呈绿色加热后消失的原因,帮助读者全面理解与更深入地认识这个主题。
2. cu与浓硝酸的反应机制当cu与浓硝酸反应时,会产生一种绿色的溶液。
这个绿色溶液是由铜离子(Cu2+)和氧化亚氮离子(NO2-)所组成的混合物。
即使是普通的家用浓硝酸,也能起到氧化剂的作用,将cu氧化为cu2+。
3. 绿色溶液的变化在最初的反应中,形成的绿色溶液在室温下是稳定的。
然而,当加热这种溶液时,绿色色素会逐渐消失。
这是因为加热会导致一系列的反应,其中最主要的是NO2逐渐分解为一氧化氮(NO)和二氧化氮(NO2)。
而NO2气体通常是红棕色的,不会像刚开始时的绿色溶液那样产生明显的颜色。
4. 反应机理的详细分析在加热过程中,NO2逐渐分解为NO和NO2,这是一个可逆反应,其反应方程式如下:2NO2 ⇌ 2NO + O2当绿色溶液不断加热时,反应达到平衡会产生大量的NO2气体,而这些气体随着升温逐渐离开溶液,使观察到的颜色逐渐减弱。
此时溶液逐渐恢复到无色或呈淡黄色。
5. 综述和回顾通过 cu与浓硝酸反应溶液呈绿色加热后消失的原因的探讨,我们可以得出以下结论:- 初始时,cu与浓硝酸的反应会生成绿色溶液,其中包含铜离子(Cu2+)和氧化亚氮离子(NO2-)。
- 当加热绿色溶液时,NO2会分解成一氧化氮(NO)和二氧化氮(NO2),这是一个可逆反应。
- 随着升温,NO2气体会逐渐离开溶液,使绿色溶液的颜色逐渐变淡,最终消失。
6. 个人观点和理解对于这个现象,我个人认为,cu与浓硝酸反应溶液呈绿色加热后消失,涉及到许多复杂的化学反应机制和平衡动态。
这个现象本身虽然简单,但是通过我们对反应机理的深入探讨,我们可以发现其中的许多细节和有趣之处。
铜和浓硝酸反应方程当铜与浓硝酸反应时,会发生以下化学反应:1. 反应方程式:Cu + 4HNO3 →Cu(NO3)2 + 2NO2 + 2H2O2. 解释:在反应中,铜(Cu)与浓硝酸(HNO3)发生氧化还原反应。
铜原子失去两个电子,从Cu的0价被氧化为Cu2+离子的2价。
而硝酸(HNO3)则被还原,其中的氮氧化物(NO3)接受铜原子失去的电子,并形成两个一价的氮氧化物(NO2)分子。
同时,水(H2O)也是反应的产物之一。
3. 反应过程:当浓硝酸加入铜片时,铜的表面会迅速出现气泡,并有大量的红棕色气体产生。
这些气泡是由于反应产生的二氧化氮(NO2)气体。
同时,溶液中会出现蓝绿色的铜离子(Cu2+)和硝酸根离子(NO3-)。
反应过程中会有大量的热能释放,溶液也会变热。
4. 反应原理:这个反应是因为铜在浓硝酸中具有较强的还原性,而硝酸则具有较强的氧化性。
铜可以被硝酸氧化为铜离子(Cu2+),同时还原剂的角色由硝酸中的氮氧化物(NO3)充当。
硝酸中的氮氧化物从二价被还原为一价,形成二氧化氮(NO2)气体的分子。
5. 安全注意事项:由于反应产生的二氧化氮是有毒的气体,刺激性较大,因此在进行这个实验时,应该在通风良好的实验室环境中进行,并戴上适当的防护装备,如护目镜和实验手套,以确保安全。
总结:铜与浓硝酸反应会产生铜离子、二氧化氮和水的化学反应。
铜被氧化为Cu2+离子,硝酸中的氮氧化物被还原为二氧化氮气体。
这个反应是一种氧化还原反应,其中硝酸充当了氧化剂的角色,而铜则是还原剂。
在进行这个实验时要注意安全,避免二氧化氮的毒性影响。
实验12 铜与浓硫酸、硝酸的反应1.下列现象或事实可用同一原理解释的是()A.浓硫酸和浓盐酸长期暴露在空气中浓度降低B.氯水和活性炭使红墨水褪色C.铁片和铝片置于冷的浓硫酸中均无明显现象D.二氧化硫和过氧化钠使品红褪色【答案】C【解析】A.浓硫酸具有吸水性,浓度降低是因溶剂增多,而浓盐酸易挥发浓度减小是因溶质减少,原因不同,A错误;B.氯水中HClO具有强氧化性使红墨水褪色,而活性炭具有吸附性使红墨水褪色,原理不同,B错误;C.铁片和铝片置于冷的浓硫酸中均无明显现象,均是因为发生了钝化,原理相同,C正确;D.过氧化钠具有强氧化性,能使品红褪色,二氧化硫能使品红溶液褪色,发生的是非氧化还原反应,原理不相同,D错。
答案选C。
2.有关铜与浓硫酸的反应下列说法错误的是()A.该反应中氧化剂与还原剂物质的量之比为1∶1B.浓硫酸在反应中既体现出氧化性,又体现出酸性C.标准状况下,lmol铜和2mol浓硫酸充分反应可得22.4L气体D.1mol铜和足量浓硫酸反应,转移电子个数为2N A【答案】C【解析】A .铜与浓硫酸反应的化学方程式为:Cu +2H 2SO 4(浓)===△CuSO 4+SO 2↑+2H 2O ,由化学方程式可知,Cu 元素的化合价从0价升高到+2价,Cu 为还原剂,S 元素的化合价一部分从+6价降低到+4价,一部分化合价不变,浓硫酸为氧化剂,氧化剂与还原剂的物质的量之比为1∶1,故A 正确;B .由化学方程式可知,浓硫酸与铜反应生成硫酸铜和二氧化硫,生成硫酸铜体现了浓硫酸的酸性,生成二氧化硫体现了浓硫酸的氧化性,故B 正确;C .lmol 铜和2mol 浓硫酸充分反应,随着反应的进行,浓硫酸变成稀硫酸,反应停止,铜和硫酸均不能完全反应,则产生的气体在标准状况下小于22.4L ,故C 错误;D .Cu 元素的化合价从0价升高到+2价,1mol 铜和足量浓硫酸反应,转移电子2mol ,转移电子个数为2N A ,故D 正确;答案选C 。
蓝色铜离子和绿色铜离子
通常,铜离子Cu2+在水溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色。
而在氯化铜的溶液中,不仅有水合铜离子[Cu(H2O)4]2+,还有氯离子Cl-与铜离子结合形成的四氯合铜络离子[CuCl4]2-,该离子的颜色为黄色。
根据光学原理我们知道,蓝色和黄色的混合色为绿色,这就是为什么我们常见的一般浓度的氯化铜溶液呈绿色的原因。
如果我们向氯化铜溶液中加水,则溶液中氯离子浓度变小,水合铜离子相对增多,溶液主要呈现水合铜离子的颜色(蓝色)。
所以我们见到的氯化铜稀溶液一般呈蓝色。
同样道理,在硝酸跟铜的反应中,稀硝酸与铜反应所得的溶液呈蓝色,而浓硝酸与铜反应所得溶液呈绿色。
这是因为,浓硝酸与铜反应时,产生大量的二氧化氮气体,二氧化氮溶解在溶液中呈黄色,二氧化氮的黄色跟水合铜离子的蓝色混合就出现了我们看到的绿色。