第6章 前线分子轨道理论
- 格式:ppt
- 大小:275.00 KB
- 文档页数:9

分子轨道理论的发展及其应用0 前言化学键是化学学科领域中最为重要的概念之一。
通常,化学键被定义为存在于分子或晶体中或两个或多个原子间的,导致形成相对稳定的分子或晶体的强相互作用。
从二十世纪初期至今,科学家们为了解释化学键现象相继提出了价键理论、分子轨道理论、配位场理论等化学键理论。
其中分子轨道理论(Molecular Orbital Theory)具有容易计算、计算结果得到实验支持的优势,并不断得到完善与拓展,因而自二十世纪五十年代以来,已经逐渐确立了其主导地位。
目前,作为相对最为成熟的化学键理论,分子轨道理论的应用已经涵盖了化学研究的几乎全部领域中。
1 分子轨道理论发展1926至1932年,Mulliken和Hund分别对分子中的电子状态进行分类,得出选择分子中电子量子数的规律,提出了分子轨道理论-。
分子轨道理论认为,电子是在整个分子中运动,而不是定域化的。
他们还提出了能级相关图和成键、反键轨道等重要概念。
1929年,Lennard-Jones提出原子轨道线性组合(Linear Combination of Atomic Orbitals)的理论。
后来,原子轨道线性组合的思想被应用于分子轨道理论中,成为分子轨道理论的基本原理。
这一原理指出,原子轨道波函数通过线性组合,即各乘以某一系数相加得到分子轨道波函数。
这种组合要遵循三个基本原则,即:组合成分子轨道的原子轨道必须对称性匹配;组成分子轨道的原子轨道须能级相近;原子轨道达到最大程度重叠以降低组成分子轨道的能量。
其中,最重要的是对称性匹配原则,对称性相同的原子轨道组合成能量低于自身的成键分子轨道,对称性相反的原子轨道组合成高于自身的反键分子轨道。
1931-1933年,Huckel提出了一种计算简便的分子轨道理论(HMO),是分子轨道理论的重大进展。
HMO理论的基本思想是,把两电子间的相互作用近似地当做单电子的平均位场模型处理,导出单电子运动方程:Hψ=Eψ 其中H是该电子的Hamilton算符,ψ是该电子所占据的分子轨道波函数,E为轨道能量。


什么是前线轨道理论前线轨道理论是一种分子轨道理论,由日本理论化学家福井谦一于1951年提出。
这一理论将分子周围分布的电子云根据能量细分为不同能级的分子轨道,认为有电子排布的能量最高的分子轨道(即最高占据轨道HOMO)和没有被电子占据的能量最低的分子轨道(即最低未占轨道LUMO)是决定一个体系发生化学反应的关键,其他能量的分子轨道对于化学反应虽然有影响但是影响很小,可以暂时忽略。
HOMO和LUMO便是所谓前线轨道。
前线轨道理论研究分子在化学反应过程中的机理,认为分子中这种前线轨道类似于原子中的价轨道,对于分子的化学性质起决定性作用。
分子进行化学反应时,只和前线轨道有关,反应的条件和方式取决于前线轨道的对称性。
前线轨道理论提出后,首先被伍德沃德和霍夫曼用于对协同反应规律的解释,即分子轨道对称守恒原理中。
这一原理在解释双分子反应时认为,电子从一个分子的最高被占据轨道流向另一个分子的最低空轨道,使旧键断裂新键生成。
因此,最高被占据轨道和最低空轨道必须满足对称性匹配原则,才能产生净的有效重叠,否则过渡状态能量太高,反应不能进行。
同时相互作用的最高被占据轨道和最低空轨道应该满足能量相近原则,能量差不得大于6eV。
利用前线轨道理论,还可以很好地解释有机协同反应选律等。
例如,应用前线轨道理论可以很好地说明烯烃的亲电加成方向问题和碳基的亲核加成问题。
前线轨道理论认为烯烃的亲电加成中,烯烃的HOMO 和试剂的LUMO是起决定性作用的分子轨道。
作为亲电试剂的质子应加到烯烃HOMO系数最大的碳原子上。
当烯烃的双键碳上连有供电基时,供基电基具有的高能级的被占轨道,其能量与烯烃轨道能量相近,他们之间可发生相互作用,使究轨道发生极化。
以上信息仅供参考,如需了解更多信息,建议查阅相关书籍或咨询专业人士。


第章前线分子轨道理论什么是分子轨道理论分子轨道理论是描述分子内电子构型的一种理论。
在化学中,原子的价电子构型决定了化学反应和化学性质,而分子的电子构型又是决定分子性质和反应的关键因素。
因此,分析和理解分子的电子构型具有重要意义。
分子轨道理论通过将原子轨道合并形成分子轨道的方式来描述分子的电子构型。
在分子轨道理论中,分子中所有原子的原子轨道合并为一系列分子轨道,每个分子轨道可以容纳一对电子。
前线分子轨道理论前线分子轨道理论是分子轨道理论的一个重要分支。
在前线分子轨道理论中,我们关注的是分子中最外层的电子。
这些电子决定了分子的化学性质和反应活性。
因此,对于化学反应和分子中的电荷转移来说,前线分子轨道理论具有重要意义。
前线分子轨道理论中,我们通常关注两个参数:能量和对称性。
在分子中,前线分子轨道由接近原子核的、能级较低的σ轨道和能级较高的π轨道组成。
由于能量较低的σ轨道电子最相互靠近原子核,因此它们的相互作用能最大。
同时,它们的能量比较低,因此对于分子中电荷转移反应最具有反应性。
分子轨道理论的应用分子轨道理论具有广泛的应用。
在设计新的材料和药物时,分子轨道理论可以帮助我们预测分子的反应性和性能。
在催化剂的设计中,分子轨道理论可以帮助我们理解催化反应的机制和选择最适合的催化剂。
分子轨道理论还可以帮助我们理解一些化学现象。
如何在实验室中制备高能量化合物、如何控制分子中重要反应的速率和选择性和如何设计更有效的催化剂,都是分子轨道理论研究领域。
此外,分子轨道理论还可以在设计新型化学反应和控制分子反应中的选择性方面发挥重要的作用。
第章前线分子轨道理论是分子轨道理论中的重要分支,它可以帮助我们理解分子中最外层电子的性质和化学反应的机理。
分子轨道理论在新材料和药物的设计、催化剂的研究、化学反应的加速和选择性控制等方面都具有广泛的应用前景。



分子轨道理论简介我们把原子通过共用电子对结合的化学键成为共价键(covalent bond)。
路易斯(G.N.Lewis)曾经提出原子共用电子对成键的概念,也就是俗称的“八隅律”(高中阶段也只是停留于此)然而,我们知道很多现实情况都无法用八隅率解释,包括:PCl5,SCl6分子。
更重要的是,八隅率从来没有本质上说明共价键的成因:为什么带负电荷的两个分子不会排斥反而是互相配对?随着近代的量子力学(quantum mechanics)的建立,近代形成了两种现代共价键理论,即是:现代价键理(valence bond theory)简称VB(又叫作电子配对法)以及分子轨道理论(molecular orbital theory)简称MO。
价键理论强调了电子对键和成键电子的离域,有了明确的键的概念。
也成功的给出了一些键的性质以及分子结构的直观图像。
但是在解释H2+氢分子离子的单电子键的存在以及氧分子等有顺磁性或者大∏键的某些分子结构时感到困难。
而分子轨道理论可以完美的进行解释,这里我就主要阐述MO法的相关理论。
洪特(Hund)和密里肯(R.S Mulliken)等人提出了新的化学键理论,即是分子轨道理论。
这是人们利用量子力学处理氢分子离子而发展起来的。
(一)氢分子离子的成键理论氢分子离子(H2+)是由两个核以及一个电子组成的最简单分子,虽然不稳定,但是确实存在。
如何从理论上说明氢分子离子的形成呢?分子轨道理论把氢分子离子作为一个整体处理,认为电子是在两个氢核a和b组成的势场当中运动。
电子运动的轨道既不局限在氢核a的周围,也不会局限于氢核b的周围,而是遍及氢核a和b。
这种遍及分子所有核的周围的电子轨道,成为“分子轨道”。
如何形成这样的分子轨道呢?我们必须通过波函数来描述原子当中的运动状态,而波函数是薛定谔方程的解。
因为得到精确的薛定谔方程的解很困难,因此我们才取了近似方法,假设分子轨道是各个原子轨道的组成。
仍然以氢分子离子为例:当这个单电子出现了一个氢原子核a附近时候,分子轨道Ψ很近似于一个院子轨道Ψa。


结构化学论⽂---分⼦轨道理论结构论⽂分⼦轨道理论的发展及其应⽤2011111510xxxx⼀、前⾔价建理论、分⼦轨道理论和配位场理论是三种重要的化学键理论。
三、四⼗年代,价键理论占主要的地位。
五⼗年代以来由于分⼦轨道理论容易计算且得到实验(光电能谱)的⽀持,取得了巨⼤的发展,逐渐占优势。
价建理论不但在理论化学上有重要的意义(下⽂中将详细介绍)。
在应⽤领域也有重要的发展,如分⼦轨道理论计算有机化合物的吸收光谱⽤于染料化学;前线分⼦轨道理论在选矿中的研究等等。
⼆、简介1、分⼦轨道理论产⽣和发展在分⼦轨道理论出现以前,价键理论着眼于成键原⼦间最外层轨道中未成对的电⼦在形成化学键时的贡献,能成功地解释了共价分⼦的空间构型,因⽽得到了⼴泛的应⽤。
但如能考虑成键原⼦的内层电⼦在成键时贡献,显然更符合成键的实际情况。
1932年,美国化学家 Mulliken RS和德国化学家HundF 提出了⼀种新的共价键理论——分⼦轨道理论(molecular orbital theory),即MO法。
该理论注意了分⼦的整体性,因此较好地说明了多原⼦分⼦的结构。
⽬前,该理论在现代共价键理论中占有很重要的地位。
以下是各个年代提出的关于分⼦轨道理论的⼀些重要理论和⽅法,是分⼦轨道理论发展过程中的⼏个⾥程碑!1926-1932年,在讨论分⼦光谱时,Mulliken和Hund提出了分⼦轨道理论。
认为:电⼦是在整个分⼦轨道中运动,不是定域化的。
他们还提出能级图、成键、反键轨道等重要的概念。
1931-1933年,Hukel提出了⼀种简单的分⼦轨道理论,⽤于讨论共轭分⼦的性质,相当成功。
1950年,Boys⽤Guass函数研究原⼦轨道,解决了多中⼼积分问题,是今天⼴为利⽤的⾃洽场分⼦轨道理论的基础,在量⼦化学的研究中占有重要地位。
1951年,Roothaan在Hartree-Fock⽅程的基础上,把分⼦轨道写成原⼦轨道的线性组合,得到Roothaan⽅程。
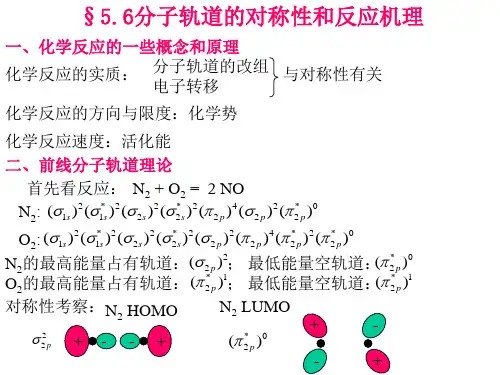
前线分子轨道理论HOMO及LUMO的画法HOMO:分子轨道中的最高已占轨道,顾名思义,这轨道里面是有电子的。
LUMO:分子轨道中的最低空轨道,这里面没有填充电子,在所有的空轨道中是能量最低的。
如何画出发生周环反应的分子的HOMO以及LUMO呢。
以乙烯为例:
1、要知道乙烯分子中的π电子数:π=2
2、有几个π电子,会组合成相应的轨道数。
故,这里会有两个轨道。
节点分别为1和0;节点数越高能量越大。
第一个轨道,在该轨道中可看到,两个P电子肩并肩重叠可形成π键,两P电子的波相相同。
第二个轨道,在该轨道中,两个P电子波相相反,中间存在节面,不能成键。
第一个轨道,是成键轨道中能量最高的,即我们所谓的HOMO。
第二个轨道,即最低未占轨道,LUMO(需要指出的是,上面虽然画出了两个P 电子,但在这里仅仅是用于指出该轨道中的两个电子应该存在的状态如此,并非指此时里面就有两个电子)
如果用电子来表示,就是这样:
在画此类轨道图时,把握住一个原则,即轨道数从1往上,其节点数从0开始增加。
如上图,第一个轨道无节点,第二个轨道有一个节点,如果有第三个轨道,则有2个节点,以此类推。
根据此原则,我们也可以画出1,3-丁二烯的π电子分子轨道位相图,如下:
遵循波粒二象性中的粒子质量守恒原子轨道个数=分子轨道个数
第二个轨道为HOMO,第三个轨道为LUMO。
前线轨道理论及其应用摘要:前线轨道理论是一种简化且有效的分子轨道理论。
它能成功地说明大量反应事实和规律。
本文综合了数篇文献的研究内容,介绍前线轨道理论及其应用情况。
关键词:前线轨道理论; 应用1.前言前线轨道理论是由福井谦一教授于五十年代初提出的一种化学理论,它以分子轨道理论为理论基础,但是没有超越实验化学家的经验和理论范围,以其简单、有效和化学概念明确的特点,赢得了众多科学工作者的关注。
本文综合了数篇文献的研究内容,将2.理论思想早在1952年福井[1]就在HMO理论的基础上提出了最高占据轨道(highest occupied MO)、最低空轨道(lowest unoccupied MO)的概念。
并称HOMO, LUMO 这两种特殊的分子轨道为“前线轨道”[2]。
考虑到在化学反应中原子的价电子起着关键作用,可以联想到,在分子的所有MO中,能量最高的HOMO上的电子最活泼最易失去;能量最低的LUMO最易接受电子。
因此,有理由认为在分子反应中,这些特殊的MO贡献最大,对反应起主导作用。
这一概念和观点,起初只引起了极少数人的注意。
但是福井等人却注意到了这一点,并且进行了深入的研究。
他们将“前线轨道及各种前线轨道间的相互作用”发展成为了解分子反应能力和预测反应机理的强有力的理沦方法—“前线轨道理论”,35年来前线轨道理论大致经过了七个重要发展阶段[3]。
前线电子密度基本概念的提出和研究;前线电子密度在共轭化合物中应用的研究;在饱和化合物中应用的研究;在立体选择反应中推广应用的研究;解释,说明化学反应中的HOMO-LUMO的相互作用;建立化学反应途径的极限反应坐标理论(简称IRC);提出化学反应的相互作用前线轨道理论(简称IFO)。
今天,这一理论已成为讨论化学问题的必不可少的工具,对于人们的化学实践具有重要的指导意义。
3.前线轨道理论分子中的轨道根据电子填充情况不同可分为被占轨道,空轨道和半占轨道[4]。
分子前线轨道分布和能量1.引言1.1 概述概述部分的内容可以包括以下内容:概述部分旨在介绍读者对于分子前线轨道分布和能量的基本概念和背景知识。
本篇文章将着重讨论分子前线轨道分布和能量的相关性,并探讨它们在化学领域中的重要性。
分子前线轨道是指在分子结构中位于最高占据轨道和最低未占据轨道之间的一对轨道。
这些轨道在化学反应和分子间相互作用中起着关键作用。
分子前线轨道的分布可以通过计算化学方法进行模拟和分析。
在本文中,我们将讨论不同分子的前线轨道分布,并探讨它们对于分子性质和反应性的影响。
能量分布是指分子中不同电子轨道的能量分布情况。
电子轨道的能量分布决定了分子中电子的分布和行为。
在分子前线轨道中,能量分布对于分子的化学性质和反应机制具有重要影响。
我们将通过分析不同分子的能量分布来深入研究分子的性质和行为。
本篇文章的目的是通过分析分子前线轨道分布和能量分布来揭示它们之间的关联,并探讨它们对于分子性质和反应性的影响。
我们将通过实例和计算化学方法来支持我们的观点,并提供进一步研究的方向和意义。
通过阅读本文,读者将获得对分子前线轨道分布和能量的基本认识,并了解它们在化学研究中的重要性。
我们相信本文的内容将对于化学领域的研究人员和学生有所帮助,并促进分子结构和性质的理解和应用。
1.2 文章结构文章结构:文章主要分为引言、正文和结论三个部分。
1. 引言部分主要是对分子前线轨道分布和能量分布的研究进行了一个概括和介绍。
首先,明确了研究的背景和意义,指出了分子前线轨道分布和能量分布在化学和材料科学等领域的重要性。
其次,简要概述了该领域的研究现状和存在的问题。
最后,明确了本文的目的和文章的结构安排。
2. 正文部分分为两个小节,分别详细介绍了分子前线轨道分布和能量分布的相关内容。
2.1 分子前线轨道分布部分主要探讨了分子中前线轨道的分布特点和影响因素。
首先,介绍了分子前线轨道的概念和意义。
然后,解释了分子轨道的形成原理和分布规律。