四化学键理论与分子几何构型
- 格式:doc
- 大小:558.00 KB
- 文档页数:8

化学键与分子结构化学键理论简介一、原子间相互作用力原子是由带电粒子组成的,我们预计原子间相互作用力大多是静电相互作用,主要取决于两个方面,一是原子的带电状态(中性原子或离子),二是原子的电子结构,按原子最外价电子层全满状态(闭壳层)或未满状态(开壳层)来分类。
闭壳层包括中性原子,如稀有气体He、Ne、Kr……,及具有稀有气体闭壳层结构的离子如Li+、Na+、Mg2+、F-、Cl-等。
开壳层则包括大多数中性原子,如H、Na、Mg、C、F 等。
显然,闭壳层原子(或离子)与开壳层原子之间相互作用很不相同。
原子间相互作用大致可分为以下几类:(1)两个闭壳层的中性原子,例如He-He,它们之间是van der Waals(范德华)引力作用。
(2)两个开壳层的中性原子,例如H-H,它们之间靠共用电子对结合称为“共价键”。
(3)一个闭壳层的正离子与一个闭壳层的负离子,例如Na+-C l-,它们之间是静电相互作用,称之为“离子键”。
(4)一个开壳层离子(一般是正离子)与多个闭壳层离子(或分子),例如过渡金属配合物M n+(X-)m,它们之间形成配位键(属共价键范围)。
(5)许多金属原子聚集在一起,最外层价电子脱离核的束缚,在整个金属固体内运动——金属键。
讨论这些成键原理的理论称化学键理论。
二、化学键理论从二十世纪初发展至今,化学键理论已形成三大流派:分子轨道理论(Molecular Orbital)、价键理论(V alence Bond)和密度泛函理论(Density Functional Theory)。
1.分子轨道理论:分子轨道理论(MO)要点:(1)分子轨道采用原子轨道线性组合(LCAO),例如CH4分子,C原子有1s,2s,2p等5个轨道,加上4个H原子1s轨道,共有9个原子轨道,可组合成9个分子轨道。
( 其中为分子轨道,为原子轨道)(2)分子中每个电子看作是在核与其它电子组成的平均势场中运动,每个电子在整个分子中运动——称为单电子近似。


![化学原理[4]化学键与分子结构-2](https://uimg.taocdn.com/2b692b22c77da26924c5b049.webp)


中学化学竞赛总训练四、化学键理论与分子几何构型1.NO的生物活性已引起科学家高度重视,它与O2-反应,生成A。
在生理pH条件下,A的t1/2= 1~2秒。
⑴写出A的可能的Lewis结构式,标出形式电荷。
推断它们的稳定性。
⑵A与水中的CO2快速一对一地结合,试写出此物种可能的路易斯结构式,表示出形式电荷,推断其稳定性。
⑶含Cu+的酶可把NO2-转化为NO,写出此反应方程式。
⑷在固定器皿中,把NO压缩到100atm,发觉气体压强快速降至略小于原压强的2/3,写出反应方程式,并说明为什么最终的气体总压略小于原压的2/3。
2.试画出N5+离子的Lewis全部可能结构式,标出形式电荷,探讨各自稳定性,写出各氮原子之间的键级。
你认为N5+的性质如何?它应在什么溶剂中制得。
3.在地球的电离层中,可能存在下列离子:ArCl+、OF+、NO+、PS+、SCl+。
请你预料哪一种离子最稳定?哪一种离子最不稳定?说明理由。
4.硼与氮形成类似苯的化合物,俗称无机苯。
它是无色液体,具有芳香性。
⑴写出其分子式,画出其结构式并标出形式电荷。
⑵写出无机苯与HCl发生加成反应的方程式⑶无机苯的三甲基取代物遇水会发生水解反应,试推断各种取代物的水解方程式,并以此推断取代物可能的结构式。
⑷硼氮化合物可形成二元固体聚合物,指出这种聚合物的可能结构,并说明是否具有导电性。
⑸画出Ca2(B5O9)Cl·2H2O中聚硼阴离子单元的结构示意图,指明阴离子单元的电荷与硼的哪种结构式有关。
5.用VSEPR理论推断下列物种的中心原子实行何种杂化类型,指出可能的几何构型。
(1)IF3(2)ClO3-(3)AsCl3(CF3)2(4)SnCl2(5)TeCl4(6)GaF63-170℃ 6.试从结构及化学键角度回答下列问题:一氧化碳、二氧化碳、甲醛、甲酸等分子(1)画出各分子的立体构型,并标明各原子间成键状况(σ、π、Πmn ) (2)估计分子中碳—氧键的键长改变规律7.近期报导了用二聚三甲基铝[Al(CH 3)3]2 (A)和2, 6 —二异丙基苯胺(B)为原料,通过两步反应,得到一种环铝氮烷的衍生物(D): 第一步:A + 2B === C + 2CH 4其次步:□C □D + □CH 4 (□中填入适当系数)请回答下列问题:(1)分别写出两步反应配平的化学方程式(A 、B 、C 、D 要用结构简式表示 (2)写出D 的结构式(3)设在第一步反应中,A 与过量B 完全反应,产物中的甲烷又全部挥发,对反应后的混合物进行元素分析,得到其质量分数如下:C (碳):73.71%,N (氮):6.34% 试求混合物中B 和C 的质量分数(%)(已知相对原子量:Al :26.98、C :12.01、N :14.01、H :1.01)8.四氨合铜(II)离子在微酸性条件下,与二氧化硫反应生成一种沉淀物(A),该沉淀物中Cu:N:S (原子个数比)=1:1:1,结构分析证明:存在一种正四面体和一种三角锥型的分子或离子,呈逆磁性。
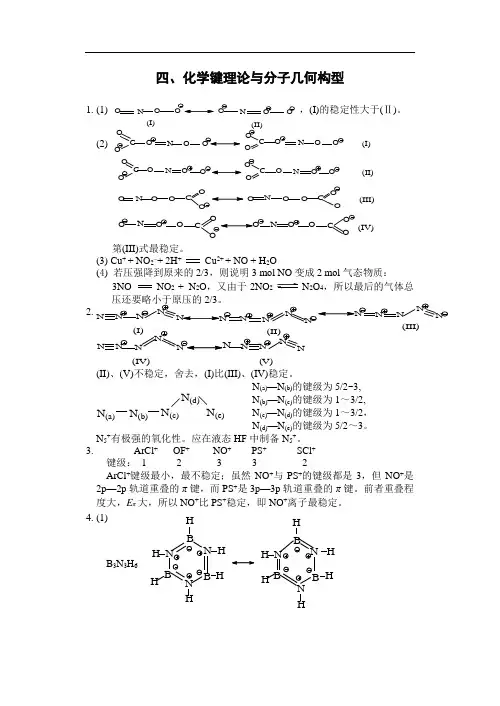
四、化学键理论与分子几何构型1. (1),(I)的稳定性大于(Ⅱ)。
(2)C OOO N O C OO O N O O (I)O C OO N OOCOO ONOO(II)O N O O CO OO NOOC O O (III)ONOOC ON OOCO O(IV)第(III)式最稳定。
(3) Cu + + NO 2–+ 2H + Cu 2+ + NO + H 2O(4) 若压强降到原来的2/3,则说明3 mol NO 变成2 mol 气态物质:3NO NO 2 + N 2O ,又由于2NO 2N 2O 4,所以最后的气体总压还要略小于原压的2/3。
2. N NN N NNNN N(IV)(V)(II)、(V)不稳定,舍去,(I)比(III)、(IV)稳定。
N (a)N (b)N (c)N (d)N (e) N (a)—N (b)的键级为5/2~3,N (b)—N (c)的键级为1~3/2,N (c)—N (d)的键级为1~3/2,N (d)—N (e)的键级为5/2~3。
N 5+有极强的氧化性。
应在液态HF 中制备N 5+。
3. ArCl + OF + NO + PS + SCl + 键级: 1 2 3 3 2ArCl +键级最小,最不稳定;虽然NO +与PS +的键级都是3,但NO +是2p —2p 轨道重叠的π键,而PS +是3p —3p 轨道重叠的π键。
前者重叠程度大,E π大,所以NO +比PS +稳定,即NO +离子最稳定。
4. (1)B 3N 3H 6N H H H H H N B N B B H H H H H H NB B H N BNO N O O O N O O (I)(II)N N N N N N N N N N (I)(II)N N N N N(III)(2) HH HH H H Cl HH H ClClB 3N 3H 6 3HCl N N N B BB(3) 无机苯的三甲基取代物有:B N B N B N HHHCH 3H 3CCH 3B NB N B N CH 3CH 3H 3CH HHB B N B N CH 3HHHCH 3CH 3(I)(Ⅱ)(III)B N B N B N CH 3HCH 3HCH 3H B N B N B N CH 3H H CH 3HH 3CB NB N B N CH 3H 3CH 3HH(IV) (V) (Ⅵ)实际上只有四种类型,因为II 、IV ;IV 、VI 属于同类型中的几何异构体。




知识探究: 化学键和分子结构Chemical Bonds and Structures of Molecules这一章是化学的核心,因为结构决定性质。
如白磷、红磷的结构不同,性质也不同;石墨、金刚石和C 60等的结构不同,性质也不同。
这一章重点讲授共价键、离子键、金属键以及分子几何构型、金属晶体、原子晶体和离子晶体的晶体结构。
另外我们也讨论分子间的作用力以及对分子晶体的一些性质的影响。
共价键与分子几何构型Covalent Bonds and Molecular Geometric Structure*(要求了解)一、经典共价键理论(Classical Covalent Bond Theory ) − LewisStructure (Octet Rule)(八电子规则)1.基本思想:当n s 、n p 原子轨道充满电子,会成为八电子构型,该电子构型是稳定的,所以在共价分子中,每个原子都希望成为八电子构型(H 原子为2电子构型)。
2.共价分子中成键数和孤电子对数的计算:例如:P 4S 3、HN 3、N +5、H 2CN 2(重氮甲烷)、NO -3 (1) 计算步骤:a .令n o − 共价分子中,所有原子形成八电子构型(H 为2电子构型)所需要的电子总数b .令n v − 共价分子中,所有原子的价电子数总和c .令n s − 共价分子中,所有原子之间共享电子总数 n s = n o - n v ,n s /2 = (n o - n v ) / 2 = 成键电子对数d .令n l − 共价分子中,存在的孤电子数。
(或称未成键电子数)3.Lewis 结构式的书写P 4S 3HN 3HN N N H N N HNNNN 5+,,,N N NNNNNN NNNNNN N N NCH 2N 2(重氮甲烷) ,HCHNN HC HN N当Lewis 结构式不只一种形式时,如何来判断这些Lewis 结构式的稳定性呢?如HN 3可以写出三种可能的Lewis 结构式,5N +可以写出四种可能的Lewis 结构式,而重氮甲烷只能写出两种可能的Lewis 结构式。
170℃四、化学键理论与分子几何构型1. NO 的生物活性已引起科学家高度重视,它与O 2-反应,生成A 。
在生理pH 条件下,A 的t 1/2= 1~2秒。
(1) 写出A 的可能的Lewis 结构式,标出形式电荷。
判断它们的稳定性。
(2) A 与水中的CO 2迅速一对一地结合,试写出此物种可能的路易斯结构式,表示出形式电荷,判断其稳定性。
(3) 含Cu +的酶可把NO 2-转化为NO ,写出此反应方程式。
(4) 在固定器皿中,把NO 压缩到100atm ,发现气体压强迅速降至略小于原压强的2/3,写出反应方程式,并解释为什么最后的气体总压略小于原压的2/3。
2. 试画出N 5+离子的Lewis 所有可能结构式,标出形式电荷,讨论各自稳定性,写出各氮原子之间的键级。
你认为N 5+的性质如何?它应在什么溶剂中制得。
3. 在地球的电离层中,可能存在下列离子:ArCl +、OF +、NO +、PS +、SCl +。
请你预测哪一种离子最稳定?哪一种离子最不稳定?说明理由。
4. 硼与氮形成类似苯的化合物,俗称无机苯。
它是无色液体,具有芳香性。
(1) 写出其分子式,画出其结构式并标出形式电荷。
(2) 写出无机苯与HCl 发生加成反应的方程式(3) 无机苯的三甲基取代物遇水会发生水解反应,试判断各种取代物的水解方程式,并以此判断取代物可能的结构式。
(4) 硼氮化合物可形成二元固体聚合物,指出这种聚合物的可能结构,并说明是否具有导电性。
(5) 画出Ca 2(B 5O 9)Cl·2H 2O 中聚硼阴离子单元的结构示意图,指明阴离子单元的电荷与硼的哪种结构式有关。
5. 用VSEPR 理论判断下列物种的中心原子采取何种杂化类型,指出可能的几何构型。
(1)IF 3 (2)ClO 3-(3)AsCl 3(CF 3)2 (4)SnCl 2 (5)TeCl 4 (6)GaF 63-6. 试从结构及化学键角度回答下列问题:一氧化碳、二氧化碳、甲醛、甲酸等分子(1) 画出各分子的立体构型,并标明各原子间成键情况(σ、π、Πmn ) (2) 估计分子中碳—氧键的键长变化规律7. 近期报导了用二聚三甲基铝[Al(CH 3)3]2 (A)和2, 6 —二异丙基苯胺(B)为原料,通过两步反应,得到一种环铝氮烷的衍生物(D): 第一步:A + 2B === C + 2CH 4第二步:□C □D + □CH 4 (□中填入适当系数)请回答下列问题: (1) 分别写出两步反应配平的化学方程式(A 、B 、C 、D 要用结构简式表示 (2) 写出D 的结构式(3) 设在第一步反应中,A 与过量B 完全反应,产物中的甲烷又全部挥发,对反应后的混合物进行元素分析,得到其质量分数如下:C (碳):73.71% ,N (氮):6.34%试求混合物中B和C的质量分数(%)(已知相对原子量:Al:26.98、C:12.01、N:14.01、H:1.01)8.四氨合铜(II)离子在微酸性条件下,与二氧化硫反应生成一种沉淀物(A),该沉淀物中Cu:N:S(原子个数比)=1:1:1,结构分析证实:存在一种正四面体和一种三角锥型的分子或离子,呈逆磁性。
分子的构造与化学键的角度理论分子的构造和化学键的角度理论是化学中关于分子结构的重要理论之一。
通过研究分子的构造和分子中各个原子之间的联系,人们可以更好地理解分子的行为和性质。
本文将就分子的构造以及化学键的角度理论展开论述。
一、分子的构造分子的构造是指分子中原子排列的方式和原子之间的相互作用。
理解分子的构造有助于解释分子的性质和反应行为。
从分子结构的角度考虑,分子可以分为线性分子、非线性分子和平面分子。
1. 线性分子线性分子是指分子中原子按照直线排列的分子。
典型的例子是二氧化碳(CO2)分子,其中碳原子与两个氧原子连接,形成线性分子结构。
线性分子通常具有较高的极性,易于形成离子化合物。
2. 非线性分子非线性分子是指分子中原子按照曲线或不规则的方式排列的分子。
典型的例子是水(H2O)分子,其中两个氢原子连接到一个氧原子上,形成非线性分子结构。
非线性分子通常具有较低的极性,易于形成共价化合物。
3. 平面分子平面分子是指分子中原子按照平面的方式排列的分子。
典型的例子是苯(C6H6)分子,其中六个碳原子连接成一个环状结构,形成平面分子结构。
平面分子通常具有较高的共轭性,易于发生共轭反应。
二、化学键的角度理论化学键的角度理论是指在分子中,原子之间化学键的形成和稳定存在所涉及的几何角度关系。
通过对化学键的角度进行研究,人们可以推测出分子的形状和立体构型。
1. 线性分子的键角对于线性分子而言,化学键之间的角度理论上为180度。
这是由于线性分子结构中原子排列在一条直线上,两个化学键形成直角。
例如,氧气(O2)分子中的氧原子与氧原子之间的键角为180度。
2. 非线性分子的键角对于非线性分子而言,化学键之间的角度理论上会略有偏离180度。
这是由于原子间的库仑斥力和键角张力的存在。
例如,水分子中的氧原子和两个氢原子之间的键角为104.5度。
3. 平面分子的键角对于平面分子而言,化学键之间的角度理论上为120度或109.5度,取决于分子的具体结构。
四、化学键理论与分子几何构型1. (1),(I)的稳定性大于(Ⅱ)。
(2)C OOO N O C OO O N O O (I)O C OO N OOCOO ONOO(II)O N O O CO OO NOOC O O (III)ONOOC ON OOCO O(IV)第(III)式最稳定。
(3) Cu + + NO 2–+ 2H + Cu 2+ + NO + H 2O(4) 若压强降到原来的2/3,则说明3 mol NO 变成2 mol 气态物质:3NO NO 2 + N 2O ,又由于2NO 2N 2O 4,所以最后的气体总压还要略小于原压的2/3。
2. N NN N NNNN N(IV)(V)(II)、(V)不稳定,舍去,(I)比(III)、(IV)稳定。
N (a)N (b)N (c)N (d)N (e) N (a)—N (b)的键级为5/2~3,N (b)—N (c)的键级为1~3/2,N (c)—N (d)的键级为1~3/2,N (d)—N (e)的键级为5/2~3。
N 5+有极强的氧化性。
应在液态HF 中制备N 5+。
3. ArCl + OF + NO + PS + SCl + 键级: 1 2 3 3 2ArCl +键级最小,最不稳定;虽然NO +与PS +的键级都是3,但NO +是2p —2p 轨道重叠的π键,而PS +是3p —3p 轨道重叠的π键。
前者重叠程度大,E π大,所以NO +比PS +稳定,即NO +离子最稳定。
4. (1)B 3N 3H 6N H H H H H N B N B B H H H H H H NB B H N BNO N O O O N O O (I)(II)N N N N N N N N N N (I)(II)N N N N N(III)(2) HH HH H H Cl HH H ClClB 3N 3H 6 3HCl N N N B BB(3) 无机苯的三甲基取代物有:B N B N B N HHHCH 3H 3CCH 3B NB N B N CH 3CH 3H 3CH HHB B N B N CH 3HHHCH 3CH 3(I)(Ⅱ)(III)B N B N B N CH 3HCH 3HCH 3H B N B N B N CH 3H H CH 3HH 3CB NB N B N CH 3H 3CH 3HH(IV) (V) (Ⅵ)实际上只有四种类型,因为II 、IV ;IV 、VI 属于同类型中的几何异构体。
这四种类型为(CH 3)3B 3N 3H 3、H 3B 3N 3(CH 3)3、(CH 3)2HB 3N 3H(CH 3)2、H 2(CH 3)B 3N 3(CH 3)2H 。
各基团与H 2O 的反应:BCH 3B(OH)2CH 3 BH B(OH)3 NH NH 3 NCH 3NH 2CH 3∴(CH 3)3B 3N 3H 3 + 6H 2O 3CH 3B(OH)2 + 3NH 3 H 3B 3N(CH 3)3 + 9H 2O 3H 3BO 3 + 3NH 2(CH 3) + 3H 2 (CH 3)2HB 3N 3H 2(CH 3) + 7H 2OH 3BO 3 + 2CH 3B(OH)2 + 2NH 3 + CH 3NH 2 + H 2(CH 3)H 2B 3N(CH 3)2H + 8H 2ONH 3 + 2H 3BO 3 + CH 3B(OH)+ 2NH 2CH 3+ 2H 2由于这四种类型水解后的产物及其量均有差别,因此根据这些差别可以判断为何种三甲基取代物。
(4) 因为硼氮二元固体聚合物(BN)m 与C n (m = n /2)是等电子体,C n 可以有金刚石型和石墨型,所以(BN)x 也具有金刚石型或石墨型。
在金刚石型中,B 、N 采取sp 3杂化,无自由电子存在,所以不导电,在石墨型中,虽然B 、N 都采取sp 2杂化,形成层状结构,但未参与杂化的N 原子2p 轨道上孤电子对占有B 原子未参与杂化的2p 轨道,成为定域π键,所以也不导电。
(5)[B 5O 9]3–·2H 2O [B 5O 7(OH)4]3–从阴离子单元的结构式中可以看到阴离子单元的电荷与硼采取sp 3杂化的原子个数相等。
B OB O B OOHOBO B O O O OH HOOH n5.6. (1)COCO 2HCHOCO一个σ键, 一个π键, 一个π配键H C HOσπσσ两个σ键,两个43Π三个σ键,一个π键CH 3COOH7个σ键,一个43Π。
σσσH C H HHσσ* (* 实际上CH 3COO -中有43Π:,而 中OH 上的氧 原子采取sp 3杂化,所以COH O的C =O 应为定域π键。
(2) 根据键级的大小,C -O 的键长从小到大的排列为:CO < CO 2 < HCHO < CH 3COOH7.(1)3170o C RN AlN Al N CH 3R CH 3Al CH R+6 CH 42(D )NHAl(CH 3)22R( )(2) 见上题中(D)。
(3) 设B 、C 混合物中B 的质量分数为x ,C 的质量分数为y ,B 中碳的质量分数 = (12C)/(C 12NH 19) = 144.12/177.32 = 0.81277氮的质量分数 = N/(C 12NH 19) = 14.01/177.32 = 0.079010 C 中碳原子的质量分数 = (14C)/(C 14AlNH 24)=14×12.01/(14×12.01+26.98+14.01+1.01×24) = 0.72049氮原子的质量分数 = N/(C 14AlNH 24)43Π4343ΠΠCH 31/21/2C OOH CH 3Al CH 3CH 3C H 3C H 3AlCH 3CH 3+NH 2NHAl(CH 3)2+2CH 42AB C2= 14.01/233.37 = 0.060033∴ 0.81277x + 0.72049y = 0.7371 0.079010x + 0.060033y = 6.34/100解得x = 0.1757 = 17.57% y = 0.8248 = 82.48%8. (1) 正四面体结构有:NH 4+、SO 42–,三角锥型有:NH 3、SO 32–,所以A 可能为Cu(NH 4)SO 3或Cu(NH 3)SO 4,但A 是反磁性的,Cu 2+是顺磁性,而Cu +是反磁性,故A 为Cu(NH 4)SO 3。
(2) Cu(NH 3)42+ + 3SO 2 + 4H 2O 2Cu(NH 4)SO 3↓ + SO 42– + 6NH 4+ (3) 2Cu(NH 4)SO 3 + 2 H 2SO 4 CuSO 4 + Cu + 2SO 2 + (NH4)2SO 4 + 2H 2O (4) 50%(5) 100% 因为 ,如此循环,趋向于100%。
9. (1) (2) C 8(NO 2)84N 2 + 8CO 210. (1) 如右图所示。
(2) C 8H 4(NO 2)4 N 2 + 2H 2O + 5CO+ 3C(3) MX 4: = 19种,MX 3Y : = 19×18=342 MX 2Y 2: = 19×18/2=171 MX 2YZ : = 19×18×17/2=2907 MXYZW : = 2×19×18×17×16/(4×3×2×1)=7752 C 的种类有:19+342+171+2907+7752=11191(4) C 中MXYZW 有对映体,所以对映体数目=3876。
11. (1) OsO 3N –(2)OOOOOs(A)正四面体OHOHOOO OsOOH OO OOsOOOO NOs(B) (cis ) 八面体(trans ) 八面体(C) 四面体12.(1) 9.3 g·dm –3 × 22.4 dm 3/mol = 208.32 g/mol 208.32/(36 + 35.45 × 5) = 1 所以PCl 5蒸汽中分子为PCl 5。
(2) 加热到250o C ,测得压力为计算值两倍,这说明 PCl 5(g) (1mol)成为2mol 气体,即 PCl 5(g) PCl 3(g) + Cl 2(g)(3) PCl 5(l)+4PCl (l) +6PCl -(l) P Cl ClClCl Cl三角双锥P Cl三角锥NO 22119C 219P 219C 121918C C 419C 2SO 2H 2Cu CuCu Cu ++++−−−→−−→+2(4) PBr 5(l)PBr 4+(l) + Br -(l) 由于r Br –﹥r Cl –,所以PBr 6–不稳定,6个Br –离子之间的排斥力大,即PBr 6–不能存在,也可以看成PBr 6–分解成PBr 5+Br –,所以PBr 5(l)与PCl 5(l)的离解方式不同。
14. (1) 因为从N →Sb 的电负性变小,成键电子对离中心原子越来越远,成键电子对之间的排斥力越来越小,所以从NH 3→SbH 3键角变小。
(2) NH 3与NF 3相比,F 的电负性大于H ,所以NF 3中的成键电子对离F原子近,N -F 键之间的排斥力小于N -H 之间的排斥力,故NH 3的键角为107o ,而NF 3的键角为102.5o 。
对于PH 3和PF 3而言,P 原子有3d 空轨道,F 原子上的孤电子对占有P 原子的3d 空轨道,增加了P 原子上的电子密度,导致P -F 键之间的排斥力大于P -H 键之间的排斥力,故PH 3的键角为93.6o ,PF 3的键角为96.3o 。
15. 丁二烯: 苯: NO 2: (也有称 ) NO 3–: SO 3: CO 2:2个 16.N CNH HNCNHH,CH 2N 2 CH 2 + N 217. S NSNS N SNSNSNS SN SNSNSSNSNSNS SN SNSN S S(I) (舍去)(Ⅱ) (舍去)(III) (舍去)(Ⅳ) (舍去)(Ⅴ)S NSNS S NN SNSNSSNSNSNS SN NSNS SNNSNS S(Ⅵ)(Ⅶ) (Ⅷ)(Ⅸ) (Ⅹ)NSNSNS S最稳定的结构式为(Ⅷ),因为 、 相距较远。
(Ⅷ)中双键表示S -N 键最短。
(XI)18. (1) SCl 3+属于AB 3E 型,S 原子应sp 3杂化,为+4氧化态。
ICl 4–属于AB 4E 2型,I 原子应sp 3d 2杂化,为+3氧化态。