CH2 重点
- 格式:pptx
- 大小:534.83 KB
- 文档页数:62

环境化学重点整理环境化学⼀、绪论1)环境定义指与某⼀中⼼事物有关(相适应)的周围客观事物的总和,中⼼事物是指被研究的对象。
对⼈类社会⽽⾔,环境就是影响⼈类⽣存和发展的物质、能量、社会、⾃然因素的总和。
2)环境问题:其⼴义理解,就是因⾃然⼒或⼈⼒引起的⽣态平衡破坏,直接或间接影响⼈类的⽣存和发展的⼀切客观存在的问题。
对于仅仅由于⼈类的⽣产和⽣活活动引起的⽣态系统失衡,产⽣全球或区域环境质量的恶化,进⽽影响⼈类⽣存和发展的⼀切问题,则称之为狭义。
分类:原⽣环境问题:⾃然⼒引发,也称第⼀类环境问题。
次⽣环境问题:⼈类⽣产、⽣活引起⽣态破坏和环境污染,反过来危及⼈类⽣存和发展的现象,也称第⼆类环境问题。
3)当前⼈类全体⾯临的环境问题⾄少有10⽅⾯1)⼤⽓污染;2)臭氧层破坏;3)酸⾬侵袭;4)⼟壤荒漠化;5)绿⾊屏障锐减;6)垃圾⼤量积留;7)⽔资源污染;8)物种濒危;9)⼈⼝激增;10)温室效应六种类型(3P+3E):⼈⼝、贫困、污染、能源、环境、⽣态破坏4)环境污染(重点)⼈类活动产⽣的副产品和废物进⼊环境,并在环境中扩散、迁移、转化,使环境系统的结构与功能发⽣变化,对⽣态系统产⽣的⼀系列⼲扰和侵害,如⽔污染、⼤⽓污染、酸⾬、臭氧层破坏、海洋污染等等。
具体地说:环境污染就是指有害物质对⼤⽓、⽔、⼟壤和动植物污染并达到有害的程度。
环境污染的具体表现:(1)有害物质对⼤⽓、⽔、⼟壤和动植物的污染并达到致害的程度(2)⽣物界的⽣态系统遭到不适当的⼲扰和破坏(3)不可再⽣资源被滥采滥⽤(4)固体废弃物、噪声、振动、恶臭、放射线等5)⼈们对环境问题认识的发展(重点)* 20世纪60年代,环境问题被当成污染问题。
——起步* 1972年,《⼈类环境宣⾔》,不仅是污染,还表现在⽣态破坏和资源枯竭,部分原因是贫困。
——⾥程碑* 20世纪80年代,《我们共同的未来》,可持续发展战略,指明了解决环境问题的根本途径。
——突破性发展* 20世纪90年代,《⾥约环境与发展宣⾔》、《21世纪议程》,促使环境保护和经济、社会协调发展,全球⾏动的纲领。



高二化学重点知识归纳笔记(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的教育资料,如幼儿教案、音乐教案、语文教案、知识梳理、英语教案、物理教案、化学教案、政治教案、历史教案、其他范文等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, this store provides various types of educational materials for everyone, such as preschool lesson plans, music lesson plans, Chinese lesson plans, knowledge review, English lesson plans, physics lesson plans, chemistry lesson plans, political lesson plans, history lesson plans, and other sample texts. If you want to learn about different data formats and writing methods, please stay tuned!高二化学重点知识归纳笔记本店铺整理的《高二化学重点知识归纳笔记》希望能够帮助到大家。

第二章证券投资基金的类型第一节证券投资基金分类概述一、证券投资基金分类的意义(一)对投资者来说,科学的分类有助于投资者加深对各种基金的认识与风险收益特征的把握,有助于投资者做出正确的投资选择与比较(二)对基金管理公司来说,基金业绩的比较应该在同一类别中进行才公平合理(三)对基金研究评价机构来说,基金的分类则是进行基金评价的基础(四)对监管部门来说,有利于实施有效的分类监管二、基金分类的困难2004年7月1日《证券投资基金运作管理办法》中,首次将我国的基金的类别分为股票基金、债券基金、混合基金、货币市场基金等基本类型三、基金分类(重要考点,经常以多项选择题出现)(一)根据运作方式不同,可以分为封闭式基金、开放式基金(二)根据法律形式的不同,可以分为契约型基金、公司型基金(三)根据投资对象不同,可分为股票基金(>60%投资于股票)、债券基金(>80%)、货币市场基金、混合基金等(四)根据投资目标不同,可分为增长型基金(追求资本增值为基本目标,主要以良好增长潜力的股票为投资对象;High Risk, High Return)、收入型基金(追求稳定额经常性收入为基本目标,一大盘蓝筹股、债券等稳定收益证券为投资目标;Low Risk,Low Return)和平衡型基金(五)依据投资理念的不同,可以分为主动型基金与被动型基金(六)根据募集方式不同,可分为公募基金和私募基金(七)根据基金的资金来源和用途的不同,可分为在岸基金和离岸基金(八)特殊类型基金1.系列基金伞形基金多个基金共有一个基金合同,子基金独立运作,子基金之间可以互相转换2.基金中的基金以其他投资基金为投资对象我国无此类基金3.保本基金4.交易型开放式指数基金(ETF)与ETF联接基金5.上市开放式基金(LOF)6.QDII基金7.分级基金,结构型基金第二节股票基金一、股票基金在投资组合中的作用1.适合长期投资2.风险较高、预期收益也较高3.提供了应付通货膨胀最有效的手段二、股票基金与股票的不同1.股票价格随时变动;股票基金价格每个交易日只有1个价格2.股票价格受成交量的影响;股票基金价格不受申购、赎回的数量的影响3.股票价格高低的合理性可以作出判断;而不能对股票基金净值的合理性进行判断4.单一股票风险较大;而股票基金由于采取投资组合,风险相对较低三、股票基金的类型(一)按投资市场分类,可以分为国内、国外、全球股票基金三大类(二)按股票规模分类,可以分为小盘、中盘与大盘股票(三)按股票性质分类,可以分为价值型股票基金与成长型股票基金(四)按基金投资风格分类,可以分为9种类型(五)按行业分类,如基础行业基金、资源类股票基金、房地产基金、金融服务基金、科技股基金等四、股票基金的投资风险股票基金的投资风险分为系统性风险、非系统性风险以及管理运作风险五、股票基金的分析方法对股票基金的分析也有一些常用的分析指标。

高二化学选择性必修二重点知识点(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的教育资料,如幼儿教案、音乐教案、语文教案、知识梳理、英语教案、物理教案、化学教案、政治教案、历史教案、其他范文等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, this store provides various types of educational materials for everyone, such as preschool lesson plans, music lesson plans, Chinese lesson plans, knowledge review, English lesson plans, physics lesson plans, chemistry lesson plans, political lesson plans, history lesson plans, and other sample texts. If you want to learn about different data formats and writing methods, please stay tuned!高二化学选择性必修二重点知识点本店铺为各位同学整理了《高二化学选择性必修二重点知识点》,希望对你的学习有所帮助!1.高二化学选择性必修二重点知识点篇一化学平衡状态的特征:逆、动、等、定、变。
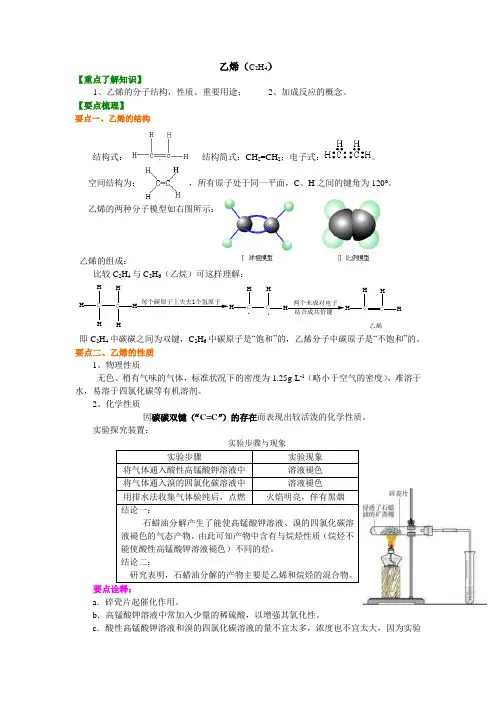
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。



高一化学重点知识点笔记整理(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的教育资料,如幼儿教案、音乐教案、语文教案、知识梳理、英语教案、物理教案、化学教案、政治教案、历史教案、其他范文等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, this store provides various types of educational materials for everyone, such as preschool lesson plans, music lesson plans, Chinese lesson plans, knowledge review, English lesson plans, physics lesson plans, chemistry lesson plans, political lesson plans, history lesson plans, and other sample texts. If you want to learn about different data formats and writing methods, please stay tuned!高一化学重点知识点笔记整理本店铺为各位同学整理了《高一化学重点知识点笔记整理》,希望对你的学习有所帮助!1.高一化学重点知识点笔记整理篇一无机非金属材料的主角——硅1、构成有机物的最不可缺少的元素是碳,硅是构成岩石和矿物的基本元素。
高一化学必修一重点知识点笔记1.高一化学必修一重点知识点笔记篇一1、溶解性①常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
极易溶于水的气体尾气吸收时要用防倒吸装置。
②溶于水的有机物:低级醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。
苯酚微溶。
③卤素单质在有机溶剂中比水中溶解度大。
④硫与白磷皆易溶于二硫化碳。
⑤苯酚微溶于水(大于65℃易溶),易溶于酒精等有机溶剂。
⑥硫酸盐三种不溶(钙银钡),氯化物一种不溶(银),碳酸盐只溶钾钠铵。
⑦固体溶解度大多数随温度升高而增大,少数受温度影响不大(如NaCl),极少数随温度升高而变小[如Ca(OH)2]。
气体溶解度随温度升高而变小,随压强增大而变大。
2、密度①同族元素单质一般密度从上到下增大。
②气体密度大小由相对分子质量大小决定。
③含C、H、O的有机物一般密度小于水(苯酚大于水),含溴、碘、硝基、多个氯的有机物密度大于水。
④钠的密度小于水,大于酒精、苯。
3、物质燃烧时的影响因素:①氧气的浓度不同,生成物也不同。
如:碳在氧气充足时生成二氧化碳,不充足时生成一氧化碳。
②氧气的浓度不同,现象也不同。
如:硫在空气中燃烧是淡蓝色火焰,在纯氧中是蓝色火焰。
③氧气的浓度不同,反应程度也不同。
如:铁能在纯氧中燃烧,在空气中不燃烧。
④物质的接触面积不同,燃烧程度也不同。
如:煤球的燃烧与蜂窝煤的燃烧。
4、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
5、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
有机化学重点(完整版)烷烃1.室温下,叔、仲、伯氢氯代的速率之比是5:4:1溴代反应中,有一种异构体占绝对,选择性高。
2.异构化反应:ch3ch2ch2ch3alcl390℃1-2mpach3chch3ch31.α-c:与官能团轻易相连的碳原子烯烃2.把烯烃加进溴的四氯化碳溶液中,轻微震荡后,红色显露,需用此反应检验烯烃的存有,以区别饱和状态烃。
(鉴别)3.马氏规则:不等距烯烃与卤化氢等极性试剂差率时,试剂中带正电的部分总是提至含氢较多的双键碳上4.差率硫酸ch2=ch2+h2so4------ch3ch2oso2ohch3ch2oso2oh+h2o-----ch3ch2oh+h2so4(间接水合法制醇)5.加成水:6.加成次卤酸7.hbr存有过氧化物效应(反马氏差率)8.高锰酸钾氧化rchr1kmnoo(分析结构,鉴别,烯----羧酸/酮)4c(直接水合法制醇)r2h+rcooh+r1cr29.催化剂水解:(制环氧乙烷)10.臭味水解:(烯-----醛)11.硼氢化-氧化反应相当于反马氏加成水得到醇,特别是伯醇的合成12.顺丁烯二酸酐与共轭二烯反应生成白色沉淀(鉴别)炔烃1.命名时首先并使双键和叁键位次和最轻,若从两边编号和一样,则优先并使双键的位次尽可能大.2.双、叁键同时存有时,差率首先出现在双键上3.加成卤化氢hgcl2-c(制氯乙烯)hcch+hclch2=ch5.与nanh2、linh2等反应nacch+chchchclchchchcch(增长碳链)6.与硝酸银(或氯化亚铜)的氨溶液反应:生成白色和棕红色沉淀(鉴定末端炔)7.加成水(炔------醛酮)催化剂:hgso4h2so48.3,4环烃类似烯但不能被高锰酸钾氧化(鉴别)可是溴的四氯化碳褪色芳香烃ch2clcl4.亲核差率:炔可与hcn、roh、rcooh差率,与烯烃相同。
h3ccch+ch3coohoh-h3c醋酸锌ococch2ch33223221.+br2苄氯当苯环上甘胺-cooh,-so3h,-cho,-cor,-oh,-nh2等官能团时以苯环为替代基febr3(fe)br2.亲电取代(特别注意催化剂)3.甲基苯的占位ch3so3ch3ch3cl2/feclh/h2o100--150℃so3hso3h+ch3cl(关键)4.烷基化反应(加长碳链)+ch3chch3clalcl3ch(ch3)3+hcl(催化剂:路易斯酸)烷基化试剂rx、roh、烯烃5.酰基化反应(得到支链烷基苯的桥梁)ooalcl3cch2ch3+ch3ch2ccl6.氯甲基化反应:(减少一个c的中间体)+hcho+hclzncl2(无水)60℃h2oh+ch2cl(作为中间体合成多一个c的羧酸,胺,醇)ch2coohnacnrnh2h2o_ohch2cnch2nhrch2oh7.含α-h的芳烃可以被高锰酸钾氧化(鉴别)-----生成羧酸8.氧化反应400-450℃9.第一类替代基+o2v2o5chchccooo+co2+h2ooo-o>-nr2>-oh>-or>-nh-c-r(-o-c-r)_>-ch3(c6h5-)>-x(cl,br)活化苯环的能力依次减少第二类替代基为卤代烃1.卤代烃的水解(制醇)2.卤代烃的醇求解-nh3,-nr3>-coor>-no2(-cn)>-so3h(-cooh)o-c-ro-c-h(合成醚,必须是伯卤代烃与醇钠反应)_3.卤代烃的氰解rcl+nacn钝化苯环+h2orch2oh+clcl的能力依次减弱2醇-水chohrcn+nacl(加长碳链,制酸,胺)rcnh2nirch2nh2rcnh(oh)h2o+_rcooh4.卤代烃的氨解5.卤代烃反应活性phch2x,ch2=chch2x>3orx>2orx>1orx(辨别)cl+nh3rnh2+nh4cl与硝酸银的醇溶液反应鉴别三类氯代烃(快-较快-慢)过量6.格式试剂的分解成rnhr'+r'nh3clrcl+r'nh2无水乙醚rx+mgrmgx(无水乙醚催化)h+h2o新制多一个c的羧酸rmgcl+co27.与有机纳反应rcoomgclrcooh醇1.辨别醇:重新加入申齐气泡产生2..与浓硫酸反应生成盐(鉴别分离醇)-----溶于浓硫酸3.分解成卤代烃(卢卡试剂)rch2ohrch2oh浓硫酸zncl2h2so4+浓hclrch2clrch2br+浓hbr4.卢卡试剂辨别3类羟基伯醇-----加热浑浊仲醇----10分钟浑浊叔醇----1分钟浑浊5.脱水反应oh+浓h2so4roh2hso4钅羊盐_6.用7.制备醛酮浓h2so4ch3ch2och2ch3℃k2cr2o7-h2so4或kmno140叔醇无法被上述两者水解(制取羧酸)4辨别伯仲与叔醇h3ch2oh170℃浓h2so4ch2=ch2ch3(ch2)3ch2-ohcro3吡啶ch3(ch2)3cho酚1.威廉姆森制备醚(醇纳加卤代烃)2.酚与酰氯(酸酐)反应分解成酯narclor+nacl3.与fecl3的显色反应(用于酚的鉴别)4.与溴水反应生成三溴苯酚白色沉淀(酚的鉴别)醛酮1.命名时官能团的优先顺序。
高中化学必修二方程式归纳总结高中化学必修二方程式总结1、乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)2、乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br3、乙烯和水CH2=CH2+H20→CH3CH2OH(条件为催化剂)4、乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl5、乙烯和氢气CH2=CH2+H2→CH3-CH3(条件为催化剂)6、乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)7、氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)8、实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4)9、乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃)10、乙炔和溴水C2H2+2Br2→C2H2Br4高中化学必修二必背方程式1、向氢氧化钠溶液中通入少量CO2:2NaOH+CO2====Na2CO3+H2O2、在标准状况下2.24LCO2通入1mol/L100mLNaOH溶液中:CO2+NaOHNaHCO33、烧碱溶液中通入过量二氧化硫:NaOH+SO2==NaHSO34、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2══Ca(HCO3)25、氨水中通入少量二氧化碳:2NH3?H2O+CO2==(NH4)2CO3+H2O6、用碳酸钠溶液吸收少量二氧化硫:Na2CO3+SO2Na2SO3+CO2↑7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O══2NaHCO38、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc9、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5ONa→C6H5OH+NaHCO310、氯化铁溶液中通入碘化氢气体:2FeCl3+2HI2FeCl2+I2+2HCl高中化学必修二必须掌握的方程式1、乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)3、以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式. CaCO3===CaO+CO22CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4----乙炔加成生成乙烯4、苯和液溴的取代C6H6+Br2→C6H5Br+HBr5、苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸)6、苯和氢气C6H6+3H2→C6H12(条件为催化剂)7、乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃)8、两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O(条件为催化剂浓硫酸140摄氏度) 9、乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2OMg+2CH3COOH→(CH3COO)2Mg+H2怎么提高化学成绩认真听课这是最简单快捷有效,也是最基本的方法,为什么怎么说呢?因为化学不需要像物理数学那样花非常多的时间去做题和研究,化学知识点特别多、而且咋,化学可以课前预习,但课堂上的效率却是最高的,往往老师讲一遍就能记住70%-80%,所以上课一定要认真听讲。
高中有机化学的知识点总结高中有机化学的知识点总结有机化学是高中化学课程中很重要的一个知识内容,我们在考试的时候会经常被考察到,那么你有经常复习有机化学的知识点吗?下面是店铺为大家整理的高中重要的化学知识要点,希望对大家有用!高中有机化学知识重要反应方程式烷:取代CH4 + Cl2 →(光照)→ CH3Cl(g) + HClCH3Cl + Cl2 →(光照)→ CH2Cl2(l) + HClCH2Cl + Cl2 →(光照)→ CHCl3(l) + HClCHCl3 + Cl2 →(光照)→ CCl4(l) + HCl现象:颜色变浅装置壁上有油状液体注意:4种生成物里只有一氯甲烷是气体三氯甲烷 = 氯仿四氯化碳作灭火剂烯:1、加成CH2=CH2 + Br2 → CH2BrCH2BrCH2=CH2 + HCl →(催化剂) → CH3CH2ClCH2=CH2 + H2 →(催化剂,加热) → CH3CH3 乙烷CH2=CH2 + H2O →(催化剂,加热加压) → CH3CH2OH 乙醇2、聚合(加聚)nCH2=CH2 →(一定条件) → [-CH2-CH2-]n(单体→高聚物)注:断双键→两个“半键”高聚物(高分子化合物)都是【混合物】炔:基本同烯。
苯:1.1、取代(溴)C6H6 + Br2 →(Fe或FeBr3)→C6H6-Br+ HBr注:V苯:V溴=4:1长导管:冷凝回流导气、防倒吸 NaOH除杂现象:导管口白雾、浅黄色沉淀(AgBr)、CCl4:褐色不溶于水的液体(溴苯)1.2、取代——硝化(硝酸)C6H6 + HNO3 → (浓H2SO4,60℃)→C6H6-NO2 + H2O注:先加浓硝酸再加浓硫酸冷却至室温再加苯50℃-60℃【水浴】温度计插入烧杯除混酸:NaOH硝基苯:无色油状液体难溶苦杏仁味毒1.3、取代——磺化(浓硫酸)C6H6 + H2SO4(浓) →(70-80度)→C6H6-SO3H + H2O2、加成C6H6 + 3H2 →(Ni,加热)→C12H12 (环己烷)醇:1、置换(活泼金属)2CH3CH2OH + 2Na → 2CH3CH2ONa +H2↑2、消去(分子内脱水)C2H5OH →(浓H2SO4,170℃)→CH2=CH2↑+H2O3、取代(分子间脱水)2CH3CH2OH →(浓H2SO4,140度)→ CH3CH2OCH2CH3 (乙醚)+ H2O(乙醚:无色无毒易挥发液体麻醉剂)4、催化氧化2CH3CH2OH + O2 →(Cu,加热)→ 2CH3CHO(乙醛) + 2H2O现象:铜丝表面变黑浸入乙醇后变红液体有特殊刺激性气味酸:取代(酯化)CH3COOH + C2H5OH →(浓H2SO4,加热)→ CH3COOC2H5 +H2O(乙酸乙酯:有香味的无色油状液体)注:【酸脱羟基醇脱氢】(同位素示踪法)碎瓷片:防止暴沸浓硫酸:催化脱水吸水饱和Na2CO3:1、减小乙酸乙酯的溶解,利于分层2、除掉乙酸,避免乙酸干扰乙酸乙酯的气味3、吸收挥发出的乙醇饱和碳酸钠不能换成氢氧化钠,否则会造成酯的水解卤代烃:1、取代(水解)【NaOH水溶液】CH3CH2X + NaOH →(H2O,加热)→ CH3CH2OH + NaX注:NaOH作用:中和HBr 加快反应速率检验X:加入硝酸酸化的AgNO3 观察沉淀2、消去【NaOH醇溶液】CH3CH2Cl + NaOH →(醇,加热)→ CH2=CH2↑ +NaCl + H2O 注:相邻C原子上有H才可消去加H加在H多处,脱H脱在H少处(马氏规律)醇溶液:抑制水解(抑制NaOH电离)高中化学必考知识主要实验操作和实验现象的具体实例1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
选修5 有机化学基础第一章至第三章重点化学方程式默写(注意配平及条件.......)班级______姓名__________一、烷烃甲烷燃烧:甲烷与氯气发生取代反应:二、烯烃: 官能团:结构_____________,名称______________。
(1)氧化反应(燃烧):CH2=CH2 + O2(2)加成:CH2=CH2 + Cl2CH2=CH2 + HClCH2=CH2 + H2CH2=CH2 + H2O(3)加聚:n CH2=CH2三、乙炔: 官能团:结构_____________,名称______________。
(1)加成:+ H2+ H2+ HCl + Cl2(2)实验室制乙炔:CaC2 + H2O四、苯和苯的同系物(1)取代反应:+ Br2 + HO-NO2+ HO-NO2(2+ H2五、卤代烃: 官能团:结构_____________,名称______________。
(1)水解反应:CH3CH2Br + NaOH(2)消去反应:CH3CH2Br + NaOH六、醇: 官能团:结构_____________,名称______________。
(1)与活泼金属:Na + CH3CH2OH(2)①氧化反应(燃烧):CH3CH2OH + O2②催化氧化:CH3CH2OH + O2(3)消去反应(实验室制乙烯):CH3CH2OHCH CHCH CHCH CHCH CHCH3(4)酯化反应:CH 3CH 2OH + (5)与HX 反应:CH 3CH 2OH + HBr七、酚: 官能团:结构_____________,名称______________。
(1)弱酸性:①与NaOH 溶液的反应: + NaOH ②苯酚的制备(“强酸制弱酸”) + H 2O + CO 2(2)取代反应:苯酚的溴化反应: + Br 2八、醛: 官能团:结构_____________,名称______________。