课题3溶液的浓度教案
- 格式:doc
- 大小:89.50 KB
- 文档页数:5

人教版九年级下册化学第九单元课题3-溶液的浓度说课稿一、教材分析本课是人教版九年级下册化学第九单元的第三课时,主要内容是溶液的浓度。
通过本课的学习,学生将了解溶液的浓度概念、计算浓度的方法及浓度的应用。
教材内容简介:本课涉及的主要概念有溶液、溶质、溶剂和溶液的浓度。
通过实际例子和计算练习,帮助学生理解溶液的浓度概念以及不同浓度的溶液对物体的影响。
学情分析:九年级学生已经基本掌握了液体的基本特性和溶解的基本概念,对溶液也有一定的了解。
此前的学习中,学生通过实验和讨论认识了溶解的条件和化学反应速率与表面积、浓度的关系。
因此,学生在本课时的学习中能够迅速理解和接受本课的知识点,并能通过计算练习来巩固相关概念。
二、教学目标1.知识与技能:–熟练掌握溶液、溶质和溶剂的概念。
–掌握计算溶液浓度的方法及其应用。
2.过程与方法:–培养学生观察问题、分析问题的能力。
–培养学生合作学习、探究学习的能力。
3.情感态度与价值观:–培养学生热爱自然科学的兴趣。
–培养学生合作、分享、探究的价值观。
三、教学重难点1.教学重点:–溶液、溶质和溶剂的概念。
–计算溶液浓度的方法及其应用。
2.教学难点:–让学生理解溶液浓度的计算方法。
–培养学生合作学习的能力。
四、教学过程1. 导入新课通过一个实际生活中的例子引入本课:某饮料店调制了两杯相同口感的柠檬水,但一杯柠檬水的酸味更浓烈。
请思考一下,这两杯柠檬水哪一杯的溶液浓度更高?2. 学习新知(1) 概念解析•溶液:由溶质和溶剂组成的混合物称为溶液。
•溶质:被溶解的物质称为溶质。
•溶剂:用于溶解溶质的物质称为溶剂。
(2) 浓度的定义与计算•溶液的浓度:指的是单位体积溶液中溶质的质量。
•计算公式:浓度(C) = 溶质的质量(m) / 溶液的体积(V)。
(3) 浓度的应用•浓溶液:溶液中溶质的质量相对较大,浓度较高。
•稀溶液:溶液中溶质的质量相对较小,浓度较低。
3. 计算练习通过几个例题进行计算练习,帮助学生掌握溶液浓度的计算方法。

溶液的浓度教案范文一、教学目标1.知识与技能(1)理解溶液的定义和组成;(2)掌握溶液浓度的计算方法;(3)了解溶液的稀释方法。
2.过程与方法(1)引导学生通过实例,理解溶液的定义和组成;(2)通过实例演算,培养学生计算溶液浓度的能力;(3)通过实验,让学生掌握溶液的稀释方法。
3.情感态度价值观(1)培养学生严谨的科学态度;(2)培养学生良好的实验操作习惯;(3)培养学生珍惜资源和环境的意识。
二、教学重点1.溶液的定义和组成;2.浓度的计算方法。
三、教学难点溶液稀释法的操作四、教学过程1.导入教师向学生展示一杯盐水和一杯纯水,请学生观察并思考两杯水的差异,并划分出盐水、纯水、溶质、溶剂四个部分,引导学生理解溶液的定义和组成。
2.理论探究(1)溶解度教师引导学生思考,不同物质在水中的溶解度不同,有些物质即使放入水中也不能完全溶解。
同学们可以进行实验观察,如将盐、糖放入热水中搅拌,观察其是否完全溶解。
(2)浓度的定义教师解释浓度的概念,即单位体积内溶质的质量或溶质的物质量与溶液的体积比值。
(3)常用浓度表示方法教师介绍常用的浓度表示方法,如质量浓度、体积浓度、摩尔浓度等,并分别解释其计算公式和应用场景。
(4)计算实例教师通过实例演算,让学生掌握浓度计算的方法。
例如:将10g的NaCl溶解在100g的水中,请计算溶液的质量浓度和体积浓度。
3.拓展应用教师给学生展示一些日常生活中的实际应用场景,如制备淡盐水、糖水等,引导学生思考在实际生活中如何计算浓度,如何制备出所需浓度的溶液。
4.实验操作(1)准备工作教师将一定浓度的盐水提前制好,准备一套容量瓶和一套刻度瓶。
(2)实验操作将一定量的盐水加入容量瓶中,注满溶液,倒入刻度瓶中得到相应体积的溶液,进行一定倍数的稀释,再通过称量得到质量和体积,并计算浓度。
5.撤课教师对本节课的内容进行归纳总结,强调浓度计算的方法和操作要点。
并告诉学生,通过实验的方式,我们可以制备出所需浓度的溶液,但在实验过程中要注意安全,并珍惜使用的化学试剂和制备出的溶液。

高中化学溶液浓度教案
主题:溶液浓度
教学目标:
1. 了解溶液浓度的概念和单位;
2. 掌握计算溶液浓度的方法和技巧;
3. 熟练运用溶液浓度的概念解决实际问题。
教学内容:
1. 溶液浓度的概念和分类;
2. 溶液浓度的计算方法:质量浓度、体积浓度、摩尔浓度;
3. 溶液稀释的计算方法。
教学过程:
第一部分:引入
1. 激发学生学习兴趣,讨论日常生活中溶液浓度的应用;
2. 引导学生思考什么是溶液浓度,为什么要了解溶液浓度。
第二部分:授课
1. 讲解溶液浓度的概念和分类;
2. 分别介绍质量浓度、体积浓度、摩尔浓度的计算方法及应用;
3. 指导学生如何计算溶液的浓度。
第三部分:练习
1. 给学生提供一些练习题,让他们实际操作计算不同类型的溶液浓度;
2. 检查并解析练习题,让学生掌握计算方法和技巧。
第四部分:总结
1. 总结本节课所学的溶液浓度知识;
2. 强调实际应用中溶液浓度的重要性。
课后作业:
1. 写出质量浓度、体积浓度、摩尔浓度的定义和计算公式;
2. 解决一些与溶液浓度相关的实际问题。
扩展阅读:
1. 了解其他溶液浓度的计算方法;
2. 学习溶液稀释的原理和计算方法。

初中化学浓度教案【教学目标】1. 了解溶液浓度的概念及其表示方法。
2. 掌握溶液浓度的计算方法。
3. 能够运用溶液浓度知识解决实际问题。
【教学重点】1. 溶液浓度的概念及其表示方法。
2. 溶液浓度的计算方法。
【教学难点】1. 溶液浓度计算公式的运用。
2. 解决实际问题能力的培养。
【教学方法】1. 采用实验演示法,让学生直观地了解溶液浓度的概念。
2. 采用讲授法,讲解溶液浓度的表示方法及计算方法。
3. 采用案例分析法,培养学生的实际应用能力。
【教学过程】一、导入(5分钟)1. 教师通过展示日常生活中常见的溶液(如饮料、药水等),引导学生思考:什么是溶液?溶液有哪些特点?2. 学生回答后,教师总结:溶液是由溶剂和溶质组成的均匀混合物,具有均一性和稳定性。
二、新课导入(10分钟)1. 教师介绍溶液浓度的概念:溶液浓度是指单位体积或单位质量的溶液中溶质的含量。
2. 教师讲解溶液浓度的表示方法:质量分数、摩尔浓度、质量浓度等。
3. 学生跟随教师一起总结溶液浓度的计算方法:质量分数=溶质质量/溶液质量×100%,摩尔浓度=溶质的物质的量/溶液的体积,质量浓度=溶质质量/溶液体积。
三、实验演示(15分钟)1. 教师准备实验:准备两个烧杯,分别加入等质量的水和酒精,再分别加入等质量的盐。
2. 学生观察实验现象:盐在水中溶解得更快,而在酒精中溶解得更慢。
3. 教师引导学生思考:为什么会出现这种现象?与溶液的浓度有什么关系?四、案例分析(10分钟)1. 教师给出案例:一瓶饮料的标签上写着“含糖量20%”,问这瓶饮料中糖的质量是多少?2. 学生运用溶液浓度的计算方法,计算出糖的质量。
3. 学生分享计算结果,教师点评并总结。
五、课堂小结(5分钟)1. 教师引导学生回顾本节课所学内容,总结溶液浓度的概念、表示方法和计算方法。
2. 学生分享学习收获,教师点评并鼓励。
六、作业布置(5分钟)1. 教师布置作业:计算一瓶500ml的0.1mol/L的盐酸溶液中HCl的质量。

课题3 溶液的浓度(第一课时)南京市浦口区汤泉中学杨金银【教学目标】知识与技能:1. 理解溶质质量分数的概念,知道其是溶液的浓稀的一种准确地表达方式。
2. 理解某温度下某物质饱和溶液溶质质量分数为一定值,其与溶解度大小有关。
3.能进行溶质质量分数的简单计算。
过程与方法:1. 通过溶质量分数的学习,知道其是表示溶液组成多种方法中的一种,学会表示混合物组成的表达方法。
2. 通过对某温度下饱和溶液溶质质量分数为一定值的讨论,体验概念是我们分析问题解决问题的依据。
情感态度·价值观:通过溶质质量分数的计算,初步养成勤于思考、敢于质疑、严谨求实等科学品质。
【重点和难点】重点:溶质的质量分数的概念及简单计算。
难点:溶质的质量分数概念的理解与应用。
【教学准备】多媒体课件实验药品及相关器材【教学过程】教学流程教师活动学生活动复习引入展示人们在死海里看书的照片;【提问】1.什么是饱和溶液?2.KNO3不饱和溶液怎样变成饱和溶液?Ca(OH)2饱和溶液怎样变成不饱和溶液?【过渡】不同的溶液组成可能是不同的。
如何来表示溶液的组成呢?激发学生兴趣启发学生思考并回答问题讨论【问题】怎样判断溶液的浓和稀?【活动1】出示3支试管,盛有不同浓度的硫酸铜溶液。
请学生判断试管里溶液的浓稀,并说明判断的依据。
【活动2】演示【实验9-7】试管编号溶剂/g 溶质/g 溶液/g①20 0.1②20 0.5③20 2.0请填写上表,并讨论,除根据溶液颜色外,你还有什么方法来判断3支试管里溶液的浓稀?【活动3】按下表数据配制3种氯化钠溶液,试判断溶液的浓稀。
【板书】一、溶液的组成与“浓”“稀”的关系:1、溶液是由溶质和溶剂组成的。
试管编号溶剂/g 溶质/g 溶液/g①8.0 2.0②18.0 2.0③38.0 2.0讨论回答:根据溶液的颜色,颜色越深,溶液越浓。
填表一定量的溶剂里,溶解的溶质越多,溶液越浓。
溶解一定时的溶质,所用的溶剂越少,溶液越浓。
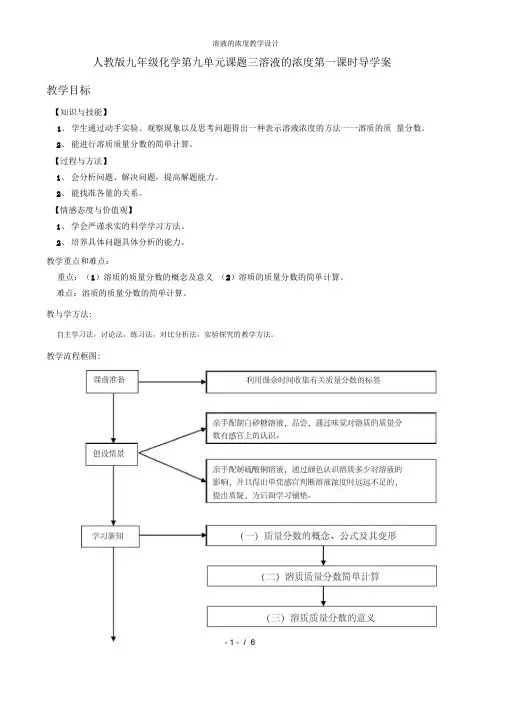
人教版九年级化学第九单元课题三溶液的浓度第一课时导学案教学目标【知识与技能】1、学生通过动手实验、观察现象以及思考问题得出一种表示溶液浓度的方法一一溶质的质量分数。
2、能进行溶质质量分数的简单计算。
【过程与方法】1、会分析问题、解决问题,提高解题能力。
2、能找准各量的关系。
【情感态度与价值观】1、学会严谨求实的科学学习方法。
2、培养具体问题具体分析的能力。
教学重点和难点:重点:(1)溶质的质量分数的概念及意义(2)溶质的质量分数的简单计算。
难点:溶质的质量分数的简单计算。
教与学方法:自主学习法,讨论法,练习法,对比分析法,实验探究的教学方法。
教学流程框图:教学过程环节溶质质量分数有关的标签。
【情景1】方法可以判断那杯白糖水溶解 的白糖多?”糖、纯净水配制一杯白糖水,倒 成两杯,一杯留着,另一杯与其 他小组交换,分别尝一尝,感觉 哪杯甜。
并且让学生表达他的感 同学发言,通过口感上的体定的认识。
教学教师活动 学生活动 设计意图1、了解无土栽培的相关知识,1、利用课余时间收集生活 充分利用课余时 课 前 准备收集相关的无土栽培营养液配 方。
2、利用课余时间收集生活中与 中见到的营养成分表标签, 与同学们交流思考这些标 签上数据的含义。
间,让同学们意识 到我们所学的内容 都与生活息息相 关,并且为本节课 的学习做好铺垫。
[引入]展示两杯白糖水。
问:“这是两杯白糖水,有什么答:喝一口,哪杯甜,它溶 解的白糖就多。
从生活中学生熟悉 的事物入手,使质 量分数这一抽象的 概念具体化。
[学生实验]每组用自带的白 将同学们分为若干小组觉。
[教师提问]你觉得自己的糖水 验,大家很容易对糖水的浓 甜,还是别人的甜?为什么会这度与溶剂溶质的关系有一 样?【情景2】[展示]两只试管乘有不同颜色的硫酸铜溶液。
冋:这是两杯硫酸铜溶液,它们是不能喝的,因为喝下去对人体有害。
那么,有什么方法判断哪只硫酸铜溶液浓呢?问:颜色深的就一定浓吗?下面我们来做个实验看看。

课题3 溶液的浓度一、教材分析溶液是常见的混合物,本单元的教学内容与学生的生活实际有紧密联系。
第三课题要紧围绕溶液的浓、稀,即一定量的溶液中含有多少溶质这一问题展开,引出溶液中溶质的质量分数的概念,并结合这一概念进行一些简单运算,初步学习配制溶质质量分数一定的溶液。
九年级的学生己具备了一定的观看问题、分析问题和解决问题的能力,对事物的认识正处于从感性到理性的转变时期,本课程的教学应联系学生思维进展规律,采纳手动实验的方法,激发学生爱好,让学生从定性到定量地认识溶液,从感性到理性地了解浓度。
二、学情分析这个年纪的学生正处于由形象思维向抽象思维的转化阶段,逻辑思维虽占优势,但很大程度上还属于经验型,需要感性经验的直接支持。
熟练掌握有关溶质质量分数与化学方程式结合的计算题,是初中化学重要的基本技能,但由于学生对溶液认识有限,对有关溶液的计算不熟悉,对化学反应前后溶液的变化不能准确掌握,使这部分内容成了学生学习的难点。
怎样突破难点,让学生深入理解和掌握这些知识,应采用“循序渐进、提高升华”的方法帮助学生理解溶质质量分数的概念,并通过自主合作实验探究,讲练结合,微课,讨论和例题等手段加深理解,学习解答化学计算题的基本规范。
三、教学目标1. 认识溶质的质量分数的含义。
2. 能进行有关溶质质量分数的简单计算。
3. 通过溶质质量分数的简单计算,掌握基本的解题方法,提高解题能力。
4. 初步学会配制一定溶质质量分数的溶液。
四、教学重难点教学重点:溶质质量分数的公式的运用和计算。
教学难点:溶质质量分数的意义的理解。
五、教学过程【情景导入】点奶茶时,你喝的是哪种甜度?标准甜,少甜,少少甜,少少少甜还是不另外加糖?【问题】在同样多的两杯水中分别溶解一汤匙糖和两汤匙糖,你能判断出哪杯水会更甜吗?【过渡】在生活中,我们有时只要大体知道溶液的浓稀就可以了,可是在实验室或科学生产中得需要确切知道溶液中含有溶质的多少,在化学中如何定量地表示溶液的浓稀呢?为了表述这个问题,人们引入了浓度这个概念,今天我们就一起来学习一下吧!【板书】溶液的浓度【过渡】在实验室中我们要经常配制溶液,下面老师来配制三种硫酸铜溶液。
课题三溶液的浓度一、对本节课的基本认识和理解
二、教与学的过程设计
三:教学反思:
本节课内容理论性较强,结构安排比较紧凑,上课之前有些许担心完不成教学任务。
好在学生们的探究欲望强烈,紧跟步伐,且基本达到了“老师引导、学生主体”的效果,也按时按量完成了教学任务,自我评价是一堂很“实在”的课!但还存在诸多不足:如“小组竞赛”部分的气氛没有达到预设的效果,“谈收获解疑问”部分,学生没有放开,没有畅所欲言,由于时间关系没有进行很好的启发就草草结束了。
在以后的课堂中一定注意改进,争取将每个环节都上到“精致”,从而提高课堂效率,更好地激发学生的学习激情!。

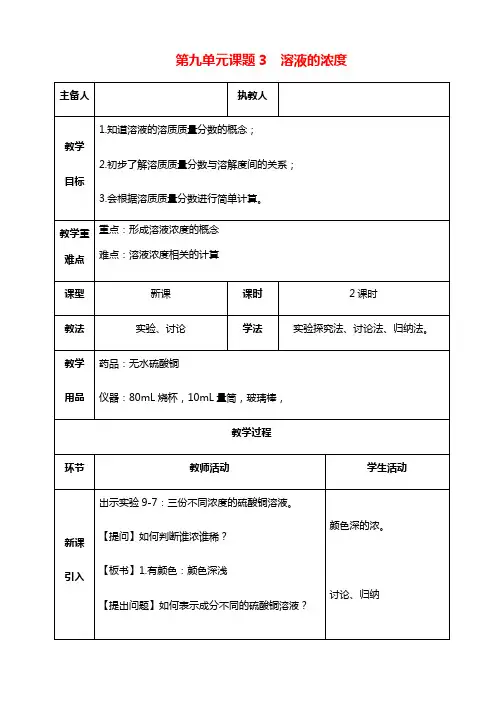
第九单元溶液课题3 溶液的浓度课程标准本节课选自人教版2012版九年级化学下册第九单元课题3溶液的浓度。
课标中要求认识溶质质量分数的含义,能配制一定溶质质量分数的溶液;能进行溶质质量分数的简单计算。
设计理念1.把教材和生活实际相结合,激发学生学习兴趣,促使学生积极参与学习。
2.发挥引导学生,促进学生的计算和独立学习能力。
教材分析1.本节课是让学生了解溶质质量分数的计算,并会进行简单的计算。
2. 这节课是在了解了溶液组成极溶解度的含义之后,从学生最熟悉的“咸”,“淡”入手,直接引出“浓”“稀”的问题。
继而以糖为例,把宏观的“甜”和糖分子联系起来。
使“浓”“稀”形象化。
在此基础上阐述溶液的组成的表示方法,使感性认识上升到理性认识,易于学生接受。
学情分析在本章以学习了溶液的特征,组成,分类,物质的溶解度等知识。
学生对溶液也有了一定的认识,又通过日常生活中溶液的例子的分析,为这节课成功做了铺垫。
学习目标1.掌握溶液浓度的表示方法----溶质的质量分数,能进行溶质的质量分数的简单计算。
2.初步学会配制一定溶质的质量分数的溶液。
教学重点:溶质的质量分数的概念和简单的计算,以及配制一定溶质的质量分数的溶液。
教学难点:溶液的溶质的质量分数的概念的引入。
教学准备:相关的课件,有关实验药品教学方法:讲授法实验法合作学习法讨论法课时建议: 2课时学习过程:复习回顾1、什么叫饱和溶液?2、KNO3不饱和溶液怎样变成饱和溶液?3、Ca(OH)2饱和溶液怎样变成不饱和溶液?4浓溶液和稀溶液判断依据:一定量溶液里,所含溶质的多少思考:溶液的浓稀和溶液的饱和是否有关系☆同一温度时,同一溶质的饱和溶液肯定比不饱和溶液浓导入新课:根据生活常识,在两杯相同质量的水中,一杯加一匙糖,另一杯加两匙糖,完全溶解后,哪一杯甜一些呢?(教师活动):演示实验在三支试管中各加入20mL 水,然后分别加入约0.5g 、1g 、2g 固体硫酸铜。
完全溶解后,比较三种溶液的颜色。
第九单元课题3 溶液的浓度
知识点一溶质质量分数的概念
【讨论】浓度是否只和溶质质量或溶液质量相关?【引导回答】一定量的溶液中溶质越多,溶液越浓。
【归纳】给出定义式
溶质的质量分数= ×100%
【讨论与交流】
①生理盐水中氯化钠的质量分数为0.9%,它的含义是什么?
②某硫酸钠溶液中硫酸钠的质量分数为38%,下列描述正确的是()
A.每100 g的溶液里有硫酸钠38 g。
B.每100 ml的溶液里有硫酸钠38 ml。
【要求】根据公式尝试完成P42实验9-7的表格
找出计算的关键。
思考、回答:不变,溶液是均一稳定的混合物
否,最多26.5%
阅读,并找到溶液稀释前后,溶质的质量不变。
听、看、记
动笔计算
回答。
说明理由,100g稀。

人教版九年级下册化学教案: 9.3溶液的浓度(第一课时)1. 教学目标•理解溶液的浓度的概念;•掌握计算溶液的浓度的方法;•能够应用浓度计算相关问题。
2. 教学重点•溶液的浓度概念的理解;•溶液浓度的计算方法。
3. 教学难点•复杂情况下的溶液浓度计算;•计算中的单位换算。
4. 教学过程4.1 导入(5分钟)通过提问学生对于溶液的浓度的认识,引导学生了解溶液的浓度概念,例如:什么是溶液的浓度?浓溶液与稀溶液有何区别?4.2 提出问题(10分钟)提出一个具体的问题:如果将10克食盐溶解在100毫升水中,求溶液的浓度。
4.3 计算方法(15分钟)•引导学生理解溶液的浓度定义:溶质质量与溶液体积的比值;•根据问题中的数据,计算出溶质的质量为10克,溶液的体积为100毫升;•将溶质质量和溶液体积的比值带入浓度的计算公式:浓度 = 溶质质量 / 溶液体积;•按照计算公式计算出溶液的浓度为10克/100毫升。
4.4 单位换算(10分钟)•引导学生理解质量单位的换算关系:1克 = 1000毫克;•将溶质质量换算成毫克:10克 = 10 * 1000毫克 = 10000毫克;•将体积单位换算成升:100毫升 = 100 / 1000升 = 0.1升;•根据换算后的数据,重新计算溶液的浓度:浓度 = 10000毫克 / 0.1升 = 100000毫克/升。
4.5 实际应用(10分钟)提出一个实际应用问题:如果需要制备0.05克/毫升的盐酸溶液,需要多少克的盐酸溶解在100毫升水中?通过引导学生按照题目中的需求,使用溶液浓度的计算公式进行计算,得出所需溶质质量。
4.6 拓展应用(15分钟)提供更复杂的溶液浓度计算问题,引导学生应用所学知识解决问题。
4.7 小结(5分钟)对本节课所学内容进行总结,强化学生对于溶液浓度的理解和计算方法。
5. 课后作业•用不同的方法计算出下列溶液的浓度:–将5克NaOH溶解在200毫升水中;–将20克蔗糖溶解在400毫升水中。
人教版化学九年级下册第九单元课题3溶液的浓度教案课题3溶液的浓度第1课时一、溶质的质量分数1.定义:溶质的质量与溶液的质量之比.2.定义式:溶质的质量分数=溶质质量×100%.溶液质量二、溶液中溶质质量分数的计算1.已知溶质和溶剂的质量,求溶质的质量分数.2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质量.溶质质量=溶液质量×溶质的质量分数.溶液质量=溶质质量+溶剂质量.一、教材作业【必做题】教材第45页练习与应用的4、7题.【选做题】教材第45页练习与应用的1、2 题. 二、课后作业【基础巩固】逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 ( )5.下列条件中的氢氧化钙溶液,质量分数最大的是 ( ) A.30 ℃的不饱和溶液 B.30 ℃的饱和溶液 C.90 ℃的不饱和溶液 D.90 ℃的饱和溶液 【拓展探究】6.(平凉中考)下图是a 、b 、c 三种物质的溶解度曲线,回答下列问题: (1)P 点的含义是 . (2)t 2 ℃时,将50 g a 物质放入50 g 水中充分溶解得到溶液的质量为 g. (3)将t 2 ℃时,a 、b 、c 三种物质的饱和溶液降温到t 1 ℃,所得溶液中溶质的质量分数由大到小的顺序是 . (4)t 1 ℃时,将盛有c 的饱和溶液的小试管放入盛水的烧杯中(如图),向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,原因是 . 【答案与解析】1.B (解析:所得溶液中溶质质量分数=100 g×10%+12.5 g100 g+12.5 g ×100%=20%.)2.B (解析:溶液具有均一性,从200 g 饱和硝酸钾溶液中取出5 g 溶液,溶液中溶质和溶液的比值不变,溶质质量分数不变,溶液的密度不变,由于取出5 g 溶液,故溶质质量和溶剂质量减少,③④不变.)3.D (解析:NaOH 固体的质量等于NaOH 溶液的质量乘以溶质的质量分数,故需称取NaOH 固体的质量为1000 g×5%=50 g.)4.D (解析:硝酸钾的溶解度随着温度的升高而增大,随着温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液的质量减小;析出硝酸钾晶体的质量应该从零开始;溶剂的质量不变;溶液中溶质的质量减小,溶剂的质量不变,溶质质量分数逐渐减小.故答案为:D.)5.B (解析:根据相同温度下同种物质的饱和溶液的质量分数大于不饱和溶液的质量分数,可判断30 ℃时氢氧化钙的不饱和溶液的溶质质量分数小于饱和溶液的溶质质量分数;同理,90 ℃时氢氧化钙的不饱和溶液的溶质质量分数小于饱和溶液的溶质质量分数;根据氢氧化钙溶解度随温度升高而减小,可判断90 ℃时氢氧化钙的饱和溶液的溶质质量分数小于30 ℃时氢氧化钙的饱和溶液的溶质质量分数.)6.(1)在t 1 ℃时,a 、c 两物质的溶解度相同 (2)75 (3)b>a>c (4)氢氧化钠固体溶于水,放热大于吸热,溶液温度升高,c 物质的溶解度减小,析出晶体(解析:(1)据图可以看出,P 点时a 、c 相交于一点,表示在t 1 ℃时,a 与c 的溶解度相同;(2)t 2 ℃时,a 物质的溶解度是50 g ,将50 g a 物质放入50 g 水中充分溶解只能溶解25 g ,得到溶液的质量为75 g ;(3)将t 2 ℃时,a 、b 、c 三种物质的饱和溶液降温至t 1 ℃,a 、b 物质的溶解度随温度的降低而减小,析出晶体,仍然是饱和溶液,且在此温度下b 的溶解度大于a ,故b 的质量分数大于a ,而c 物质的溶解度随温度的降低而增大,溶液组成不变,溶质质量分数与t 2 ℃时相同,据图可以看出小于a ;(4)t 1 ℃时,将盛有c 的饱和溶液的小试管放入盛水的烧杯中,向水中加入一定量的氢氧化钠固体后,试管中的溶液变浑浊,说明有固体析出,原因是氢氧化钠溶于水放出热量,温度升高,c 物质的溶解度随温度的升高而减小的缘故.) 本节课的教学思路清晰,教师通过创设真实的问题情境,启发引导学生自主学习,其主要特色如下: ①以“死海”的真实情景导入,未成曲调先有情; ②在几个教学环节的过渡中,有“嫁与春风不用媒”的效果; ③教学过程中,注重联系生活实际和溶液的组成知识,运用了生活中的物品实例教学,并要求学生亲自动手实验探究,体现了学生的主体作用,在实践操作中学生初步掌握了一些基本的操作及知识.在此基础上引出溶液的质量分数的概念,并与以前所学质量分数建立联系,深化学生对概念的理解,为学生对质量分数的计算的学习打下基础.收到了“似曾相识燕归来”的效果,让学生学得轻松,学得愉快. ④在设计反馈练习时,让学生的理解和应用等各方面的能力都得到了训练和提升. 建议:关于溶液中溶质的质量分数的教学是初中教学的一个重点.可以增设演示实验并组织学生参与,充分调动学生的学习积极性,激发学习兴趣. 1.溶液的浓度 几种溶液中溶质的质量分数与溶液密度的对照表.(在20 ℃时) HCl HNO 3 H 2SO 4 HAc NaO H NH 3·H 2O KCl KNO 3 NaC l NH 4N O 3 1% 1.0032 1.0036 1.0051 0.9996 1.0095 0.9939 1.0046 1.0045 1.0053 1.0023 2% 1.0082 1.0091 1.0118 1.0012 1.0207 0.9905 1.0110 1.0108 1.0125 1.0064 4% 1.0181 1.0201 1.0250 1.0040 1.0428 0.9811 1.0239 1.0234 1.0268 1.0147 6% 1.0279 1.0301 1.0385 1.0069 1.0648 0.9730 1.0369 1.0363 1.0413 1.0230 8% 1.0376 1.0427 1.0522 1.0097 1.0869 0.9651 1.0500 1.0494 1.0559 1.0313 10% 1.0476 1.0543 1.0661 1.0125 1.1089 0.9575 1.0633 1.0627 1.0707 1.0397 12% 1.0574 1.0661 1.0802 1.0154 1.1309 0.9501 1.0768 1.0762 1.0857 1.0482 14% 1.0673 1.0781 1.0947 1.0182 1.1530 0.9430 1.0905 1.0899 1.1009 1.0567 161.01.01.11.01.10.931.11.11.11.0% 776 903 094 209 751 62 043 039 162 653 18% 1.0878 1.1026 1.1243 1.0236 1.1972 0.9295 1.1185 1.1181 1.1319 1.0740 20% 1.0980 1.1150 1.1394 1.0263 1.2191 0.9229 1.1328 1.1326 1.1478 1.0828 25% - 1.1469 1.1783 1.0326 - - 1.1623 - - - 30% 1.1492 1.1800 1.2185 1.0384 1.3279 0.8920 - - - 1.1277 40% 1.1980 1.2463 1.3028 1.0488 1.4300 - - - - 1.1754 50% - 1.3100 1.3951 1.0575 1.5253 - - - - 1.2258 60% - 1.3667 1.4983 1.0642 - - - - - - 70% 1.4134 1.6105 1.0685 - - - - - - 80% - - 1.7272 1.0700 - - - - - - 90% - - 1.8144 - - - - - - - 95% - - 1.8337 - - - - - - - 2.关于溶液稀释或增浓的计算 (1)关于溶液稀释的计算 因为溶液稀释前后,溶质的质量不变,所以若设浓溶液质量为A g ,溶质的质量分数为a %,加水稀释成溶质的质量分数为b %的稀溶液B g ,则A g×a %=B g×b %(其中B =A +m 水). (2)关于溶液增浓(无溶质析出)的计算 溶液增浓通常有几种情况: ①向原溶液中添加溶质: 因为溶液增加溶质前后,溶剂的质量不变.增加溶质后,溶液中溶质的质量=原溶液中溶质的质量+增加的溶质的质量,而溶液的质量=原溶液的质量+增加的溶质的质量.所以,若设原溶液质量为A g ,溶质的质量分数为a %,加溶质B g 后变成溶质的质量分数为b %的溶液,则A g×a %+B g=(A g+B g )×b %. ②将原溶液蒸发掉部分溶剂 因为溶液蒸发溶剂前后,溶质的质量不变.所以,若设原溶液质量为A g ,溶质的质量分数为a %,蒸发B g 水后变成溶质的质量分数为b %的溶液,则:A g×a %=(A g-B g )×b %. ③与浓溶液混合 因为混合后的溶液的总质量等于两混合组分溶液的质量之和,混合后的溶液中溶质质量等于两混合组分的溶质质量之和,所以,设原溶液质量为A g ,溶质的质量分数为a %,浓溶液质量为B g ,溶质的质量分数为b %,两溶液混合后得到溶质的质量分数为c %的溶液,则:A g×a %+B g×b %=(A g+B g )×c %. 3.关于溶质质量分数运用于化学方程式的计算: 解这类问题时要注意: (1)化学方程式下相对应的物质质量不能直接写溶液质量,而要写参加化学反应的溶质实际质量. (2)若已知溶液的体积或求溶液的体积,要用m=ρV 这个公式进行换算. (3)单位要统一.4.关于溶液中溶质的质量分数计算的具体情况(1)若溶质全部溶于水,且不与水发生化学反应,直接利用溶质质量分数计算公式进行计算.(2)若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算.(3)若溶质溶于水时与水发生了化学反应,则溶液中的溶质就为反应后的生成物了.(4)若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量.因为结晶水合物溶于水时,结晶水就转化为溶液中的溶剂了.(5)关于酸、碱、盐溶液间发生1~2个化学反应,求反应后所得溶液的溶质质量分数问题的计算.首先要明确生成的溶液中溶质是什么,其次再通过化学反应计算溶质质量是多少(往往溶质质量由几个部分组成),最后分析各量间关系求出溶液总质量,再运用公式计算出反应后溶液中溶质的质量分数.第课时1.会计算一定质量分数的溶液中溶质和溶剂的质量.2.能解决溶液稀释过程中的有关计算.通过溶液的稀释计算和关于化学方程式的综合计算,提高学生的分析能力和计算能力.学习计算过程中,了解溶液与生产生活的联系,体会到化学与生活生产的关系.【重点】一定质量分数溶液的配制步骤、稀释问题的计算方法.【难点】稀释过程中溶液变化的分析.【教师准备】实验教具:多媒体、玻璃棒、烧杯、量筒、托盘天平等;化学药品:氯化钠、水. 【学生准备】预习教材44页的【例题2】. 导入一:【提问】生活中所存在的溶液的质量分数不一定就是你所要的那个浓度.比如周末你打完球回到家,你妈妈给你配制了一杯盐水给你喝了一口感觉太咸了,会怎么办?加水.这个行为在化学里就叫做溶液的稀释,那在稀释前后溶液里哪些量是不变的呢?导入二:【展示】《煮粥诗》:“煮饭何如煮粥强,好同儿女细商量.一升可作三升用,两日堪为六日粮.有客只需添水火,无钱不必问羹汤.莫言淡泊少滋味,淡泊之中滋味长.”【讲解】粥是我们正常饮食里经常遇到的一种食品.不但大家都吃过粥,而且还将继续“捧碗而啜”地吃下去.你可不要小瞧了这被称为“稀饭”的粥.粥中加水后,米粒不变,粥变得更稀.类似的现象如在菜汤中加水,汤中食盐质量不变,汤的味道变淡.这种现象与溶液的稀释相似. 三、溶液稀释和配制问题的计算[过渡语]在化学实验里也常遇到这种类似的情况,我们要将浓的溶液稀释成所需要的稀溶液,需要向浓溶液中加水,如何计算稀释过程中需要加入水的质量呢?如何计算稀释前后溶液的质量分数呢?在这个计算过程中只要抓住稀释前后的溶质质量不变就可以了.思路一【展示例1】将1 g食盐放入烧杯中,再加入9 mL水,用玻璃棒搅拌,至溶解.再向上述烧杯中加入10 mL水,搅拌.(水的密度为1 g/cm3)【提问】1.试分别写出稀释前后溶质质量、溶液质量、溶质质量分数.2.分析各量的变化情况.溶液稀释问题解题的关键是什么?【讨论交流】1.稀释前溶质质量是1 g,溶液质量是9 g,溶质质量分数为10%;稀释后溶质的质量是 1 g,溶液质量是20 g,溶质质量分数是5%.2.稀释后溶液质量增加,溶质质量分数减小,溶质质量不变.【解题关键】稀释前溶质的质量=稀释后溶质的质量.【展示例2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液.要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?【设问】根据稀释前后溶质的质量相等,怎样列出计算的方程式?【提示】若设需要加入水的质量为x,请同学们列出方程式.【学生活动】50 g×98%=(50 g+x)×20%.【解析】一名学生板演,其余学生在本上练习,教师强调解题格式.解法1:设需加水的质量为x.50 g×98%=(50 g+x)×20%,x=195 g.答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水195 g.【提示】若设稀释后溶液的质量为x,请同学列出方程式.【学生活动】解:设稀释后溶液的质量为x.50 g×98%=x×20%,x=245 g,245 g-50 g=195g.答:把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液需加水195 g.【课堂练习】1.把200 g 20%的食盐水溶液稀释成10%的溶液需加水多少克?2.把30 g质量分数为20%的氢氧化钠溶液加水稀释到100 g.此溶液中氢氧化钠的质量分数为多少?【讨论交流】1.200 g. 2.6%.【展示】某工厂化验室配制5000 g 20%的盐酸,需38%的盐酸(密度为1.19 g/cm3)多少毫升?【提问】此题与上述练习题有何异同?能否用体积直接带入公式进行计算?【回答】1.相同点都是溶液稀释问题.不同点是上述练习题中已知和求都是指质量,而此题是已知质量求体积.2.溶质的质量分数是质量比不能用体积直接带入公式计算.【提问】已知溶液体积、溶液密度、溶质质量分数,你能否写出求溶质质量的计算公式?【回答并板书】溶质质量=溶液体积×溶液密度×溶质的质量分数.【设问】根据上述公式,并根据稀释前后溶质质量相等,你能否列出方程式?解:设需38%的盐酸体积为x.5000 g×20%=1.19 g/cm3×x×38%,x≈2211 mL.答:需38%的盐酸2211 mL.思路二【自主学习】阅读教材44页【例题2】.【展示例题2】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?【讨论】解这道题的关键是什么?【分析】抓住关键:.【点拨】解法1:设稀释后溶液的质量为x.50 g×98%=x×20%,x=245 g.245 g-50 g=195 g.解法2:设把50克98%的浓硫酸稀释成20%的稀硫酸需要加水的质量为x,则稀释后溶液的质量为(50克+x),根据稀释前后溶液中溶质的质量不变得:50克×98%=(50克+x)×20%解得:x=195克.答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克.【讨论】课本的解法和老师的解法有什么不同?你习惯哪种解法?【拓展】如果把50 g换成50 mL,那么还需什么条件才能解题?【点拨】涉及体积时:溶质质量=溶液体积×溶液密度×溶质的质量分数.【展示例题3】配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升?(质量分数为20%的硫酸溶液密度为1.14 g/mL,质量分数为98%的浓硫酸密度为1.84g/mL).解:设配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸的体积为x,根据稀释前后溶液中溶质的质量不变得:500 mL×1.14g/mL×20%=x×1.84 g/mL×98%.解得:x≈63.2 mL.答:配制500 mL质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸63.2 mL.【分析】将溶质质量分数公式和密度公式综合起来解题.四、把溶质的质量分数运用于化学方程式的计算[过渡语]我们学习了有关溶液的稀释问题,在实际应用中我们还会遇到溶液间化学反应的问题,需要用化学方程式解决溶质质量分数的计算问题.思路一【展示】 100 g 某硫酸溶液恰好与13 g锌完全反应.试计算这种硫酸中溶质的质量分数.【提问】 与锌反应的是硫酸溶液中的哪种成分(溶质、溶剂、溶液)?【讨论交流】 溶质与锌发生化学反应.【讨论】 解出此题的关键是什么?【总结】 关键是利用化学方程式先求出硫酸溶液中溶质的质量.【引言】 根据以上分析,求解此题.解:设100 g 硫酸溶液中溶质质量为x .Zn+H 2SO 4ZnSO 4+H 2↑65 9813 g x6513 g =98x,x =19.6 g. 溶质的质量分数=溶质质量溶液质量×100%=19.6 g 100 g ×100%=19.6%.答:这种硫酸中溶质的质量分数为19.6%.思路二【引入】化学反应经常在溶液中进行,参加化学反应的多数是溶液中的溶质,溶剂一般不参加化学反应,如何用化学方程式解决溶质质量分数的计算问题.请看例题.【展示例题】12克Mg条与100克稀H2SO4恰好完全反应,则该硫酸中溶质的质量是克,原硫酸溶液中溶质的质量分数是.生成物溶液中溶质的化学式是.生成物溶液的溶质质量分数是.【分析】Mg+H2SO4MgSO4+ H2↑24 98 120 2 12 g z x y 24∶98 =12 g∶z,解得z=49 g. 24∶120=12g∶x,解得x=60 g. 24∶2=12g∶y,解得y=1 g.因12克Mg条与100克稀硫酸恰好完全反应,生成的氢气逸散到空气中,故生成的溶液为MgSO4溶液,其质量为12克镁条+100克稀硫酸-氢气质量=111克.×100%≈MgSO溶液溶质的质量分数=60g4111g54.05%.【小结】对学生的板演进行评价,引导学生归纳计算步骤.[知识拓展]1.溶液的稀释根据稀释前后溶质的总量不变进行运算,无论是用水,或是用稀溶液来稀释浓溶液,都可计算.(1)用水稀释浓溶液设稀释前的浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%,则可得m×a%=(m+n)×b%.(2)用稀溶液稀释浓溶液设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两溶液混合后的溶质的质量分数为c%.则可得A×a%+B×b%=(A+B)×c%或AB =c%-b%a%-c%.为了便于记忆和运算,可列成十字交叉图示如下:A B =c%-b%a%-c%这种运算方法叫十字交叉法.例:利用95%的浓硫酸和5%的稀硫酸配制成30%的硫酸溶液2019 g,问需这两种溶液各多少克?解:所以AB =2565=513.这里表明,5份重的95% H2SO4溶液和13份重的5% H2SO4溶液混合,可配得5+13=18份重的30%的H2SO4溶液.故可得,95% H2SO4溶液的用量为:2019 g×518≈555.6 g,5% H2SO4溶液的用量为:2019 g×1318≈1444.4 g.溶液的稀释与浓缩:方法计算依据计算公式溶液的稀释①加水稀释②加稀溶液稀释①加水稀释前后,溶液中溶质的质量不变②用稀溶液稀释浓溶液时,稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量加水稀释:稀释前后溶液中溶质的质量不变m浓×ω浓%=(m浓+m水)×ω稀%溶液的浓缩①添加溶质②蒸发溶剂③加入浓溶液①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出)③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀%注意:a.几种溶液混合,溶液的体积不能简单相加,即V总≠V A+V B.b.混合后溶液的质量、溶质的质量可以相加,即m总=m A+m B.c.要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积.1.(广州中考)将50 g 98%的浓硫酸溶于450 g水中,所得溶液中溶质的质量分数为()A.9.8%B.10.2%C.10.8%D.19.6%解析:将50 g 98%的浓硫酸溶于450 g水中,所得溶液中溶质的质量分数为50g×98%×100%=9.8%.50g+450g故答案为A.2.向一定质量分数的KNO3溶液中逐渐加水稀释,下列图像中符合此溶液中溶质质量变化规律的是()解析:溶液稀释前后,溶质的质量不变,则向一定质量分数的KNO3溶液中逐渐加水稀释,溶质的质量不变.图像应该成一条水平直线,故D图像与实验操作过程对应一致.故答案为D.3.(大庆中考)某溶液溶质的质量分数为20%,加入50 g水后变为10%,稀释后溶液中溶质的质量是()A.50 gB.10 gC.100 gD.40 g解析:设稀释前溶液的质量为x,根据溶液稀释前后,溶质的质量不变,则x×20%=(x+50 g)×10%,x=50 g.溶液稀释前后,溶质的质量不变,则稀释后溶液中溶质的质量是50 g×20%=10 g.故答案为:B.4.汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:(1)需要630克稀硫酸的体积是多少毫升?(2)需要浓硫酸多少克?解析:(1)630克稀硫酸的体积是:630克÷1.2克/厘米3=525厘米3,即525毫升;(2)要配制的28%的硫酸其溶质来源于98%的浓硫酸,则需要浓硫酸的质量是:630克×28%÷98%=180克.故答案为:(1)需要630克稀硫酸的体积是525毫升.(2)配制这种稀硫酸630克需要浓硫酸的质量是180克.5.(泉州中考)农业生产上通常用溶质质量分数为10%~20%的食盐溶液来选种.(1)现要配制120 kg溶质质量分数为20%的食盐溶液,需要取用固体食盐kg;(2)用60 kg溶质质量分数为20%的食盐溶液,可稀释成12%的食盐溶液kg.解析:(1)溶质的质量=溶液的质量×溶质的质量分数,120 kg×20%=24 kg;(2)设质量分数为12%的溶液的质量为z,则20%的溶液中的溶质与12%的溶液中的溶质相等,则60 kg×20%=z×12%,z=100 kg.故答案为:(1)24 (2)100第2课时三、溶液稀释和配制问题的计算关键:稀释前溶质的质量=稀释后溶质的质量涉及体积时:溶质质量=溶液体积×溶液密度×溶质的质量分数四、溶质的质量分数应用于化学方程式的计算参加化学反应的是溶液中的溶质.一、教材作业【必做题】教材第45页练习与应用的3、6题.【选做题】教材第45页练习与应用的5、8题. 二、课后作业【基础巩固】1.用60%浓硫酸A与20%稀硫酸B来配制30%硫酸溶液,所用溶液A、B的质量比为()A.2∶1B.1∶2C.3∶1D.1∶32.如要将100 g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为()A.50 gB.90 gC.100 gD.200 g3.向100 g 20%的氯化钠溶液中加入100 g水,稀释后溶液中溶质的质量分数是()A.2.5%B.5%C.10%D.20%4.某同学用25 ℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解.然后该同学又用酒精灯加热至60 ℃,固体全部溶解.那么在加热前后,以下各量没有发生改变的是()A.NaCl的溶解度B.溶质的质量C.溶剂的质量D.溶质的质量分数5.电解水时,常在水中加入少量的硫酸以增强水的导电性,现用25 g溶质质量分数为8%的硫酸溶液进行电解的实验,过一段时间后,测得硫酸溶液中溶质质量分数为10%,则被电解的水的质量为()A.1 gB.2 gC.3 gD.5 g6.有100 g 10%的盐酸溶液(氯化氢气体的水溶液),要使其溶质质量分数增大一倍,应采取的方法是()A.把溶液的量倒掉一半B.溶质的质量增大一倍C.将100 g 10%的盐酸与200 g 25%的盐酸混合D.蒸发掉溶剂的质量是原溶液质量的一半【能力提升】7.(株洲中考)化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸.请回答下列问题:(1)上述浓硫酸中溶剂的质量分数是.(2)要把50 g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?(请写出计算过程)【拓展探究】8.(黔东南中考)某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求: (1)铜锌合金中,Zn的质量分数是.(2)所用稀硫酸溶液中溶质的质量分数是多少?【答案与解析】1.D(解析:设需60%浓硫酸的质量为x,需要20%硫酸溶液的质量为y,则:x×60%+y×20%=(x+y)×30%,解得x∶y=1∶3.)2.C(解析:设需要加入水的质量为x,100 g×20%=(100 g+x)×10%,x=100 g.)3.C(解析:稀释后溶液中溶质的质量分数是:100g×20%×100%=10%.)100g+100g4.C(解析:依据加热到60 ℃时没有溶解的氯化钠全部溶解可知,加热后氯化钠的溶解度增大了;加热前后物质在溶液中溶解的氯化钠质量变大了,所以溶质的质量增加了;由题干可知加热前后水的质量基本不变,所以溶剂的质量没有发生变化;加热后溶液中溶解的溶质变多,所以溶液变浓,溶质的质量分数变大了.)5.D(解析:由题意知,设电解水的质量为x,列式×100%=10%,解得x=5 g,所以电解水的质量为:25×8%25-x为5 g.)6.C(解析:溶液具有均一性,把溶液的量倒掉一半,其溶质质量分数不变;根据溶质质量分数×100%可知,溶质的质量增大一倍,因溶液的=溶质质量溶液质量质量也增加,因此溶质质量分数增大不到一倍;将100 g 10%的盐酸与200 g 25%的盐酸混合,溶质×100%=20%;蒸发时先挥发质量分数为100g×10%+200g×25%100g+200g出来的是氯化氢气体,故D错误.)7.(1)2%(2)设稀释后溶液的质量为x.50 g×98%=x×10%,x=50g×98%=490 g,需要水的质量=49010%g-50 g=440 g.答:要把50 g 质量分数为98%的浓硫酸稀释成质量分数为10%的硫酸需要水440 g.(解析:(1)上述浓硫酸中溶剂的质量分数是:100%-98%=2%.)8.(1)65% (2)所用稀硫酸溶液中溶质的质量分数为:9.8 g50 g ×100%=19.6%.(解析:设反应中消耗稀硫酸溶液中溶质的质量为x ,则:Zn+H 2SO 4ZnSO 4+H 265 986.5 g x656.5 g =98x,解得x =9.8 g.) 本节课从学生熟悉的生活入手,把枯燥的计算演绎成学生的实验、生活体验,用一系列教学活动来激发学生兴趣,点拨思维、总结方法,既丰富了溶质质量分数计算的化学意义,又做到了讲练结合、落实基础.溶质质量分数是比较抽象的概念,引入和过渡都是以生活中学生比较熟悉的生活现象和行为开始,达到以生活实际为基础,以计算为载体,实现化学理论与实际相联系的教学目标.体现了知识与生活的联系,如课堂提到的生理盐水等.课程教学中以“先学后教,当堂训练”的教学模式,如计算题,让有错误的学生上黑板板书,起到学生教学生的作用,体现了学生为主.关注了化学知识和生活的联系,还关注了学生的发展需求.练习与应用(教材第45页)1.(1)饱和(2)31.6 g (3)24%2.20%.(解析:7g×100%=20%.)35g3.880 g.(解析:设需要水的质量为m,则100 g×98%=(100 g+m)×10%,解得m=880 g.)4.55 g ;495 g.(解析:需氢氧化钠的质量=500 mL×1.1 g/cm 3×10%=55 g ,需水的质量=500 mL×1.1 g/cm 3×(1-10%)=495 g.)5.19.6%.(解析:设100 g 这种硫酸中溶质的质量为m ,则:Zn+H 2SO 4ZnSO 4+H 2↑6513 g 98m6513 g =98m,解得m =19.6 g. 这种硫酸中溶质的质量分数为19.6 g100 g ×100%=19.6%.)6.8.8 g ;4.45 L.(解析:设生成二氧化碳的质量为m ,则:CaCO 3+2HCl CaCl 2+H 2O+CO 2↑7373 g×20% 44m7373 g×20%=44m,解得m =8.8 g. 生成二氧化碳的体积为8.8 g1.977 g ·L -1≈4.45 L.)7.67.5 t~81 t.(解析:每月消耗氯化钠的质量最少为15 t×15%×30=67.5t,最多为15 t×18%×30=81 t.)8.(1)0.05%. (2)2019 mL.(解析:(1)1.0 mL 溶液d中溶质的质量为:1.0g4.0×10×10×5=0.0005 g,溶液d中溶质的质量分数为:0.0005g1.0mL×1g·cm-3×100%=0.05%.(2)1.0 g该药品可配制溶液d的体积为:1.0g0.0005g·mL-1=2019 mL.)1.溶液计算中的常见方法与技巧汇总关于溶液的计算是初中化学计算的重要组成部分,其题型众多,解题方法也多,现将一些主要的解题方法与技巧汇总如下:(1)隔离法隔离法就是通过分析,将某一份溶液(一个整体)分割成两个部分,或者将某一个完整的过程,分割成两个或多个过程,然后进行计算的方法.一定温度下,向某硝酸钾溶液中加入4。
9.3 溶液的浓度(第2课时) 学习目标 知识与技能1. 会配制一定溶质质量分数的溶液,(重点)会对结果进行误差分析.(难点)2.会结合溶解度曲线图进行质量分数的计算和判断(重难点)过程与方法:通过氯化钠溶液的配制,加深对溶质质量分数的理解情感态度与价值观:体会化学来源于生活,服务于生活二、溶解度与质量分数的应用 典型例题1: 1、20℃时,NaCl 的溶解度为36克,含义是_________________________________.则该温度下溶质的质量分数是_______。
2、在20℃时,食盐溶解度是36g 。
在此温度时,将25g 食盐放入50g 水中,则所得溶液中溶质的质量分数是_______。
规律小结:利用溶解度计算质量分数时注意:溶解度是该温度下溶解溶质的_______值. 学以致用:1、一定温度时,某物质的溶解度为αg ,形成的饱和溶液中溶质的质量分数为b%,则a 与b 的大小关系为 ( ) A.a 大于b B. a 等于b C. a 小于b D.无法判断 2、60℃时,50gH 2O 中最多溶解55gKNO 3。
若把60℃时的210gKNO 3饱和溶液蒸发掉50gH 2O 后,再降到60℃,则析出晶体后溶液中溶质质量分数是 .典型例题2:右下图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:(1)随着温度的升高其溶解度反而减小的是___________;在______℃时,甲与丙的溶解度相等。
(2)t 3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的 质量之比为__________。
(3)t 1℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是________________(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示)。
⑷ ①t 3℃时甲的饱和溶液降温到t 1℃时,其溶质质量分数将____(填“变大、变小或不变”下同) ② t 1℃时甲的饱和溶液升温到t 3℃时,其溶质质量分数将_____.⑸ ①t 3℃时丙的饱和溶液降温到t 1℃时,其溶质质量分数将_____.(同上)一、一定溶质质量分数溶液的配制学以致用3 配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是 ( )A.③④①②⑤B.①②③④⑤C.④⑤①②③D.②①④③⑤ 1、若配制150g 质量分数为10%的氢氧化钠溶液。
课题3《溶液浓度》教案
[讨论]在上述活动探究中,三种溶液中溶质的质量分数各是多少?把计算结果填在上表的空栏中。
[学生活动]
[汇报结果]三种溶液中溶质的质量分数为:
1.溶质的质量分数为:×100%≈4.8%。
2.溶质的质量分数为:×100%≈9.1%。
3.溶质的质量分数为:×100%≈13%。
[过渡]根据以上所学,同学们练习配制两杯简单的溶液,并用溶质的质量分数进行比较。
[活动与探究](投影展示)
按下表所定的量配制氯化钠溶液(ρ水=1 g·cm-3)
溶质质量/g 溶剂质量/g 溶质的质量分数
10 90
20 80
[交流实验结果]
(1) ×100%=10%。
(2) ×100%=20%。
[思考]对两氯化钠溶液而言,能否通过颜色判断溶液的浓稀呢?我们通常采用什么办法比较溶液的浓稀呢?
[学生发言]1.氯化钠溶液是无色溶液,无法通过肉眼观察确定溶液的依稀。
2.可通过计算溶质的质量分数来比较各溶液浓度的大小。
[教师小结]溶质的质量分数能准确地表示某溶液的组成,也能比较不同溶液浓度的大小,对生产、生活有很大的作用。
[引导]请同学们总结上述活动中涉及了有关溶质质量分数的哪类计算。
例1.在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。
现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
[讨论]1.溶质质量与溶质质量分数、溶液质量的关系。
进行溶质质量分数的简单计算,进一步理解溶液的溶质质量分数
培养学生的分析问题和解题能力
2.溶液质量、溶质质量、溶剂质量的关系。
[引入]溶质的质量分数在实际生活中应用广泛,而在实际生产中又往往需要把现有的溶液中溶质的质量分数增大或减小呢。
[讨论]在温度不变的条件下,如何使原有溶液的溶质质量分数增大或减小?
反思质疑:
[讨论]1.原溶液中溶质的质量是多少?溶液的质量是多少?溶剂的质量是多少?
2.向原溶液中增加10克硝酸钾(全部溶解)或增加10克水后,溶液中溶质质量、溶剂质量、溶液质量各是多少?
3.上述形成的两种溶液中溶质的质量分数各是多少?
随堂检测:
在40克溶质的质量分数为15%的硝酸钾不饱和溶液中,加入10克硝酸钾或10克水,计算所得溶液中溶质的质量分数。
加深对溶质质量分数计算的理解
通过质疑加深理解
板书
课题3 溶质的质量分数一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.定义式:溶质的质量分数=×100%二、溶液中溶质质量分数的计算
教学后记
课题3 溶质的质量分数(第二课时)
学习目标:
1.掌握一种溶液组成的表示方法-------溶质的质量分数,能进行溶质质量分数的简单计算2.能进行溶质质量分数和化学方程式混合的简单综合计算。
教学重点
溶液的溶质质量分数简单的计算以及溶质质量分数和化学方程式混合的综合计算。
教学难点
溶液的溶质质量分数和化学方程式混合的综合计算。
教学程序
【提问】
1.什么是溶质的质量分数?它的计算公式是什么?
2.如何配制一定量的溶质质量分数一定的溶液?
【投影】例题2:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?分析、讨论、交流、发言,寻找方法,尝试解题。
【讨论】解这道题的关键是什么?
【分析】抓住关键:溶液稀释(或浓缩)前后溶质的质量不变。
学生板演。
评价解题的正确性,并讨论,形成一致意见。
结合教师给出的条件解题。
【又问】如果把50g换成50mL,那么还需要什么条件才能解题?
【投影】例题3:100g某稀盐酸溶液与25g碳酸钙完全反应。
试计算这种稀盐酸溶液中溶质的质量分数。
读题、审题、讨论、寻找题中的相关量。
思考如何把有关化学方程式的计算和溶液中溶质的质量分数的计算结合起来。
结合讨论进行解题。
学生板演。
针对板演进行评价。
【分析】这种与化学方程式结合起来的题目怎样来寻找溶质、溶剂、溶液的量及其关系呢?(见板书设计)
【小结】对学生的板演进行评价,引导学生归纳计算步骤,注意事项。
本课题所学知识主要有哪些方面?你都学会了吗?说出来,大家交流一下吧!
【课堂反馈练习】:
1.溶液加水稀释时,没有发生变化的是()
A. 溶质的质量分数
B.溶质的质量
C.溶剂的质量
D.溶液的质量
2.浓度为10%的氢氧化钠溶液20g,若将其浓度增大一倍,应采取的方法是()
A.加20g氢氧化钠
B.蒸去水10g
C.加入20g10%的氢氧化钠溶液
D.将溶液中的水蒸发一半
3.若将12g含有少量铜屑(不与盐酸反应)的铁粉样品放到盛有100g盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量为111.6g。
试求铁粉样品中铁的质量分数。
4.在农村和公园里常用喷雾器喷洒农药,喷雾器的工作原理是:利用外缸压缩气体对内缸充气,当缸内压强达到某一值时,喷雾器便能正常工作。
现有一喷雾器给葡萄喷洒硫酸铜溶液,需配制含硫酸铜质量分数为4%的溶液。
请回答:
(1).配制质量分数为4%的硫酸铜溶液5kg,需硫酸铜晶体多少kg。
(2).要使喷雾器内的溶液迅速喷出,则要利用打气筒对内缸充气。
当内缸大气压为4.04×105Pa 时,喷雾器便能正常工作,若此时喷雾器内溶液的总体积为4.807L,溶液质量为5kg,溶液的深度是0.4m。
求喷雾器缸底所受的压强?
【板书设计】:
课题3 溶质的质量分数
第二课时
例题2:溶液稀释和配制问题的计算
【解】设:稀释后溶液的质量为x.。
50g ×98%=x×20%
x=(50g×98%)/20%=245g
所以:水的质量为245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要水195g。
例题3:溶质的质量分数运用于化学方程式的计算
【解】设:这种稀盐酸中溶质的质量为x。
CaCO3﹢2HCl======CaCl2+ H2O+ CO2
100 73
25 g x
100/25g=73/x
x=(25×73g)/100=18.25g
所以:溶质的质量分数==(18.25g/100g) ×100%==18.25%
答:这种稀盐酸溶液中溶质的质量分数为18.25%。