铜-锌原电池及其原理
- 格式:ppt
- 大小:697.50 KB
- 文档页数:15
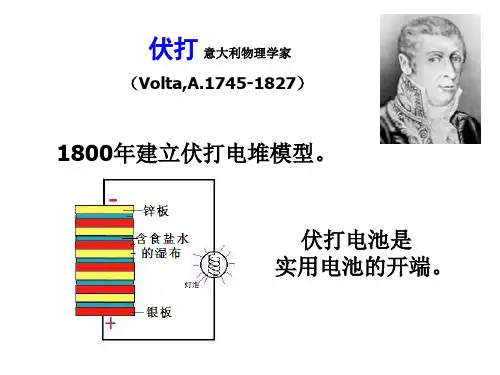


锌和铜原电池硫酸铜
锌和铜原电池是一种常见的原电池类型,也称为锌-铜电池。
硫酸铜可以用作该电池中的电解质。
以下是该电池的工作原理:
1. 电极反应:
- 在锌极(负极),锌离子(Zn2+)离开电极并进入溶液中。
锌极变成锌离子:Zn → Zn2+ + 2e^-
- 在铜极(正极),铜离子(Cu2+)从溶液中移动到电极上,减少为固态铜:Cu2+ + 2e^- → Cu
2. 电解质:
- 硫酸铜(CuSO4)溶解在水中,产生铜离子和硫酸根离子:CuSO4 → Cu2+ + SO4^2-
3. 电子流动:
- 锌极生成的电子以外部电路的形式流向铜极。
在外部电路中,电子可以用来供电给各种电子设备。
这样,锌离子和铜离子在溶液中形成了离子间的动态平衡。
这种离子间的转移为氧化还原反应提供了可用的电能,使电流在电路中流动。
需要注意的是,锌-铜电池是一次性电池,即一旦反应结束,
电池便无法再次使用。

铜锌原电池工作原理铜锌原电池是一种常见的原电池,它由铜和锌两种金属作为电极,硫酸作为电解质,通过化学反应产生电能。
铜锌原电池的工作原理涉及到电化学反应和电子传导的过程,下面我们将详细介绍铜锌原电池的工作原理。
1. 电化学反应。
铜锌原电池的正极是由氧化锌构成的,负极是由氧化铜构成的。
在电池中,正极和负极之间通过电解质相连,电解质通常是硫酸溶液。
当铜锌原电池接通外部电路时,正极的氧化锌会释放出电子,转化为锌离子,同时负极的氧化铜会吸收这些电子,转化为铜离子。
这个过程可以用下面的化学方程式来表示:在正极:Zn → Zn2+ + 2e-。
在负极:Cu2+ + 2e→ Cu。
这些化学反应释放出的电子通过外部电路流动,产生电流,从而驱动外部设备的工作。
2. 电子传导。
在铜锌原电池中,电子是通过金属导线在正极和负极之间传导的。
当电子从正极流向负极时,它们驱动了外部电路中的设备工作,比如手电筒、遥控器等。
这种电子传导的过程是铜锌原电池能够正常工作的关键。
3. 电解质传导。
除了电子传导,铜锌原电池中的电解质也起着重要的作用。
电解质是一种可以导电的溶液,它连接着正极和负极,使得正负极之间的化学反应能够持续进行。
在铜锌原电池中,硫酸通常被用作电解质,它能够促进正负极之间的离子传导,帮助维持电池的正常工作。
总结。
铜锌原电池的工作原理涉及到电化学反应、电子传导和电解质传导三个方面。
通过正极和负极之间的化学反应产生电子,通过外部电路传导电子,以及通过电解质传导离子,铜锌原电池能够产生持续的电流,驱动外部设备的工作。
这种工作原理使得铜锌原电池成为了一种常见的原电池,被广泛应用于日常生活中的各种电子设备中。

一、概述锌铜原电池是一种基本的化学能转换成电能的装置。
它的工作原理是利用锌和铜在电解质溶液中的化学反应来产生电能。
正极和负极的反应是锌与氢离子和铜离子之间的化学反应,而整个电池的总反应则是这些反应的综合。
本文将分析锌铜原电池的正负极反应及总反应。
二、锌铜原电池的结构和原理锌铜原电池由锌片、铜片和电解质溶液组成。
锌片作为负极极板,铜片作为正极极板,它们分别浸泡在含有硫酸的电解质溶液中。
电池内部的化学反应会使得正负极板上的电子流动,从而形成电流,实现能量转换。
三、锌的正极反应当锌片浸入电解质溶液中时,会发生下列正极反应:Zn(s) → Zn2+(aq) + 2e^-这意味着固态的锌会失去电子,转变成锌离子。
这个过程叫做氧化反应。
四、铜的负极反应当铜片浸入电解质溶液中时,会发生下列负极反应:Cu2+(aq) + 2e^- → Cu(s)这表示铜离子会接受电子,转变成固态的铜。
这个过程称为还原反应。
五、总反应正极和负极反应的综合表示锌铜原电池的总反应:Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)在这个综合反应中,锌原子从固态转变成锌离子,放出电子;铜离子则接受这些电子,转变成固态的铜。
这样形成了电子流动,产生了电流。
六、锌铜原电池的应用锌铜原电池由于结构简单,制造成本低,使用方便,被广泛应用在闹钟、遥控器、手电筒等小型电子产品中。
它也被用于实验室中进行化学能转换成电能的示范,教育科普领域。
七、结论锌铜原电池是一种重要的化学能转化为电能的装置,它的正极反应是锌离子失去电子,负极反应是铜离子接受电子,整个电池的总反应是锌和铜在电解质溶液中发生氧化还原反应。
它在生活和教育科普领域都有着重要的应用价值。
八、锌铜原电池工作原理的深入探讨锌铜原电池是一种重要的化学能转换成电能的装置,其工作原理涉及到物质的氧化还原反应。
在电池中,正极和负极之间的化学反应产生了电子流动,形成了电流,从而实现了电能的转化。

原电池锌铜稀硫酸铜反应现象一、锌铜电池的原理锌铜电池是一种常见的原电池,其工作原理基于金属间的电化学反应。
电池中的两种金属(锌和铜)在稀硫酸铜溶液中发生反应,产生电流。
锌金属作为负极,在溶液中被氧化成锌离子(Zn2+),同时释放出电子;铜离子(Cu2+)在溶液中被还原成铜金属,同时接受锌离子释放的电子。
这个电子传递的过程产生了电流,从而使电池工作。
二、反应过程锌铜电池的反应过程可以分为两个半反应:锌负极的氧化反应和铜正极的还原反应。
1. 锌负极的氧化反应:Zn(s)→Zn2+(aq)+ 2e-在锌的表面,金属锌(Zn)氧化为锌离子(Zn2+),同时释放出两个电子。
2. 铜正极的还原反应:Cu2+(aq)+ 2e-→ Cu(s)在铜的表面,铜离子(Cu2+)接受锌离子释放的两个电子,被还原成金属铜(Cu)。
三、实验现象进行锌铜电池实验时,我们可以观察到以下现象:1. 锌负极表面逐渐生成锌离子(Zn2+)溶解在溶液中,溶液逐渐变浑浊。
2. 铜正极表面逐渐生成铜金属,金属的颜色逐渐变深,表面出现光泽。
3. 在外部电路中,连接正负极的导线中产生电流,可以驱动电子设备工作。
4. 锌负极逐渐腐蚀,金属表面出现锈迹;铜正极表面没有明显变化。
四、实验注意事项在进行锌铜电池实验时,需要注意以下几点:1. 使用纯净的锌和铜金属作为电极,避免杂质的影响。
2. 使用稀硫酸铜溶液作为电解质,浓度过高会影响电池的工作效果。
3. 实验中应注意安全,避免溶液的溅出或误触电源引起意外。
4. 实验结束后,及时处理废弃物和溶液,避免对环境造成污染。
总结:锌铜电池是一种常见的原电池,通过锌金属和铜金属在稀硫酸铜溶液中的电化学反应产生电流。
实验中可以观察到锌负极腐蚀、铜正极生成金属以及电流的产生等现象。
锌铜电池的应用广泛,可以用于驱动小型电子设备和实验室中的电化学实验。
通过深入了解锌铜电池的原理和反应现象,我们可以更好地理解电化学原理和电池的工作机制。


铜锌原电池引言:铜锌原电池,也被称为干电池或锌碱电池,是一种常用的原电池。
它由锌盖(即负极)和铜盖(即正极)组成,通过电解质中的化学反应将化学能转化为电能。
1. 原理铜锌原电池的工作原理是基于化学反应。
它包含一个锌盖(负极),里面装有锌粉和碳棒;一个铜盖(正极),里面装有铜粉和二硫化碳;以及一个电解质,通常是氢氧化钠或碳酸钠。
当电池连接到外部电路时,化学反应开始进行,产生电子流从负极流向正极,使电池工作。
2. 化学反应铜锌原电池的主要化学反应是锌的氧化和铜的还原。
在电解质中,锌发生氧化反应,将锌原子离子化,生成锌离子。
反应的化学式如下:Zn(s) → Zn2+(aq) + 2e-在同一时间,铜在正极上发生还原反应,接受来自负极的电子,生成金属铜。
反应的化学式如下:Cu2+(aq) + 2e- → Cu(s)以这种方式,铜锌原电池中的化学能被转化为电能。
3. 优点和应用铜锌原电池有一些明显的优点和应用领域。
首先,铜锌原电池相对便宜,在成本方面比其他电池(如镍镉电池和锂离子电池)更经济实惠。
这使得它们广泛应用于一次性电子产品、家用电器和玩具等需要替换电池的设备中。
其次,铜锌原电池具有较长的存储寿命。
即使在未使用时,铜锌原电池也能保持较长时间的储能状态。
这使得它们成为备用电源的理想选择,如应急灯和远程控制器。
此外,铜锌原电池也有良好的性能特点。
它们通常具有较高的放电电压和大容量,能够提供足够的电能供应设备长时间使用。
4. 环境影响和回收然而,铜锌原电池也对环境产生一定的影响。
它们含有重金属和有毒物质,如铅和汞,因此在废弃时需要妥善处理。
为了减少对环境的影响,很多国家都设立了回收铜锌原电池的专门收集站点。
回收的电池将被送往专门的处理厂进行处理,其中的有毒物质将被安全地处理掉,而有用的金属如锌和铜则会被回收再利用。
5. 结论总结一下,铜锌原电池是一种常用且经济实惠的原电池。
通过化学反应将化学能转化为电能,铜锌原电池成为了众多设备中的理想能源选择。

铜锌原电池带盐桥1.引言1.1 概述铜锌原电池是一种常见的原电池类型,它由铜和锌两种材料构成。
在这种电池中,锌材料作为负极,铜材料作为正极,它们之间通过一个盐桥连接起来。
铜锌原电池的工作原理是通过化学反应将化学能转化为电能。
在电池运行过程中,锌在负极发生氧化反应,即将锌离子化,并释放出电子。
这些电子通过外部电路流向正极,从而产生电流。
与此同时,盐桥的作用是维持电池中的电中性,将阴离子和阳离子在两个电极之间传递,以保持电荷平衡。
盐桥在铜锌原电池中起到了非常重要的作用。
首先,它提供了离子传递的通道,促进了电子在外部电路中的流动。
其次,盐桥还能够补充电池中可能由于电荷转移而产生的电荷不平衡,保持电池的稳定性和持续性。
通过铜锌原电池带盐桥的设计,我们可以有效地利用化学能转化为电能,实现能源的转换和利用。
这种电池具有结构简单、成本低廉、稳定性高等优点,因此在许多应用领域得到广泛应用。
本文旨在探讨铜锌原电池带盐桥的原理和作用,并总结其在能源领域的优点。
同时,我们也将展望未来在这一领域的研究方向,以期进一步提高铜锌原电池的性能和应用范围。
通过深入研究铜锌原电池带盐桥的技术,我们可以为可再生能源领域的发展和应用做出更大的贡献。
1.2 文章结构文章结构包括引言、正文和结论三个部分。
引言部分为整篇文章的开头,用于引入主题,提供背景信息和研究意义。
在本文中,引言部分可以首先介绍铜锌原电池以及其在能源领域的应用,然后再引出本文要讨论的关键问题——铜锌原电池带盐桥的作用和优点。
正文部分是详细阐述文章的内容。
2.1节可以介绍铜锌原电池的原理,包括电池的构造、工作原理和反应方程式等。
可以对铜和锌的电化学特性进行说明,并解释它们在电池中产生电能的机制。
2.2节是重点内容,可以重点介绍盐桥在铜锌原电池中的作用。
盐桥是连接两个半电池中电解液的通道,它起到平衡电荷和离子浓度的作用,保持电池正常工作。
可以详细解释盐桥是如何实现离子传递的,并阐述其在电池中维持电位差和防止极化等方面的意义。

锌铜原电池工作原理
锌铜原电池是一种常见的化学电池,它的工作原理是基于电化学反应。
该电池包含两个电极:一个由锌(Zn)金属组成的锌枝电极作为负极,另一个由铜(Cu)金属组成的铜片电极作为正极。
这两个电极分别浸泡在电解质溶液中,通常是硫酸溶液。
在电池工作时,锌电极上发生了氧化反应,即锌金属离子(Zn2+)失去两个电子变成离子进入电解质溶液:
Zn(s) → Zn2+(aq) + 2e^-
这个反应释放出电子,这些电子从负极锌电极通过导线流向正极铜电极。
在正极铜电极上,铜离子(Cu2+)从电解质溶液中接受了两个电子,还原成金属铜:
Cu2+(aq) + 2e^- → Cu(s)
这个还原反应吸收了电子,完成了电流的闭环。
整个电池工作的过程可以总结为:锌电极上的锌金属氧化成锌离子,释放出电子,电子通过导线从负极流向正极。
在正极,铜离子接受电子,还原成金属铜。
这个过程中,电子的流动导致了电流的产生。
锌铜原电池的工作原理基于金属间的电势差。
在这种电池中,锌的电负性比铜大,因此锌更容易氧化释放出电子。
而铜则接
受电子还原能力较强,可以从溶液中吸收电子还原成金属。
这种电位差驱动着电子流动,使电池产生电流。
锌铜原电池是一种不可充电电池,也称为一次性电池。
一旦电池中的锌被完全氧化,电池停止工作。
锌铜原电池原理,溶液可以更换
锌铜原电池是一种原电池,其工作原理基于两种不同金属之间
的电化学反应。
在锌铜原电池中,锌是负极,铜是正极。
当这两种
金属浸泡在电解质溶液中时,会发生氧化还原反应。
在负极,即锌极,锌原子会失去电子变成离子,即Zn → Zn2+ + 2e-,而在正极,即铜极,铜离子会接受电子变成原子,即Cu2+ + 2e→ Cu。
这些电
子流动形成了电流,从而产生电能。
至于溶液的更换,原电池中的电解质溶液可以在一定程度上进
行更换。
因为在原电池工作过程中,电解质溶液中的成分会发生变化,有些溶质会被耗尽,有些产物会积累,这会影响电池的性能。
因此,定期更换电解质溶液可以延长原电池的使用寿命和保持其稳
定性能。
在更换溶液时,需要注意保持溶液的浓度和PH值,以及更
换溶液的方法和频率,以确保电池的正常运行。
此外,需要注意的是,虽然电解质溶液可以更换,但是在更换
过程中需要小心操作,避免对电池结构和内部零部件造成损坏。
另外,更换溶液的过程中也需要处理废弃溶液,以免对环境造成污染。
因此,在更换电解质溶液时,需要遵循相关的操作规程和环保要求。
总的来说,锌铜原电池的工作原理是基于锌和铜之间的电化学反应,电解质溶液可以在一定程度上进行更换,但在更换时需要注意操作方法和环保要求。
主题:zn和cu的原电池电极反应方程式随着社会的不断发展,化工领域的研究与应用也日趋广泛。
其中,电化学领域的研究对于能源转化、储存以及环境保护等方面都具有重要意义。
而锌和铜的原电池电极反应方程式作为电化学研究中的重要内容,对于理解电化学反应的机理以及原电池的性能具有重要的指导意义。
本文将对zn和cu的原电池电极反应方程式进行探讨,以期对相关领域的研究和应用起到一定的帮助。
一、锌和铜原电池的基本原理1. 锌和铜原电池是由一种简单的原电池,其基本构造包括锌和铜的电极,以及硫酸锌和硫酸铜的电解质。
在原电池的工作过程中,锌电极处于负极,而铜电极则处于正极。
2. 在原电池中,锌发生氧化反应,而铜则发生还原反应。
当原电池连接外部电路时,通过这种氧化还原反应,就可以产生电流。
3. 锌和铜原电池的工作原理可以用电化学反应方程式来表示,通过研究锌和铜原电池的电极反应方程式,可以更好地理解其工作原理。
二、锌电极的反应方程式1. 锌电极在原电池中发生氧化反应,其反应方程式如下:Zn -> Zn2+ + 2e-这是锌发生氧化反应时的标准电极反应方程式,其中Zn表示锌原子,Zn2+表示锌离子,2e-表示释放出的电子。
2. 锌的氧化反应是一个放电过程,通过上述反应方程式可以看出,锌在氧化的过程中失去了电子,并转化为锌离子。
3. 锌的氧化反应是一个自发进行的反应,在锌和铜原电池中起着至关重要的作用。
三、铜电极的反应方程式1. 铜电极在原电池中发生还原反应,其反应方程式如下:Cu2+ + 2e- -> Cu这是铜发生还原反应时的标准电极反应方程式,其中Cu2+表示铜离子,Cu表示铜原子,2e-表示接受的电子。
2. 铜的还原反应同样是一个放电过程,通过上述反应方程式可以看出,铜离子接受了电子,并转化为铜原子。
3. 铜的还原反应同样是一个自发进行的反应,在锌和铜原电池中也起着至关重要的作用。
四、锌和铜原电池的整体反应方程式1. 通过分析锌和铜电极的反应方程式,可以得到整个锌和铜原电池的电化学反应方程式:Zn + Cu2+ -> Zn2+ + Cu整体反应方程式表示了锌和铜原电池的工作原理,其中锌被氧化,而铜离子被还原,从而释放出电子产生电流。