CHO细胞表达体系及其特
- 格式:doc
- 大小:25.50 KB
- 文档页数:1

CHO细胞基本知识引言CHO细胞(Chinese Hamster Ovary cells)是一种常见的哺乳动物细胞系,常被用于生物技术领域的研究和应用。
CHO细胞具有诸多优点,如易于培养、较高的复制速度和稳定性等,使其成为生物药物生产的重要工具。
本文将介绍CHO细胞的基本知识,包括其来源、特点、培养条件和应用等方面。
来源CHO细胞最初来源于中国仓鼠卵巢组织,1957年被美国科学家狄利克(Dilworth)和哈普斯特(Hamster)首次成功培养。
经过多年的研究和改进,CHO细胞逐渐成为工业界主要采用的细胞系之一。
现在,CHO细胞已经被广泛应用于生物制药行业,特别是重组蛋白的生产。
特点CHO细胞有许多特点使其成为生物药物生产的理想细胞系。
1.易于培养:CHO细胞相对容易培养,可以在常规的培养基中生长。
其生长要求较为简单,包括适当的培养基、温度、pH值、营养物质等。
2.高繁殖速度:CHO细胞的繁殖速度较快,在适宜的培养条件下,细胞数量可以迅速增加。
这对于大规模的生物药物生产非常有利。
3.稳定性:CHO细胞在长期培养过程中具有较高的遗传和表达稳定性。
这对于生物药物的一致性和稳定性非常重要。
4.多样性:CHO细胞可以表达多种重组蛋白,包括抗体、生长因子、酶等。
这使得CHO细胞在生物制药领域有广泛的应用前景。
培养条件CHO细胞的培养条件对于细胞的生长和表达产物的质量具有重要影响。
以下是一些常用的培养条件:1.培养基:CHO细胞通常使用含有葡萄糖和氨基酸的培养基,如DMEM(Dulbecco’s Modified Eagle’s Medi um)或RPMI 1640。
培养基中还可以添加胎牛血清(FBS)或人血清蛋白(HSA)等血清成分,以提供细胞所需的营养和生长因子。
2.温度和湿度:CHO细胞通常在37摄氏度的恒温箱中培养,相对湿度约为90%。
温度和湿度的控制对细胞的生长和代谢活性至关重要。
3.pH值:CHO细胞在培养过程中的最适pH值通常在7.0-7.6之间。

CHO (Chinese Hamster Ovary) 细胞是常用的哺乳动物细胞系统,用于表达重组蛋白的研究和生产。
以下是一般性的CHO 细胞表达重组蛋白的方案:
1. 购买表达载体:选择适合的表达载体,可以是质粒或病毒载体。
载体应包含适当的启动子、选择标记等。
2. 转染CHO 细胞:将表达载体导入CHO 细胞中。
转染方法可以选择经典的化学或电穿孔法,也可以选择使用特定的转染试剂或转染仪器。
3. 选择稳定转染株:在转染后,使用适当的选择剂(如抗生素) 处理细胞,以选择稳定表达重组蛋白的细胞株。
可通过单克隆分离等方法筛选和扩增单一细胞克隆。
4. 细胞培养条件优化:优化培养基配方和细胞培养条件,包括温度、pH 值、培养基组分等,以提高重组蛋白的产量和纯度。
5. 表达蛋白的诱导:使用适当的诱导剂或方法,例如添加诱导剂(如甲酪酸) 到培养基中,以启动重组蛋白的表达。
6. 重组蛋白的纯化和分析:通过细胞破碎和不同的纯化步骤(如亲和层析、离子交换层析、凝胶过滤等)从培养基或细胞提取物中纯化目标重组蛋白,并使用适当的分析方法验证表达的蛋白的纯度和功能。
在每个步骤中,需要根据具体的重组蛋白和研究目的进行优化和调整。
此外,合理的培养细胞和操作操作也至关重要,以确保产量和纯度的理想达到。
这些方案的细节将根据具体的实验目的和需要进行个体化定制。

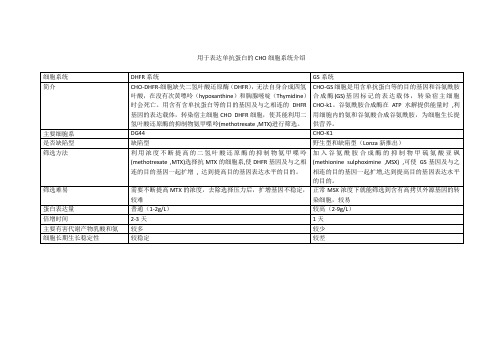
生物技术进展 2023 年 第 13 卷 第 5 期 698 ~ 703Current Biotechnology ISSN 2095‑2341进展评述Reviews不同亚型CHO 宿主细胞对抗体表达的影响曹辉 , 董静 , 贾宇 , 江一帆*华北制药集团新药研究开发有限责任公司,抗体药物河北省工程研究中心,抗体药物研究国家重点实验室,石家庄 050015摘要:CHO 细胞作为宿主细胞广泛应用于生物药工业化生产中。
其中,CHO -K1、CHO -DG44和CHO -S 是最常见的3种亚型。
虽然这些亚型是从共同的原始CHO 细胞分离出来的,但在不同的实验室或生物医药公司、研究人员、培养基或培养方式下连续传代、驯化和保存,使得CHO 细胞积累了大量变异,导致宿主细胞应用于抗体药生产时会在细胞生长状态、抗体表达量及以糖型为代表的质量属性方面表现出较大差异。
综述了CHO 细胞不同亚型的染色体差异、生长状态、表达差异以及糖型差异,以期为抗体药物研发中宿主细胞的选择提供参考。
关键词:CHO 细胞;抗体;表达量;糖型DOI :10.19586/j.2095‑2341.2023.0064中图分类号:Q28, R392-33 文献标志码:AEffects of Different Sources of CHO Host Cells on Antibody ExpressionCAO Hui , DONG Jing , JIA Yu , JIANG Yifan *State Key Laboratory of Antibody Drug Development , Hebei Engineering Research Center of Antibody Medicine , New Drug Research and Development Co. Ltd , North China Pharmaceutical Corporation , Shijiazhuang 050015, ChinaAbstract :CHO cells comprise a variety of lineages including CHO -K1, CHO -DG44 and CHO -S , which have been widely used in the industrial production of biological drugs. All CHO cell lines share a common ancestor , however , during the process of cell passage cultivation , cell domesticated , and preservation by different laboratories or companies , substantial genetic heterogeneity among them has been produced , that showed great differences in cell growth state , antibody titer , glycosylation and other product quality attributes. This article reviewed the difference in chromosome , growing status and expression , and glycoform in different sources ofCHO host cells , which was expected to be helpful in host cell selection during antibody drug research and development process.Key words :CHO cells ; monoclonal antibody ; antibody titer ; glycosylation生物药物在国际医药市场中占据主导地位,截至2023年,全球范围内已有100多个抗体药物被批准上市,近1 200个抗体药物处于不同临床试验阶段[1]。


cho细胞表达系统及筛选原理Cho细胞表达系统及筛选原理一、引言Cho细胞表达系统是一种常用的哺乳动物细胞表达系统,被广泛应用于重组蛋白的生产。
本文将介绍Cho细胞表达系统的原理以及其在蛋白质筛选中的应用。
二、Cho细胞表达系统的原理Cho细胞是一种中国仓鼠卵巢细胞系,具有较高的生长速度和蛋白质表达能力。
Cho细胞表达系统主要包括以下几个关键步骤。
1. 转染将目标基因导入Cho细胞中,通常使用质粒转染法或病毒载体转染法。
质粒转染法通过将目标基因插入质粒DNA中,然后利用转染试剂将质粒DNA导入细胞内。
病毒载体转染法则通过构建携带目标基因的病毒载体,将其感染到Cho细胞中。
2. 选择性筛选为了确保只有转染成功的细胞能够表达目标蛋白,通常在培养基中添加适当的选择性抗生素,如G418或葡萄糖酸钾。
只有转染成功的细胞才能抵抗抗生素的作用,存活下来。
3. 扩增和表达经过筛选的细胞将被扩增培养,以获得足够数量的细胞进行大规模蛋白质表达。
通常选择合适的培养基和培养条件,以提高细胞的生长速度和蛋白质表达水平。
4. 蛋白质纯化经过表达的目标蛋白质需要进行纯化,以去除其他杂质。
常用的纯化方法包括亲和层析、离子交换层析、凝胶过滤层析等。
通过这些方法,可以获得高纯度的目标蛋白质。
三、Cho细胞表达系统在蛋白质筛选中的应用Cho细胞表达系统在蛋白质筛选中具有以下优势。
1. 高表达水平Cho细胞具有较高的蛋白质表达能力,能够快速产生大量目标蛋白。
这对于需要大量蛋白质的研究和工业应用非常有利。
2. 真核细胞表达与原核细胞表达系统相比,Cho细胞表达系统能够实现真核细胞蛋白质表达。
这使得Cho细胞表达系统适用于需要进行正确的蛋白质翻译修饰、蛋白质折叠和组装的蛋白质研究。
3. 可选择性筛选通过添加适当的选择性抗生素,可以筛选出成功表达目标蛋白的细胞。
这样可以确保筛选后的细胞具有较高的表达水平和纯度。
4. 灵活性Cho细胞表达系统可以应用于多种类型的蛋白质,包括单链抗体、重组蛋白、酶等。
人促红细胞生成素在CHO细胞上的表达随着生物技术的不断发展,基因工程在医药领域的应用越来越广泛。
人促红细胞生成素(Erythropoietin,简称EPO)作为一种生长因子,在治疗贫血方面发挥着重要的作用。
本文将探讨人促红细胞生成素在CHO细胞上的表达情况。
一、背景介绍1. EPO的功能和应用人促红细胞生成素是一种由肾脏分泌的蛋白质激素,对红细胞的生成起着重要的调节作用。
它可以刺激骨髓中的前红细胞(erythroblast)增殖和分化,促进红细胞的生成。
因此,EPO在临床上广泛应用于贫血的治疗,特别是在肾衰竭等引起贫血的疾病中。
2. CHO细胞的特点和应用CHO细胞是一种常用的哺乳动物细胞,广泛应用于蛋白质的表达和研究领域。
CHO细胞具有较高的产物稳定性和较低的免疫原性,是表达重组蛋白的理想宿主细胞之一。
因此,将EPO在CHO细胞上进行表达研究,具有重要的理论和实践价值。
二、EPO基因的克隆和构建1. EPO基因的克隆通过PCR扩增技术,从人体肝脏组织中获得EPO基因的DNA序列,然后进行DNA片段的纯化和测序,以确保所获得的DNA序列的准确性。
2. EPO基因的构建基于CHO细胞中常用的表达载体系统,将EPO基因与相应的表达载体连接,构建成重组表达质粒。
通过酶切和连接等分子生物学技术,确保EPO基因正确地插入到质粒中,并经过测序确认。
三、CHO细胞中的EPO表达1. 细胞转染将构建好的重组表达质粒转染到CHO细胞中,可以使用电穿孔法、化学法或病毒介导的转染等方法。
2. 表达培养在适当的培养基和条件下,对转染后的CHO细胞进行培养和筛选,选择出稳定的表达细胞株。
在培养的过程中,可以通过ELISA等技术手段检测培养上清液中的EPO表达情况。
3. 表达产物的纯化和鉴定通过亲和层析、离子交换层析和凝胶过滤等技术手段,对CHO细胞培养上清液中的EPO进行纯化。
然后可以利用质谱等分析方法,对纯化后的产物进行鉴定和定量。
CHO细胞表达体系特点及CHO细胞表达疫苗来源:易生物实验浏览次数:533 网友评论0 条CHO细胞表达体系特点及CHO细胞表达疫苗关键词:细胞疫苗CHO细胞表达体系CHO细胞表达分子生物学、分子免疫学等学科的发展使基因工程疫苗具有越来越重要的地位。
在基因工程疫苗研究的动物细胞表达系统中,最具代表性的就是中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)。
它是用来表达外源蛋白最多也最成功的一类细胞。
本文就CHO细胞表达系统在疫苗研制中的应用做一综述。
1、CHO细胞表达体系及其特点CHO细胞属于成纤维细胞,既可以贴壁生长。
也可以悬浮生长。
目前常用的CHO细胞包括原始CHO和二氢叶酸还原酶双倍体基因缺失型(DHFR-) 突变株CHO。
近年来,为降低生产成本和减少血制品带来的潜在危害性,动物细胞生产开始使用无血清培养基(SFM),但SFM往往导致细胞活力差,贴壁性差,分泌外源蛋白的能力差等缺点。
另有研究者尝试将类胰岛素生长因子IGF基因和转铁蛋白基因转入CHO细胞获得能自身分泌必需蛋白的“超级CHO”,无需在培养基中转铁蛋白和胰岛素,细胞可在sFM 中生长良好。
与其他表达系统相比,CHO表达系统具有以下的优点:(1)具有准确的转录后修饰功能,表达的蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子;(2)既可贴壁生长,又可以悬浮培养,且有较高的耐受剪切力和渗透压能力;(3)具有重组基因的高效扩增和表达能力,外源蛋白的整合稳定;(4)具有产物胞外分泌功能,并且很少分泌自身的内源蛋白,便于下游产物分离纯化;(5)能以悬浮培养方式或在无血清培养基中达到高密度培养。
且培养体积能达到1000L以上,可以大规模生产。
2、CHO细胞表达疫苗(1)乙肝疫苗CHO细胞表达疫苗的种类不多,多数处于研究阶段。
目前只有CHO表达乙肝疫苗已投入生产,这是除酵母表达乙肝疫苗以外,唯一已用于人类使用的基因工程亚单位疫苗。
常用的蛋白质表达体系
常用的蛋白质表达体系有多种,包括原核细胞体系、哺乳动物细胞体系和酵母细胞体系。
在原核细胞体系中,常用的表达宿主包括大肠杆菌(E. coli)和单核细胞(S. cerevisiae)。
大肠杆菌是最常用的原核表达宿主,具有生长快、易操作、高产量的优点。
通过将目标基因插入质粒中,然后将质粒转化到大肠杆菌中,利用其自身的表达机制来产生蛋白质。
单核细胞是酵母菌的一种表达宿主,相比于大肠杆菌,其优点包括可以进行异源蛋白质糖基化、易扩展培养规模等。
哺乳动物细胞体系是一种常用的真核蛋白质表达体系,可用于表达复杂的蛋白质,尤其对于需要正确的蛋白质修饰的研究非常重要。
哺乳动物细胞常用的表达宿主包括CHO细胞、HEK293细胞等。
CHO细胞(Chinese Hamster Ovary cells)是最常用的哺乳动物细胞表达系统之一,具有高产量和稳定的表达特点。
HEK293细胞(Human Embryonic Kidney 293 cells)也广泛用于蛋白质表达,其优点包括易于培养、高表达能力和适用于多种蛋白质修饰。
另外,酵母细胞体系也是常用的蛋白质表达体系。
酵母细胞表达宿主包括酿酒酵母(S. cerevisiae)和毕赢酵母(P. pastoris)。
酿酒酵母是一种单细胞真核生物,具有低成本、易于操作和较高的蛋白质产量的优点。
而毕赢酵母则适用于表达高产量的蛋白质和进行复杂的蛋白质修饰。
总之,不同的蛋白质表达体系有各自的优缺点,研究人员可根据需要选择合适的表达宿主进行蛋白质表达研究。
CHO细胞表达体系及其特点
诞生于70年代末的基因工程药物因其具有其他药物无法比拟的优点,已迅速成为制药工业中一个引人瞩目的领域。
1995年美国基因工程药物销售额约为48亿美元,1997年超过60亿美元,年增长率达20%以上。
各国政府将其视为新的经济增长热点而给予了大力支持。
基因工程药物研究与开发的主要环节包括:①基因的克隆和基因工程菌的构造;②重组细胞的培养;③目的产物的分离纯化等。
针对这些主要环节,研究人员正致力于高效表达、培养工艺及下游分离纯化等方面的研究。
随着基因工程技术的不断发展,目前已有多种表达系统可用于生产具有医疗价值的人或动物来源的蛋白质(表1)。
大肠杆菌(E.coli)是使用最早的表达系统,其显著优点是易于操作,产量高,成本低,但由于用E.coli生产的蛋白质药物因缺乏糖基化而在人体内易被降解,因此它的药放大大降低。
此外,它还存在易产生内毒素和包涵体的问题。
真核细胞中CHO 细胞是目前重组糖基蛋白生产的首选体系;因为与其他表达系统相比,它具有许多优点:①具有准确的转录后修饰功能,表达的糖基化药物蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子;
②具有产物胞外分越功能,便于下游产物分离纯化;
③具有重组基因的高效扩增和表达能力;
④具有贴壁生长特性,且有较高的耐受剪切力和渗透压能力,可以进行悬浮培养,表达水平较高;
⑤CHO细胞属于成纤维细胞(fibroblast),很少分泌自身的内源蛋白,利于外源蛋白的启分离。
但CHO细胞培养成本高,条件难掌握,易污染,在一定程度上影响了它的广泛应用。
目前已有越来越多的药用蛋白在CHO细胞中获得了高效表达(表2),其中部分药物已投放市场,倒如EPO、GCSF等。
CHO 细胞属于成纤维细胞,既可以贴壁生长。
也可以悬浮生长。
目前常用的CHO细胞包括原始CHO和二氢叶酸还原酶双倍体基因缺失型(DHFR-)突变株CHO。
近年来,为降低生产成本和减少血制品带来的潜在危害性,动物细胞生产开始使用无血清培养基(SFM),但SFM往往导致细胞活力差,贴壁性差,分泌外源蛋白的能力差等缺点。
另有研究者尝试将类胰岛素生长因子IGF基因和转铁蛋白基因转入CHO细胞获得能自身分泌必需蛋白的“超级CHO”,无需在培养基中转铁蛋白和胰岛素,细胞可在SFM 中生长良好。
与其他表达系统相比,CHO表达系统具有以下的优点:
(1)具有准确的转录后修饰功能,表达的蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子;
(2)既可贴壁生长,又可以悬浮培养,且有较高的耐受剪切力和渗透压能力;
(3)具有重组基因的高效扩增和表达能力,外源蛋白的整合稳定;
(4)具有产物胞外分泌功能,并且很少分泌自身的内源蛋白,便于下游产物分离纯化;
(5)能以悬浮培养方式或在无血清培养基中达到高密度培养。
且培养体积能达到1000L以上,可以大规模生产。