2016WHO 胶质瘤分类解读
- 格式:ppt
- 大小:16.70 MB
- 文档页数:50



胶质瘤病理报告解读
胶质瘤的病理报告是对胶质瘤组织进行病理学检查后得出的结果,用于确定胶质瘤的类型、级别和其他特征。
以下是一些常见的胶质瘤病理报告中可能包含的信息:
1. 胶质瘤类型:胶质瘤可以分为不同的类型,如星形细胞瘤、少突胶质细胞瘤、室管膜瘤等。
病理报告将明确指出胶质瘤的类型。
2. 胶质瘤级别:胶质瘤根据其恶性程度分为不同的级别,通常使用WHO(世界卫生组织)分级系统。
病理报告将指出胶质瘤的级别,如Ⅰ级、Ⅱ级、Ⅲ级或Ⅳ级。
3. 细胞形态和特征:病理报告可能描述胶质瘤细胞的形态、大小、核的特征以及是否存在异型性(细胞形态和结构的异常)。
4. 增值指数:增值指数是评估胶质瘤细胞增殖活性的指标。
病理报告可能会提供增值指数的值,如Ki-67 增殖指数。
5. 免疫组化结果:免疫组化是一种通过抗体检测肿瘤组织中特定蛋白质表达的技术。
病理报告可能会列出一些免疫组化标记物的结果,这些标记物可以帮助确定胶质瘤的类型和预测预后。
6. 分子遗传学信息:现代胶质瘤的诊断常常结合分子遗传学检测。
病理报告可能会提供有关胶质瘤分子遗传学改变的信息,如IDH 基因突变状态。


胶质瘤分级标准 ki67
胶质瘤的分级标准是根据2016年世界卫生组织(WHO)中枢神经系统肿
瘤的分类,将胶质瘤分为四级:I级胶质瘤主要包括毛细细胞型星形细胞瘤
和室管膜下巨细胞型星形细胞瘤。
II级胶质瘤主要包括弥漫性星形细胞瘤、少突胶质细胞瘤和少突-星形胶质细胞瘤。
III级胶质瘤主要包括间变性星形
细胞瘤、间变性少突胶质细胞瘤和间变性少突-星形胶质细胞瘤。
IV级胶质
瘤主要指胶质母细胞瘤和胶质肉瘤。
至于Ki67,这是一种增殖活性细胞核抗原,在多种肿瘤组织中表达。
Ki67
指数是通过免疫组化染色和计数特定区域中的阳性细胞来确定的。
一般来说,Ki67指数越高,代表肿瘤细胞的增殖能力越强,恶性程度也越高。
因此,
Ki67指数对脑胶质瘤的诊断、分级以及治疗方案的选择都有重要的参考价值。
请注意,这些内容仅供参考,不能替代专业医疗建议。
如果需要进行胶质瘤的分级或治疗方案选择,请咨询专业医生或神经外科医生进行评估。

2016who中枢神经系统分类简述译者按:“2016年版WHO中枢神经分类概述”于5月9日在Acta Neuropathol杂志在线发表。
我们在第一时间将中文翻译版本推送,希望能够给神经肿瘤临床工作者提供一点帮助。
由于翻译团队都是神经外科医生,文中部分病理诊断名词的翻译可能与临床实践有部分出入,同时表格内的诊断专有名词未全文编译,敬请谅解。
摘要2016世界卫生组织(WHO)中枢神经系统肿瘤分类是2007版本概念和实践上的进一步推进。
新的中枢神经系统WHO 分类系统首次针对大多数肿瘤在组织学分型基础上增加了分子分型来分类,从而建立了分子时代CNS肿瘤诊断的新概念。
2016 CNS WHO分类主要在弥漫型胶质瘤、髓母细胞瘤和其它胚胎性肿瘤中进行了重分类,这之中包含了结合组织学和分子学特征的新名称定义原则,包括胶质母细胞瘤-IDH 野生型和胶质母细胞瘤-IDH突变型;弥漫型中线胶质瘤-H3 K27M突变型;RELA融合阳性室管膜瘤;髓母细胞瘤-WNT 激活型和髓母细胞瘤-SHH激活型;胚胎性肿瘤伴有多层细胞菊形团-C19MC激活等。
2016版增加了部分新的肿瘤,删除了部分不再与诊断和生物学相关的名称、变化和形式等。
其它需要指出的变化还包括在非典型性脑膜瘤中增加脑侵犯作为一个诊断标准,在新的单独神经纤维瘤/血管外皮细胞瘤联合体中引入了软组织类型分级系统,这种分型系统不同于其它CNS分型系统。
总之,希望2016 CNS WHO分类系统能使临床、实验室研究和流行病学的研究更便利,并且改善脑肿瘤患者的生存。
前言过去的一个世纪中,脑肿瘤的分类很大程度上基于肿瘤组织学发生的概念,肿瘤根据微观中的相似和不同之处来假定其细胞起源和分化水平。
这些组织学的特征主要依赖于光学显微镜下H-E染色,免疫组织化学染色显示相关蛋白质和部分超微结构特征。
比如,2007版中将星形细胞表型的肿瘤与少突细胞表型的肿瘤区别开来,而不论这些不同的星形细胞肿瘤临床上是否相似或不同。
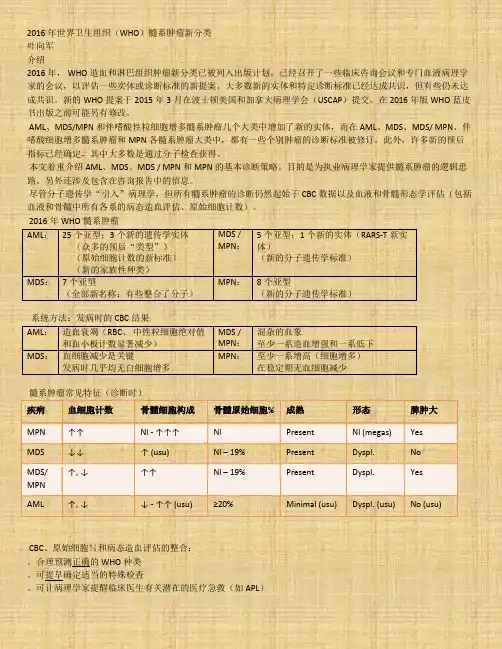
2016年世界卫生组织(WHO)髓系肿瘤新分类叶向军介绍2016年, WHO造血和淋巴组织肿瘤新分类已被列入出版计划。
已经召开了一些临床咨询会议和专门血液病理学家的会议,以评估一些实体或诊断标准的新提案。
大多数新的实体和特定诊断标准已经达成共识,但有些仍未达成共识。
新的WHO提案于2015年3月在波士顿美国和加拿大病理学会(USCAP)提交。
在2016年版WHO蓝皮书出版之前可能另有修改。
AML、MDS/MPN和伴嗜酸性粒细胞增多髓系肿瘤几个大类中增加了新的实体,而在AML、MDS、MDS/ MPN、伴嗜酸细胞增多髓系肿瘤和MPN各髓系肿瘤大类中,都有一些个别肿瘤的诊断标准被修订。
此外,许多新的预后指标已经确定,其中大多数是通过分子检查获得。
本文着重介绍AML、MDS、MDS / MPN和MPN的基本诊断策略。
目的是为执业病理学家提供髓系肿瘤的逻辑思路。
另外还涉及包含在咨询报告中的信息。
尽管分子遗传学“引入”病理学,但所有髓系肿瘤的诊断仍然起始于CBC数据以及血液和骨髓形态学评估(包括血液和骨髓中所有各系的病态造血评估、原始细胞计数)。
2016年WHO髓系肿瘤AML:25个亚型;3个新的遗传学实体(众多的预后“类型”)(原始细胞计数的新标准)(新的家族性种类)MDS /MPN:5个亚型;1个新的实体(RARS-T新实体)(新的分子遗传学标准)MDS:7个亚型(全部新名称;有些整合了分子)MPN:8个亚型(新的分子遗传学标准)系统方法:发病时的CBC结果AML:造血衰竭(RBC、中性粒细胞绝对值和血小板计数显著减少)MDS /MPN:混杂的血象至少一系造血增强和一系低下MDS:血细胞减少是关键发病时几乎均无白细胞增多MPN:至少一系增高(细胞增多)在稳定期无血细胞减少髓系肿瘤常见特征(诊断时)疾病血细胞计数骨髓细胞构成骨髓原始细胞% 成熟形态脾肿大MPN ↑↑ Nl - ↑↑↑ Nl Present Nl (megas) Yes MDS ↓↓ ↑ (usu) Nl – 19% Present Dyspl. NoMDS/MPN↑, ↓ ↑↑ Nl – 19% Present Dyspl. Yes AML ↑, ↓ ↓ - ↑↑ (usu) ≥20% Minimal (usu) Dyspl. (usu) No (usu)CBC、原始细胞%和病态造血评估的整合:。

一、神经上皮组织肿瘤1.星形细胞肿瘤毛细胞型星形细胞瘤毛细胞黏液型星形细胞瘤室管膜下巨细胞星形细胞瘤多形性黄色星形细胞瘤弥漫性星形细胞瘤纤维型星形细胞瘤原浆型星形细胞瘤肥胖型星形细胞瘤间变性星形细胞瘤胶质母细胞瘤巨细胞胶质母细胞瘤胶质肉瘤大脑胶质瘤病2.少突胶质细胞肿瘤少突胶质瘤间变性少突胶质瘤3.少突胶质星形细胞瘤少突星形细胞瘤间变性少突星形细胞瘤4.室管膜肿瘤室管膜下瘤黏液乳头型室管膜下瘤室管膜瘤细胞型乳头型透明细胞型脑室膜细胞型5.脉络膜丛肿瘤脉络膜丛乳头状瘤非典型脉络膜丛乳头状瘤脉络丛乳头状癌6.其他神经上皮组织肿瘤星形母细胞瘤三脑室脊索样胶质瘤血管中心性胶质瘤7.神经元和混合性神经元-神经胶质肿瘤小脑发育不良性节细胞瘤胚胎发育不良性神经上皮瘤节细胞瘤节细胞胶质瘤间变性节细胞胶质瘤中央性神经细胞瘤脑室外神经细胞瘤小脑脂肪神经细胞瘤乳头状胶质神经元肿瘤四脑室菊形团形成性胶质神经元肿瘤8.松果体区肿瘤松果体细胞瘤中间分化型松果体实质瘤松果体母细胞瘤松果体区乳头状瘤9.胚胎性肿瘤髓母细胞瘤多纤维性/结节性髓母细胞瘤髓母细胞瘤伴广泛结节形成间变性髓母细胞瘤大细胞性髓母细胞瘤中枢神经系统原始神经外胚层肿瘤(PENTs)中枢神经系统神经母细胞瘤中枢神经系统节细胞神经母细胞瘤髓上皮瘤室管膜母细胞瘤非典型畸胎样/横纹肌样瘤二、颅和椎旁神经肿瘤施旺(雪旺)瘤(神经鞘瘤,神经瘤)细胞型丛状型黑色素型神经纤维瘤丛状型神经束膜瘤神经束膜瘤恶性神经束膜瘤恶性周围神经鞘膜瘤(MPNST)上皮样型MPNST伴有间质分化的MPNST黑色素型MPNST伴有腺样分化的MPNST三、脑(脊)膜肿瘤1.脑(脊)膜上皮细胞肿瘤脑(脊)膜瘤上皮型纤维(纤维母细胞)型过渡型(混合型)砂粒型血管瘤型微囊型分泌型淋巴浆细胞丰富型化生型脊索样型透明细胞型非典型性乳头型横纹肌样型间变性(恶性)2.脑(脊)膜间质肿瘤脂肪瘤血管脂肪瘤蛰伏脂肪瘤(冬眠瘤)脂肪肉瘤(颅内)孤立性纤维瘤纤维肉瘤恶性纤维组织细胞瘤平滑肌瘤平滑肌肉瘤横纹肌瘤横纹肌肉瘤软骨瘤软骨肉瘤骨瘤骨肉瘤骨软骨瘤血管瘤上皮样血管内皮瘤血管外皮细胞瘤间变性血管外皮细胞瘤血管肉瘤Kaposi肉瘤Ewing肉瘤3.原发性黑色素细胞病变弥漫性黑色素细胞增生症黑色素细胞瘤恶性黑色素瘤脑膜黑色素瘤病4.其他与脑(脊)膜相关的肿瘤血管母细胞瘤四、淋巴瘤和造血系统肿瘤恶性淋巴瘤浆细胞瘤粒细胞肉瘤五、生殖细胞肿瘤生殖细胞瘤胚胎性癌卵黄囊瘤绒毛膜癌畸胎瘤成熟型未成熟型混合性生殖细胞肿瘤六、鞍区肿瘤颅咽管瘤釉质瘤型乳头型颗粒细胞瘤垂体细胞瘤腺垂体梭形细胞嗜酸细胞瘤七、转移性肿瘤3、真真的心,想你;美美的意,恋你;暖暖的怀,抱你;甜甜的笑,给你;痴痴的眼,看你;深深的夜,梦你;满满的情,宠你;久久的我,爱你!4、不管从什么时候开始,重要的是开始以后不要停止;不管在什么时候结束,重要的是结束以后不要后悔。


第5版WHO中枢神经系统肿瘤分类胚胎性肿瘤解读摘要2021年第5版WHO中枢神经系统肿瘤新分类,将中枢神经系统胚胎性肿瘤(CNS embryonal tumours,CET)分为髓母细胞瘤和其他CET两个亚类;做了髓母细胞瘤分子亚分型,WNT 活化型分为α和β亚型,SHH活化/TP53野生型和TP53突变型分为SHH-1~-4亚型,非WNT/非SHH活化型分为1~8亚型;将其他CET由原先8型整合为6型,并增加或确定了一些新肿瘤类型及原有肿瘤的新分子亚型。
本文对以上变更作简要解读。
正文2016年WHO中枢神经系统肿瘤分类,首次尝试按分子遗传学特征相似性原则对中枢神经系统肿瘤重新分类,但引入分子分型者仅为胶质瘤和胚胎性肿瘤,远不能满足临床对中枢神经系统肿瘤精准病理诊断的实际需要。
故2021年第5版WHO 中枢神经系统肿瘤新分类(简称第5版分类),纳入大量新分子遗传学和表观遗传学(DNA甲基化谱)诊断指标及更详细的临床和随访数据,据此制定了中枢神经系统肿瘤分类、亚分类、分型、亚分型及分级的新方案,新增了许多肿瘤类型和分子亚型,其中变动最大者仍是胶质瘤和胚胎性肿瘤。
第5版分类将中枢神经系统胚胎性肿瘤(CNS embryonal tumours,CET)分为髓母细胞瘤(medulloblastoma,MB)和其他CET两个亚类,本文将介绍第5版分类CET的主要变更。
一、第5版分类MB的主要变更(一)MB分型和分级及变化概况第5版分类的MB分子分型未变,但按DNA甲基化谱和转录组差异做了MB分子亚分型(表1);将MB定义为单一组织学分型,将原组织学分型(经典型、促纤维增生/结节型、广泛结节型、大细胞/间变性)降格为亚型,但各组织学亚型的形态学诊断标准及常对应的分子分型未变;不再单列“MB,NOS(无分子信息)”分型;仍将全部MB定为中枢神经系统WHO 4级,但级别改用阿拉伯数字表示。
表1 第5版WHO分类髓母细胞瘤(MB)的分子分型及分子亚型(二)MB各分子分型及亚型的特征与意义1.WNT活化型MB及亚型的特征:该型MB预后最好,均有WNT 通路活化,其活化原因之一CTNNB1基因突变为该型MB特有;该型MB被分为α和β两个分子亚型;WNT-α亚型见于儿童,均呈第6号染色体单体;WNT-β亚型见于年长儿童和年轻成人,常呈第6号染色体二倍体。

中国中枢神经系统胶质瘤诊断与治疗指南(最全版)第一章概述胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,WHO中枢神经系统肿瘤分类将胶质瘤分为WHOⅠ~Ⅳ级,Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤[1]。
本指南主要涉及低级别胶质瘤、高级别胶质瘤、大脑胶质瘤病和室管膜瘤的诊治。
近30年来,原发性恶性脑肿瘤发生率逐年递增,年增长率为1%~2%,在老年人群尤为明显[2]。
根据美国脑肿瘤注册中心(Central Brain Tumor Registry of the United States, CBTRUS)统计,胶质瘤约占所有中枢神经系统肿瘤的27%,约占恶性肿瘤的80%;在原发性恶性中枢神经系统肿瘤中,胶质母细胞瘤(Glioblastoma, GBM, WHOⅣ级)的发病率最高,占了46.1%,约为3.20/10万,且男性多于女性;其次是弥漫性星形细胞瘤,发病率为0.53/10万。
GBM的发病率随着年龄的增长而增加,最高发的年龄为75~84岁,新诊断的中位年龄是64岁[3]。
胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。
近年来,高级别胶质瘤发病机制研究的热点包括:等位基因的杂合性缺失及基因的遗传性变异研究,DNA错配修复,细胞信号通路紊乱(如EGFR及PDGF通路),PI3K/Akt/PTEN、Ras和P53/RB1通路基因突变和肿瘤干细胞研究等。
胶质瘤临床表现主要包括颅内压增高及神经功能缺失。
目前,诊断主要依靠CT及MRI检查等影像学诊断,一些新的MRI序列,如磁共振弥散加权成像和弥散张量成像(DWI和DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)和功能磁共振成像(fMRI)开始应用于临床,对提高诊断水平及判断预后有重要意义。
正电子发射计算机断层显像(PET)和单光子发射计算机断层成像术(SPECT)对于鉴别肿瘤复发与放射性坏死有一定帮助。
胶质母细胞瘤的分级标准英文回答:Grading of Gliomas: A Comprehensive Guide.Gliomas are the most common primary tumors of thecentral nervous system (CNS). They are classified according to their histopathological features into four grades: World Health Organization (WHO) grades I to IV. The gradingsystem is based on the following criteria:Cytological atypia: This refers to the presence of abnormal cells that differ from normal cells in size, shape, and arrangement.Mitotic activity: This refers to the rate of cell division. A higher mitotic activity indicates a more aggressive tumor.Neoangiogenesis: This refers to the formation of newblood vessels within the tumor. Neoangiogenesis is associated with increased tumor growth and invasiveness.Necrosis: This refers to the death of tumor cells. Necrosis can be either coagulative (characterized by eosinophilic, glassy appearance) or liquefactive (characterized by cystic degeneration).The WHO grading system for gliomas is as follows:WHO Grade I: These are the least aggressive gliomas. They are typically well-differentiated and have a low mitotic activity. They are usually curable with surgery.WHO Grade II: These gliomas are more aggressive than grade I gliomas. They are typically moderatelydifferentiated and have a slightly higher mitotic activity. They are often curable with surgery and adjuvant therapy.WHO Grade III: These gliomas are highly aggressive. They are typically poorly differentiated and have a high mitotic activity. They are usually not curable, buttreatment can延长survival.WHO Grade IV: These are the most aggressive gliomas. They are typically undifferentiated and have a very high mitotic activity. They are usually fatal within a few months of diagnosis.中文回答:胶质瘤分级标准,全面指南。
第五版《世界卫生组织中枢神经系统肿瘤分类指南》下成人胶质瘤诊断及预后第五版《世界卫生组织中枢神经系统肿瘤分类指南》下成人胶质瘤诊断及预后胶质瘤是中枢神经系统最常见的原发肿瘤之一,其分类和诊断标准对于确定患者的预后以及制定治疗策略起到至关重要的作用。
世界卫生组织(World Health Organization,简称WHO)发布了第五版《世界卫生组织中枢神经系统肿瘤分类指南》,对成人胶质瘤的诊断和预后进行了更新和精细化。
根据第五版指南,成人胶质瘤主要分为三类:星形细胞瘤(astrocytoma)、少突胶质细胞瘤(oligodendroglioma)和混合星-突细胞瘤(mixed astrocytoma-oligodendroglioma)。
这三类胶质瘤在组织学上具有不同的特征和标志物,对于不同类型的胶质瘤需采用不同的诊断方法和治疗策略。
在诊断星形细胞瘤时,需要观察细胞的增生情况和形态学特征。
根据细胞的核分裂象数目、细胞异型性以及新生血管的形成情况,可将星形细胞瘤分为三个级别:低级别星形细胞瘤(grade II)、中级别星形细胞瘤(grade III)和高级别星形细胞瘤(grade IV)。
低级别星形细胞瘤术后预后较好,而高级别星形细胞瘤则预后较差。
少突胶质细胞瘤是一种较为罕见的胶质瘤,常见于颞叶和额叶。
在诊断上,少突胶质细胞瘤需要观察细胞核的形态学特征,如核分裂象数目和核异型性。
对于带有1p/19q基因失配的少突胶质细胞瘤,其预后较好;相反,对于未带有基因失配的少突胶质细胞瘤,其预后较差。
混合星-突细胞瘤是由星形细胞和少突胶质细胞混合组成的肿瘤。
在诊断上,需要观察细胞的形态学和分子遗传学特征。
近年来,分子遗传学检测在胶质瘤的诊断和预后评估方面发挥了越来越重要的作用。
例如,对于混合星-突细胞瘤中的IDH (isocitrate dehydrogenase)突变和1p/19q基因失配的检测,可以帮助确定患者的预后和治疗策略。
中国胶质瘤指南
胶质瘤的定义和分类
胶质瘤是一种常见的中枢神经系统肿瘤,由胶质细胞形成。
根据WHO(世界卫生组织)的分类,胶质瘤被分为四个等级,其中一级和两级为良性肿瘤,三级和四级为恶性肿瘤。
胶质瘤的症状和诊断
胶质瘤的症状包括头痛、晕厥、恶心和呕吐、精神失常等。
诊断胶质瘤需要进行脑部影像学检查,头部CT或MRI可用于确定嗜铬细胞瘤的病变位置和大小。
胶质瘤的治疗
目前针对胶质瘤的治疗包括手术切除、放疗和化疗等多种方法。
手术切除是目前胶质瘤治疗的首要选择,但由于胶质瘤的位置和大小不同,手术切除并不能完全去除瘤体。
放疗和化疗是在手术切除后进行的辅助治疗。
胶质瘤治疗中的综合护理
在胶质瘤治疗的过程中,同时进行综合护理可以有效缓解患者的痛苦。
综合护理包括饮食调理、药物治疗和心理治疗等,可以提高患者的生活质量和治疗效果。
在药物治疗方面,目前已经出现了很多针对胶质瘤的靶向药物,这些药物对提高治疗效果有明显的作用。
胶质瘤的预后和复发
胶质瘤的预后和复发与治疗的效果有很大关系。
良性肿瘤的预后较好,恶性肿瘤的预后则较差。
胶质瘤的复发率相对较高,需要密切的随访和治疗。
作为一种常见的神经系统肿瘤,胶质瘤的治疗和管理是一个十分复杂的过程。
综合护理和治疗仍然存在很大的发展空间,加强科研和临床实践有助于提高胶质瘤治疗的效果和预后,为患者带来更多的福音。