各类烃的化学性质
- 格式:ppt
- 大小:1.03 MB
- 文档页数:18
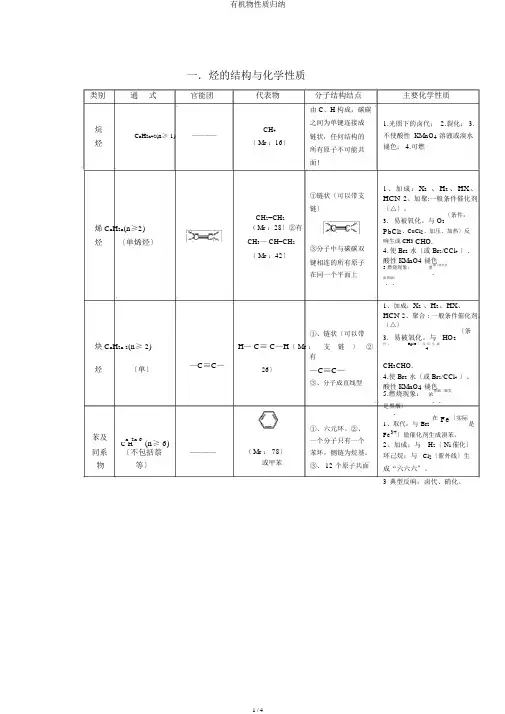
一.烃的结构与化学性质类别通式官能团烷C n H2n+2(n≥ 1)————烃烯C n H2n(n≥2)烃〔单烯烃〕炔C n H2n-2(n≥ 2)代表物分子结构结点由 C、H 构成,碳碳之间为单键连接成CH4链状,任何结构的〔 Mr :16〕所有原子不可能共面!①链状〔可以带支链〕CH2=CH2(Mr :28〕②有CH3— CH=CH2③分子中与碳碳双〔 Mr :42〕键相连的所有原子在同一个平面上①、链状〔可以带H— C≡ C—H〔Mr:支链〕②有主要化学性质1.光照下的卤代;2.裂化;3.不使酸性 KMnO4溶液或溴水褪色; 4.可燃1、加成:X2、H2、HX、HCN2、加聚:一般条件催化剂〔△〕。
3.易被氧化。
与 O2〔条件:PbCl2、CuCl2、加压、加热〕反响生成 CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:黑烟〔炔类是.浓黑烟〕..1、加成:X2、H2、HX、HCN 2、聚合 : 一般条件催化剂。
〔△〕3.易被氧化。
与 HO2〔条件:HgSO 〕反应生成4烃〔单〕—C≡C—26〕—C≡C—③、分子成直线型CH3CHO.4.使 Br2水〔或 Br2/CCl4〕、酸性 KMnO4褪色5.燃烧现象:浓黑烟〔烯类..是黑烟〕.苯及n 2n-6(n≥ 6)C H同系〔不包括萘————物等〕(Mr : 78〕或甲苯①、六元环。
②、一个分子只有一个苯环,侧链为烷基。
③、 12 个原子共面1、取代:与 Br2在Fe〔实际是Fe3+〕做催化剂生成溴苯。
2、加成:与H2〔 Ni 催化〕环己烷;与Cl2〔紫外线〕生成“六六六〞。
3典型反响:卤代、硝化。
二.烃的衍生物的结构与化学性质类别通式一卤代烃:卤代R—X烃多元饱和卤代烃:Cn H2n+2-m X m一元醇:R—OH醇饱和多元醇:C n H2n+2O m醚R—O—R′酚醛酮羧酸酯官能团卤原子—X醇羟基—OH醚键酚羟基—OH醛基羰基羧基酯基代表物C2H5Br(Mr : 109〕CH3OH(Mr : 32〕C2 H5 OH(M r : 46〕C2H5O C2H5(M r : 74〕(M r : 94〕HCHO(M r : 30〕(M r : 44〕(M r : 58〕(M r : 60〕HCOOCH3(M r : 60〕(M r : 88〕分子结构结点主要化学性质卤素原子直接与烃基 1.与 NaOH 水溶液共热发生取结合代反响生成醇β-碳上要有氢原子才 2.与 NaOH 醇溶液共热发生消能发生消去反响去反响生成烯羟基直接与链烃基结1.跟活泼金属反响产生 H22.跟卤化氢或浓氢卤酸反响生合, O—H 及 C—O 均成卤代烃有极性。

烃的性质与应用了解烃的性质与应用领域烃的性质与应用烃是由碳和氢组成的有机化合物,是化学界的基础。
它们通常以烷烃、烯烃和芳香烃三类为主要代表,具有丰富的性质和广泛的应用领域。
本文将讨论烃的性质以及在各个应用领域中的应用。
一、烃的性质烃作为有机化合物,有以下几个基本性质:1. 沸点和熔点:一般来说,烃的分子量越大,其沸点和熔点越高。
由于分子间的范德华力增加,相应的在固态或液态下,分子间的相互作用力也增加,所以烃的熔点和沸点会升高。
2. 可燃性:烃具有较高的可燃性,可以在空气中燃烧,释放出大量的热能和二氧化碳。
这也是烃被广泛应用于燃料领域的重要原因之一。
3. 溶解性:烃通常是非极性溶剂,可以溶解其他非极性物质,如脂肪、蜡、树脂等。
但对于极性物质如水、醇类溶解度很小。
4. 较低的化学活性:烃分子通常是稳定的,不容易发生化学反应。
但是,通过引入一些功能基团,可以增加烃的反应性,从而实现更多的应用。
二、烃在能源领域的应用1. 燃料:由于烃具有高能量和易得性的特点,被广泛应用于各种类型的燃料中,如汽车燃料、航空燃料、工业燃料等。
2. 天然气:天然气是一种主要由甲烷组成的烃类,作为清洁、高效的能源供应方式,广泛应用于城市燃气、工业生产等领域。
三、烃在化工领域的应用1. 原料:烃是化工行业的重要原料,被用于制造各种化学产品,如涂料、塑料、橡胶、纤维等。
2. 合成:通过合成技术,可以将烃转化为更有价值的化学品,如烯烃和芳香烃,为化工行业开发出更多新型材料提供了基础。
四、烃在医药领域的应用1. 药物:烃类化合物被广泛应用于药物研发过程中的合成和结构优化,为创造新的药物提供了基础。
2. 医疗设备:烃类化合物广泛应用于医用塑料、医用橡胶等医疗设备的制造,如输液管、注射器等。
五、烃在环境保护领域的应用1. 治理污染:由于烃的可燃性和挥发性,可应用于处理环境污染事故,如油污的清洁、溃矿水体的处理等。
2. 可持续能源:通过开发和利用生物烃,如生物柴油、生物甲烷等,可以减少对传统石油资源的依赖,实现可持续能源发展。


烃的结构和性质烃是一类由碳和氢组成的有机化合物,根据碳原子之间的化学键情况不同,可以分为四大类:烯烃、烷烃、炔烃和芳香烃。
烯烃是由碳原子之间存在一个碳碳双键的化合物。
由于烯烃分子中存在碳碳双键,所以它们具有较高的化学反应活性。
烯烃分子可以进行加成反应、环加成反应和聚合反应等。
根据双键的位置,烯烃可分为内烯烃和外烯烃。
内烯烃是双键处于分子内部的烯烃,外烯烃是双键处于分子末端的烯烃。
例如,乙烯就是一种最简单的烯烃,其分子式为C2H4烷烃是由碳原子之间只存在碳碳单键的化合物。
烷烃分子中的碳原子通过单键相连,形成直链或支链结构。
由于烷烃分子中不存在双键或三键,因此它们的化学反应活性相对较低。
烷烃主要参与燃烧反应,是石油和天然气等石化工业的主要原料。
按照分子中的碳原子数目,烷烃可分为甲烷、乙烷、丙烷等多个类别,其中甲烷(CH4)是最简单的一种烷烃。
炔烃是由碳原子之间存在一个碳碳三键的化合物。
由于炔烃分子中存在碳碳三键,所以它们的化学反应活性较高。
炔烃分子可以进行加成反应、环加成反应和聚合反应等。
炔烃也可以参与燃烧反应,与氯气、溴气等发生加成反应,制备卤代烃。
乙炔(C2H2)是最简单的炔烃。
芳香烃是由苯环结构组成的化合物。
苯环由碳原子和氢原子交替连接而成,其中每个碳原子都被一个氢原子取代。
芳香烃分子中的苯环具有稳定的共轭结构,因此芳香烃比非芳香烃更稳定。
芳香烃具有较低的反应活性,不容易发生加成反应和氧化反应。
苯(C6H6)是最简单的芳香烃。
总体来说,烯烃、烷烃、炔烃和芳香烃都属于烃类化合物,它们的结构和性质有一些共同特点,也有一些明显区别。
其中,烯烃和炔烃具有较高的反应活性,容易发生加成反应和聚合反应;烷烃的反应活性相对较低,主要参与燃烧反应;芳香烃由于具有稳定的共轭结构,比非芳香烃更稳定,反应活性较低。

初中一年级化学烃类的命名和性质化学是一门研究物质的科学,其中烃类是化学中一个重要的分支。
烃类是由碳和氢元素组成的有机化合物,它们在生活和工业中扮演着重要的角色。
本文将介绍初中一年级化学中烃类的命名和性质。
一、烃类的命名烃类根据碳原子数可以分为烷烃、烯烃和炔烃。
它们具有不同的结构和命名规则。
1. 烷烃烷烃是由碳原子通过单键连接而成的烃类。
根据碳原子数的不同,它们的命名也有所不同。
以甲烷为例,甲烷由一个碳原子和四个氢原子组成,其命名规则是将烷烃的碳原子数作为前缀,再加上"-ane"作为后缀。
所以,甲烷的中文名就是一碳烷烃。
2. 烯烃烯烃是由碳原子通过一个或多个双键连接而成的烃类。
在命名时,需要标记双键的位置。
以乙烯为例,乙烯由两个碳原子和四个氢原子组成,其命名规则是将烯烃的碳原子数作为前缀,再加上"-ene"作为后缀。
同时,需要在碳原子数前面加上双键的位置,以数字表示。
所以,乙烯的中文名就是两碳烯烃。
3. 炔烃炔烃是由碳原子通过一个或多个三键连接而成的烃类。
在命名时,需要标记三键的位置。
以乙炔为例,乙炔由两个碳原子和两个氢原子组成,其命名规则是将炔烃的碳原子数作为前缀,再加上"-yne"作为后缀。
同时,需要在碳原子数前面加上三键的位置,以数字表示。
所以,乙炔的中文名就是两碳炔烃。
二、烃类的性质烃类具有一些特殊的物理和化学性质,下面将介绍其中的几个。
1. 燃烧性质烃类是一种易燃物质,它们在适当的条件下可以燃烧。
烷烃的燃烧产物主要是二氧化碳和水,烯烃和炔烃的燃烧产物还会产生一些其他的气体。
这也是烃类经常用作燃料的原因之一。
2. 密度和沸点烃类的密度和沸点与其分子量有关。
一般来说,烃类的分子量越大,密度和沸点也越高。
这是由于分子量大的烃类分子间的引力较强,使得密度和沸点升高。
3. 反应性烃类还具有一定的反应性。
例如,烯烃和炔烃可以发生加成反应和聚合反应,产生新的化合物。

初中化学知识点归纳烃类化合物的分类和性质初中化学知识点归纳—烃类化合物的分类和性质烃是由碳和氢构成的有机化合物,可分为脂肪烃、烯烃、炔烃和环烃四个类别。
本文将分别介绍这四类烃的命名规则、结构特点以及常见的物理和化学性质。
一、脂肪烃脂肪烃由碳原子链组成,分为直链和支链两种。
命名规则为“烷+烯(表示含有双键)+炔(表示含有三键)+环”。
1. 直链烷烃:由碳原子链直接连接而成,通式为CnH2n+2。
例如,甲烷、乙烷等。
直链烷烃的物理性质与碳原子数目有关,随着碳原子数目的增加,沸点和密度也逐渐升高。
2. 支链烷烃:在碳链上含有分支,通式为CnH2n。
例如,异丙烷、异丁烷等。
支链烷烃的物理性质通常与直链烷烃相比较,熔点、沸点和密度较低。
二、烯烃烯烃是含有碳碳双键的烃类化合物,分为直链烯烃、支链烯烃和环烯烃三种。
1. 直链烯烃:由碳原子链构成,其中至少有一个碳碳双键。
命名规则为“烯+烷+二烯(表示有两个双键)”等。
例如,乙烯、丙烯等。
直链烯烃通常为无色气体,密度较小。
2. 支链烯烃:在碳链上含有分支,同时有碳碳双键存在。
支链烯烃的物理性质与直链烯烃类似,但熔点和沸点通常较低。
3. 环烯烃:由碳原子组成的环状结构,其中至少有一个碳碳双键。
例如,环己烯、环戊烯等。
环烯烃的物理性质与直链烯烃相似,但由于环状结构的存在,活性可能增加。
三、炔烃炔烃是含有碳碳三键的烃类化合物,常常具有较高的活性。
根据碳原子链的不同,炔烃可以分为直链炔烃和环炔烃两种。
1. 直链炔烃:由碳原子链构成,其中至少有一个碳碳三键。
命名规则为“炔+烷+炔(表示有两个三键)”等。
例如,乙炔、丙炔等。
直链炔烃为无色气体,密度较小。
2. 环炔烃:由碳原子组成的环状结构,其中至少有一个碳碳三键。
例如,环丙炔、环戊炔等。
环炔烃的物理性质与直链炔烃类似,但由于环状结构的存在,活性可能增加。
四、环烃环烃是由碳原子构成的环状结构,其中没有双键或三键。
根据环的数目,环烃可以分为单环烃、多环烃和螺环烃等。


各类有机物性质一览表有机物是由碳和氢等元素组成的化学物质,其性质多种多样。
本文将为您提供一份各类有机物性质的一览表,帮助您更好地了解和掌握有机化学的知识。
一、烃类烃类是由碳和氢组成的有机化合物,包括烷烃、烯烃和炔烃三类。
1. 烷烃(Alkanes):- 物理性质:a) 烷烃一般为无色气体或液体,随碳链增长而升高沸点和融点。
b) 烷烃的密度较小,常用比重瓶法测定。
- 化学性质:a) 烷烃可以发生取代反应,如卤代烷生成取代产物。
b) 在适当条件下,烷烃还可以发生燃烧反应,生成二氧化碳和水。
2. 烯烃(Alkenes):- 物理性质:a) 烯烃常见的是无色气体或液体,在室温下存在。
b) 烯烃的密度通常较小。
- 化学性质:a) 烯烃可以进行加成反应,如与溴水生成溴代烷。
b) 烯烃还可以进行聚合反应,生成高分子化合物。
3. 炔烃(Alkynes):- 物理性质:a) 炔烃一般为无色气体或液体。
b) 炔烃的密度相对较小。
- 化学性质:a) 炔烃可以进行加成反应,如与溴水生成溴代炔烃。
b) 炔烃可以和水反应生成醛和酮。
二、醇类醇是含有羟基(—OH)的有机化合物。
1. 一元醇(Monohydroxy Alcohols):- 物理性质:a) 一元醇常见的是无色液体。
b) 醇的氢键使其具有比醚、酮和醛有更高的沸点。
- 化学性质:a) 一元醇可以发生酯化反应,生成酯类化合物。
2. 二元醇(Polyhydroxy Alcohols):- 物理性质:a) 二元醇一般为无色液体。
b) 二元醇的水溶液具有较高的粘度。
- 化学性质:a) 二元醇可以发生糖化反应,生成糖类化合物。
三、酮类酮是含有羰基(C=O)的有机化合物。
1. 简单酮(Simple Ketones):- 物理性质:a) 简单酮常为无色液体。
b) 酮的沸点较相应的醇和醚高。
- 化学性质:a) 简单酮可以发生还原反应,生成相应的醇。
2. 糖酮(Sugar Ketones):- 物理性质:a) 糖酮常为无色或白色固体。

24 烃和卤代烃的结构和性质知识清单【知识网络】1.烃类的组成、结构与性质2.烃类的转化规律【知识归纳】考点1 烷烃一、烷烃的结构和物理性质1.烷烃的结构2.烷烃的物理性质(1)状态:当碳原子数小于或等于4时,烷烃在常温下呈气态(2)溶解性:不溶于水,易溶于苯、乙醚等有机溶剂(3)熔、沸点①碳原子数不同:碳原子数的越多,熔、沸点越高;CH3CH2CH2CH2CH2CH3>CH3-CH2CH3②碳原子数相同:支链越多,熔、沸点越低CH3CH2-CH2CH3>CH3-CH3③碳原子数和支链数都相同:结构越对称,熔、沸点越低CH 3-CH 2CH 3>(4)密度:随碳原子数的增加,密度逐渐增大,但比水的小 二、烷烃的化学性质1.稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂和还原剂都不发生反应。
(1)性质(2)烷烃不能使酸性高锰酸钾溶液褪色 2.氧化反应(1)可燃性:C n H 2n +2+213 n O 2n CO 2+(n +1)H 2O(2)KMnO 4(H +):不褪色3.分解反应:烷烃受热时会分解产生含碳原子数较少的烷烃和烯烃 C 16H 34C 8H 16+C 8H 184.取代反应(1)反应举例:CH 3CH 3+Cl 2CH 3CH 2Cl+HCl (一氯取代) (2)反应条件:光照和纯净的气态卤素单质①在光照条件下烷烃能够使溴蒸汽褪色 ②在光照条件下烷烃不能使溴水褪色。
③在光照条件下烷烃不能使溴的四氯化碳溶液褪色。
④液态烷烃能够和溴水发生萃取,液体分层,上层颜色深,下层颜色浅。
(3)化学键变化:断裂C -H 键和X -X 键;形成C -X 键和H -X 键(4)取代特点:分子中的氢原子被卤素原子逐步取代,往往是各步反应同时发生 (5)产物种类:多种卤代烷烃的混合物,HX 的物质的量最多 (6)产物的量①根据碳元素守恒,烷烃的物质的量等于所有卤代烷烃的物质的量之和 ②根据取代反应的特点,有机物中卤素的物质的量等于HX 的物质的量等于反应了的X 2的物质的量,即反应了的n (X 2)=n (一卤代物)+2n (二卤代物)+3n (三卤代物)+……=n (HX )=n (C -X )考点2 烯烃一、烯烃的结构和物理性质 1.结构特点(1)烯烃的官能团是碳碳双键()。
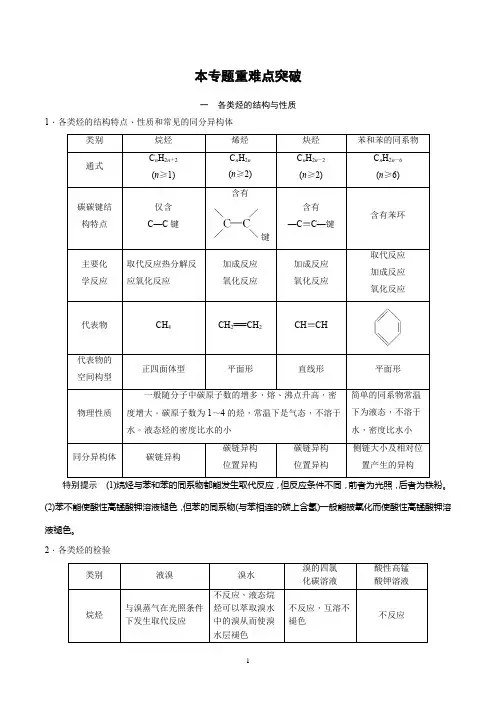
本专题重难点突破一各类烃的结构与性质1.各类烃的结构特点、性质和常见的同分异构体含有键特别提示(1)烷烃与苯和苯的同系物都能发生取代反应,但反应条件不同,前者为光照,后者为铁粉。
(2)苯不能使酸性高锰酸钾溶液褪色,但苯的同系物(与苯相连的碳上含氢)一般能被氧化而使酸性高锰酸钾溶液褪色。
2.各类烃的检验特别提示应用上述性质可以解决不同类型烃的鉴别问题,同时要特别注意条件(如液溴、溴水、溴的四氯化碳溶液、光照、催化剂等)对反应的影响。
例1有4种无色液态物质:己烯、己烷、苯和甲苯,符合下列各题要求的分别是(1)不能与溴水或酸性KMnO4溶液反应,但在FeBr3作用下能与液溴反应的是________,生成的有机物名称是________,反应的化学方程式为__________________________________________________________________________________________________________。
此反应属于__________反应。
(2)与溴水或酸性KMnO4溶液都不反应的是__________________________。
(3)能与溴水和酸性KMnO4溶液反应的是____________________________。
(4)不与溴水反应但与酸性KMnO4溶液反应的是__________。
二烃类燃烧的规律1.烃完全燃烧前后气体体积变化规律烃完全燃烧的通式:C x H y+(x+y4)O2―――→点燃x CO2+y2H2O(1)燃烧后温度高于100 ℃,即水为气态ΔV=V后-V前=y4-1①y=4时,ΔV=0,体积不变;②y>4时,ΔV>0,体积增大;③y<4时,ΔV<0,体积减小。
(2)燃烧后温度低于100 ℃时,即水为液态ΔV=V前-V后=1+y4,总体积减小。
特别提示烃完全燃烧时,无论水是气态还是液态,燃烧前后气体体积变化都只与烃分子中的氢原子数有关,而与烃分子中碳原子数无关。

烃及其衍生物的化学性质一、烷烃:1.取代反应——特征反应烷烃可与纯卤素单质在光照下发生取代反应生成卤代烃和卤化氢,如乙烷与氯气反应生成一氯乙烷和氯化氢。
2.氧化反应——可燃性烷烃可在空气或氧气中完全燃烧生成CO2和H2O燃烧的通式:O2点燃nCO2+(n+1)H20C n H2n+2+3n+123.分解反应——高温裂化或裂解烷烃受热时会分解产生含碳原子数较少的烷烃和烯烃。
二、烯烃:1.氧化反应:(1)燃烧通式:(2)烯烃能使酸性高锰酸钾溶液褪色。
2.加成反应:(1)丙烯与溴的四氯化碳溶液发生反应的化学方程式:(2)二烯烃的1,2-加成与1,4-加成3.加聚反应:丙烯发生加聚反应的方程式:三、炔烃(乙炔为例):(1)氧化反应:①能使酸性高锰酸钾溶液褪色。
②能燃烧:火焰明亮,并伴有浓烈的黑烟;乙炔燃烧:(2)加成反应:(3)乙炔的实验室制法:①实验装置四、苯1.取代反应:2.加成反应:3.氧化反应:五、苯的同系物1.取代反应——卤代反应苯环和侧链都能发生取代反应,但条件不同。
(1)苯环上的氢被取代(2)烷基氢被取代取代反应——硝化反应甲苯与浓硝酸和浓硫酸的混合物在加热条件下可以发生取代反应,生成一硝基取代物、二硝基取代物和三硝基取代物,硝基取代的位置均以甲基的邻、对位为主。
其中生成三硝基取代物的化学方程式如下:2.加成反应:甲苯与氢气在Pt作催化剂和加热的条件下能发生加成反应:3,氧化反应:(1)苯及其同系物都能燃烧,火焰明亮,有大量黑烟。
O2点燃nCO2+(n-3)H20C n H2n-6+3n−32(2)与溴水反应(不反应!!!):苯与甲苯均不能发生化学反应,苯和甲苯的密度比水小,溴水的密度大于苯和甲苯的密度,溴易溶于苯和甲苯中,故苯和甲苯能够萃取溴。
(3)与酸性高锰酸钾反应苯不与酸性高猛酸钾反应,甲苯可以与酸性高猛酸钾反应,甲苯可以使酸性高猛酸钾溶液褪色,这是由于苯环上的甲基被酸性高锰酸钾氧化的结果(侧链氧化)。
烃的分类和性质烃是一类由碳和氢组成的有机化合物,它们是化学界中最基本的化合物之一。
烃可以根据分子结构和性质的不同而进行分类。
本文将介绍烃的分类和性质,并探讨它们在化工和生活中的应用。
一、烃的分类根据分子结构和碳原子之间的连接方式,烃可以分为以下几类:烷烃、烯烃和炔烃。
1. 烷烃:烷烃是由碳原子通过单键连接形成的链状结构化合物。
烷烃的通用分子式为CnH2n+2,其中n代表碳原子数。
常见的烷烃有甲烷、乙烷、丙烷等。
烷烃是最简单的烃类,由于其分子中只含有碳碳单键和碳氢键,分子间的相互作用较弱,常见于天然气和石油中。
2. 烯烃:烯烃是由碳原子通过一个或多个双键连接形成的化合物。
烯烃的通用分子式为CnH2n,其中n代表碳原子数。
常见的烯烃有乙烯、丙烯、苯乙烯等。
烯烃比烷烃分子中含有的双键使得它们更加活泼,具有较强的反应性。
3. 炔烃:炔烃是由碳原子通过一个或多个三键连接形成的化合物。
炔烃的通用分子式为CnH2n-2,其中n代表碳原子数。
常见的炔烃有乙炔、丙炔等。
炔烃由于含有三键,在化学反应中起到重要的作用,例如乙炔和氯气反应可以生成氯乙烯。
二、烃的性质1. 物理性质:烃通常是无色无味的液体或气体,随着碳原子数的增加,它们的沸点和熔点增加。
此外,由于烃分子中只含有碳氢键,分子间的相互作用较弱,使得烃具有较低的溶解度。
2. 化学性质:烃可以发生多种化学反应,例如燃烧、加氢、卤代反应等。
其中,烃的燃烧是最常见的反应,它们与氧气反应可以生成二氧化碳和水。
另外,在适当的催化剂存在下,烯烃和炔烃可以发生加氢反应,使得双键或三键转化为饱和的单键。
三、烃的应用烃在化工和生活中有广泛的应用。
1. 燃料:由于烃具有较高的燃烧热值和可燃性,常常被用作燃料。
烷烃类燃料如天然气、液化石油气等直接用于供暖、烹饪等生活用途,而汽油、柴油等则作为交通工具的燃料。
2. 化工原料:烃是化工行业中重要的原料之一,广泛应用于合成农药、塑料、橡胶、涂料、染料等产品。
有机物烃及其衍生物性质总结 2014.3.3一.物理性质总结1.烃类物理性质总结①分子中碳原子数≤4时为气体,随着分子中碳原子数的递增,熔沸点升高,相对密度逐渐增大,常温下的存在状态由气态过渡到液态、固态;②.难溶于水,易溶于有机溶剂;③.密度比水小,与水混合后均在上层,为无色油状液体。
2.常见有机物的状态①常温下为固体的有:饱和高级脂肪酸、饱和高级脂肪酸甘油酯(油脂)、高级脂肪酸盐、所有糖类、所有高分子化合物、三溴苯酚、三硝基苯酚、三硝基甲苯TNT等均为固体。
(所有的高分子化合物、油脂一定是混合物)、苯酚、醋(16.6℃以下)②液态:油状:硝基苯、溴乙烷、乙酸乙酯、油酸粘稠状:石油、乙二醇、丙三醇,烃[C x H Y]:当x>4时。
(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH 甲酸HCOOH乙醛CH3CHO ★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态③气态:气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷a 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态b衍生物类:一氯甲烷(...HCHO....,沸点为....-.21℃...)......).甲醛(.....CH..3.Cl..,.沸点为...-.24.2℃3. 气味:无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味))稍有气味:乙烯(植物生长的调节剂) 芳香气味,有一定的毒性,尽量少吸入:苯及苯的同系物、石油、苯酚刺激性:甲醛、甲酸、乙酸、乙醛甜味:乙二醇(甘醇)、丙三醇(甘油)、蔗糖、葡萄糖香味:乙醇、低级酯苦杏仁味:硝基苯4. 密度比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油,烃类密度均小于水。
比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯5. 挥发性:乙醇、乙醛、乙酸6.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。