探索酸的性质之酸的个性-课件
- 格式:ppt
- 大小:315.50 KB
- 文档页数:14



酸的种类与性质酸是我们日常生活中常见的物质之一。
它们具有特殊的性质,可以对其他物质产生影响。
酸的种类和性质是多样的,我们在学习化学的过程中会常常接触到这些知识。
本文将介绍一些常见的酸的种类与性质,以及它们在生活中的应用。
首先,让我们来谈谈酸的定义。
在化学中,酸是指一类具有特定性质的物质,能够产生氢离子(H+)。
根据酸性的程度,酸可以分为强酸和弱酸。
强酸是指能够完全电离生成H+的酸,如盐酸(HCl)和硫酸(H2SO4);而弱酸只能电离一部分生成H+,如醋酸(CH3COOH)和碳酸(H2CO3)。
常见的酸种类非常多,我们来逐个了解一下。
第一个就是硫酸,它是一种强酸,具有强烈的腐蚀性。
它被广泛应用于工业生产中,例如制造肥料、合成化学品和清洁剂等。
其次是盐酸,也是一种强酸,常用于清洁金属表面和调节PH值。
磷酸也是一种常见的酸,常用于制造肥料和食品添加剂。
此外,还有氢氟酸和氢氯酸,它们具有强烈的腐蚀性,用途广泛,如制造玻璃和金属加工等。
除了无机酸,有机酸也是一类重要的酸。
有机酸来源于生物体,包括水果、蔬菜和动物体内的代谢产物等。
例如柠檬酸是一种常见的有机酸,存在于柠檬和其他柑橘类水果中。
它被广泛用于食品和饮料工业,具有酸味增强和防腐的作用。
苹果酸是另一种常见的有机酸,存在于苹果中,可用于食品和药物工业。
除了酸的种类,酸的性质也是我们需要了解的。
首先是酸的酸度。
酸度表示酸的浓度和反应性的强弱程度。
一般来说,酸度高的酸具有较强的腐蚀性和反应性。
此外,酸还具有与金属反应产生氢气的性质。
当酸与金属反应时,会产生相应的金属盐和氢气。
酸还可以与碱进行中和反应,生成盐和水。
这是因为酸和碱具有互补的性质。
酸呈酸性,而碱呈碱性,它们的中和反应会产生中性的盐和水。
这是我们在日常生活中使用盐和水的原理。
酸在生活中的应用非常广泛。
首先是食品和饮料工业。
酸作为食品中的调味剂和防腐剂,能够增加食品的口感和延长食品的保质期。
其次是医药工业。



§1.2探索酸的性质(3-4课时)【教学目的】【知识重点和难点】重点:酸的共性和三种常见酸的个性,会测定溶液的酸碱性和酸碱度难点:酸的共性和个性的生活应用【教学准备】实验仪器:第一课时:盐酸、硫酸(浓,稀)、硝酸、,酚酞、石蕊试剂,蓝色红色石蕊试纸,白醋、水、酸果汁、盐酸,玻璃棒、点滴板第二课时:试管多支,盐酸、石蕊、氢氧化钠、氢氧化铝、鸡蛋壳、铁钉(生锈的和不生锈的)、氧化铜,氧化铁粉末第三课时:试管、锌、氧化铁粉末、氧化铜、硫酸铜和氢氧化钠(制氢氧化铜)氯化钡溶液第四课时:浓盐酸、浓硫酸、稀盐酸、稀硫酸,硝酸银、试管、玻璃棒、烧杯,纸,硝酸学生课前准备:第一课时:学生自制酸碱指示剂,第四课时:查阅酸的用途,调查酸(雨)的污染【课时安排】共4课时,第1、2知识块1课时,第3知识块2课时(包括探究活动),第4知识块1课时。
【教学过程】验,课后继续课外探究:花的颜色除了和色素有关以外,和土壤的酸碱性是否有一定的关系习题:1、下列物质不属于酸的是()A、HNO3B、NaHCO3C、H3PO4D、HI2、用简单的方法区别水和硫酸,并写出实验步骤3、思考:一位科学家在做研究时不小心将盐酸滴到了紫花上,紫花逐渐变红色。
看到这么个现象,许多问题在他的脑子里涌现出来,如果你是那个科学家,你会有什么问题,你会有什么想法?培养应用提高学生从现象和材料中提出问题的能力知识的能力作业:预习酸有那些性质,找出更多的区别水和盐酸的方法为下节课做准备●板书一、酸:酸是在水中电离时,生成的阳离子都是(H+)这一种粒子的一类物质(三种强酸和醋酸的电离方程式)二、酸碱指示剂第2课时●教学过程设计教师活动学生活动设计意图问题:上节课的作业题:除了用酸碱指示剂和PH试纸外,还可以用什么方法区分水和盐酸溶液?回答检查学生的预习情况,培养自学能力,自主解决问题的能力板书酸的共性1、铁和稀盐酸反应:Fe + 2HCl=== FeCl2 + H22、(1)氧化铁和稀盐酸反应:Fe2O3 + 6HCl=== 2FeCl3 + 3H2O (2)氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O3、(1)盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O (2)氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O 4、某某石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑第三课时。



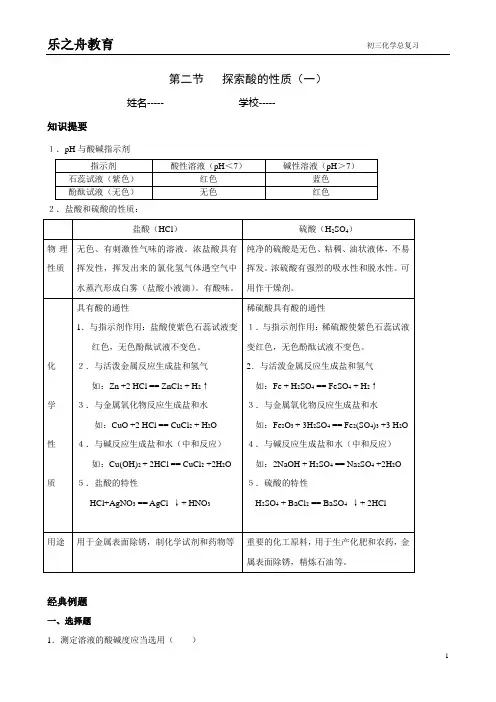
第二节探索酸的性质(一)姓名----- 学校-----知识提要1.pH与酸碱指示剂2.盐酸和硫酸的性质:经典例题一、选择题1.测定溶液的酸碱度应当选用()A.紫色石蕊试液B.pH试纸C.无色酚酞试液D.以上都可以2.能把稀盐酸、水和氢氧化钠三种无色溶液鉴别出来,应选择()A.石蕊试液B.无色酚酞C.紫色石蕊试液和氯化钡溶液D.硝酸银溶液3.土壤的酸碱度直接影响农作物的生长,已知某地土壤显微酸性,从土壤的酸碱性考虑在该地区不适宜种植的作物是()A.西瓜B.甘草C.小麦D.油菜4.区别稀盐酸和稀硝酸,选用的试剂是()A.AgNO3B.Na2CO3 C.BaCl2 D.石蕊试剂5.能跟盐酸反应放出可燃性气体的是()A.Na2CO3B.NaHCO3C.Zn D.AgNO36.要除去硝酸中溶有的少量盐酸选用()A.硝酸银B.氢氧化钠C.金属铜D.金属锌7.根据果汁瓶标签上标出的化学物质,请你运用学过的有关知识解答下列各题。
(1)这种果汁喝起来有酸味,则对果汁pH的判断,正确的是()A.pH>7 B.pH=7 C.pH<7 D.pH=14(2)已知苯甲酸钠是一种防腐剂,化学方程式是C6H5COONa。
下列各组中,前面一个数表示苯甲酸钠中元素的种类,后面一个数表示1个苯甲酸钠分子中原子的个数,正确的一组是()A.4 15 B.5 16 C.6 15 D.4 68.如图,往稀盐酸中滴加氢氧化钠溶液至完全中和时,溶液的pH变化的图象正确的是()二、填空题 9.认识酸(1)写出下列物质的化学式:盐酸 硫酸 硝酸 (2)盐酸、硫酸、硝酸电离时生成的 全部是 ,所以它们都是 。
(3)根据酸的分子里是否含有氧原子,可以把酸分为含氧酸和无氧酸,上述三种酸中,属于含氧酸的是 。
(4)酸溶液的pH 值 7(<、>、=),酸溶液中加入石蕊溶液,变 色。
10.指出下列物质中加入石蕊试液或酚酞试液后的颜色变化:11.盐酸的主要化学性质:12.将一枚生锈的铁钉放入足量的盐酸中,先观察到的现象是 ,化学方程式为 ;过一会又观察到的现象 是 ,化学方程式是。

《酸的化学性质》课件课件内容:酸的化学性质一、引言酸是一种重要的化学物质,它在化学反应中表现出多种性质。
了解酸的化学性质对于理解化学反应和解决化学问题至关重要。
本课件将详细介绍酸的化学性质,并通过实例解释其应用。
二、定义酸是一种能够解离出氢离子(H+)的化合物。
这种解离过程使得酸溶液具有独特的酸性性质。
酸的通式为HA,其中A代表酸根。
常见的酸包括盐酸(HCl)、硫酸(H2SO4)和硝酸(HNO3)。
三、酸性表述1、酸性强度酸的强度指其解离出氢离子的能力。
在水中,酸的解离程度取决于其酸性强度。
强酸如盐酸和硝酸能够完全解离成氢离子和酸根,而弱酸如乙酸只能部分解离。
酸性强度通常用pH值表示,pH值越小,酸性越强。
2、酸碱反应酸与其他化合物之间的反应称为酸碱反应。
在这种反应中,酸提供氢离子与碱的碱性部分结合,形成水和盐。
例如,盐酸与氢氧化钠反应生成氯化钠和水:HCl + NaOH → NaCl + H2O。
酸碱反应在化学工业中有广泛应用,如制造纤维素、染料和药物等。
3、氧化还原反应酸在氧化还原反应中扮演重要角色。
例如,在电池中,酸提供了氢离子作为反应的媒介。
在酸的存在下,金属如铁和铜能够进行氧化还原反应,生成相应的金属离子和氢气。
这些反应对于工业生产和生活应用具有重要意义。
四、盐类化合物酸与碱反应生成的盐类化合物在化学反应中具有重要作用。
盐可以电离出金属离子和酸根,这些离子在许多化学反应中起着关键作用。
例如,氯化钠(NaCl)是一种重要的盐,它广泛用于食品加工和医疗行业。
在酸性环境中,盐类化合物可能发生化学反应,如沉淀反应或气体生成反应,这使得酸碱反应更加复杂和丰富。
五、总结酸的化学性质主要包括酸性强度、酸碱反应和氧化还原反应等方面。
这些性质在化学工业、生活应用和科学研究等领域具有广泛的应用价值。
了解酸的化学性质有助于我们更好地理解化学反应的机制,解决化学问题,并探索新的化学反应和合成方法。
通过本课件的学习,我们深入了解了酸的化学性质及其应用。
第一章探索物质的变化第二节探索酸的性质—盐酸一、学习目标:1、认知目标:通过实验的观察与分析,了解盐酸的物理性质和用途,初步掌握盐酸的化学性质,理解复分解反应,了解石蕊试液,酚酞试液等酸碱指示剂在酸、碱溶液里的颜色。
2、技能目标:培养学生观察能力、分析归纳能力和实验基本操作能力。
3、情感目标:对学生进行科学态度、科学的学习方法的教育。
二、重点难点:盐酸的化学性质,指示剂在酸碱溶液里的颜色变化。
有关盐酸化学性质的化学方程式。
三、教学方法:实验探讨法。
四、教学用具:1、仪器:试管、滴管、镊子、试管夹、酒精灯(附火柴)等。
2、药品:锌粒、镁条、新制氢氧化铜、碳酸钙粉末、氧化铜、酚酞试液、石蕊试液、浓盐酸、工业盐酸、稀盐酸、氢氧化钠溶液、硝酸银溶液、稀硝酸。
3、其它:铁钉、锈铁钉。
学习盐酸和写出剂:附1:课堂练习一1、盐酸是()的水溶液,纯净的盐酸是()色()气味的()体,浓盐酸()腐蚀性,有()性,挥发出来的氯化氢遇水蒸气形成()。
附2:课堂练习二1、如何鉴别失去标签的氢氧化钠溶液和盐酸这两瓶溶液?2、有一根生锈的铁钉放入试管中,然后滴加适量的稀盐酸,观察现象。
先_____________后__________________,写出有关反应的化学方程式__________;________________。
附3:课堂练习三1、下列物质和盐酸反应生成白色沉淀的是()(A)Fe (B)CuO (C)NaOH溶液(D)AgNO3溶液2、在人的胃液中含有少量盐酸有助消化,若胃酸过多会吐酸水,可用来治胃酸过多的药物中主要含有(A)ZnSO4(B)NaCl(C)Al(OH)3(D)AgNO33、下列物质中和盐酸反应生成黄色溶液的是()(A)Fe (B)Zn(C)Cu(OH)2(D)Fe(OH)34、下列物质中能和盐酸反应,既不生成沉淀,又无气体放出且溶液呈无色的是()(A)AgNO3(B)Cu(OH)2(C)NaCO3(D)Al2O3*5、若用浓盐酸和锌反应制氢气,制得氢气中混有氯化氢气体,如何除去混在氢气中的氯化氢气体?附4:随堂检测1、盐酸能使紫色的石蕊试液变(),无色的酚酞试液()色。
九年级科学酸的个性在日常生活中,我们经常会遇到一些酸性物质,比如柠檬汁、醋等。
这些酸性物质不仅有着独特的味道,还具有一些特殊的化学性质。
在九年级科学课程中,我们将深入探究酸的个性及其相关的知识。
本文将介绍酸的定义、特性、性质、应用等方面的内容。
一、酸的定义酸是一类化学物质,其特征在于能够腐蚀金属、导电以及在水中呈现酸性溶液。
酸通常呈现酸性质,并能够与碱发生中和反应。
根据酸所含氢离子的不同数量,可以将其分为单质酸和氧化酸。
单质酸是由非金属元素直接与氢结合而成的化合物,比如盐酸(HCl)和硫酸(H2SO4)。
而氧化酸是由非金属元素与氧原子结合而成的化合物,比如硝酸(HNO3)和硫酸(H2SO4)等。
二、酸的特性1. 酸性溶液的特点:酸性溶液具有酸味、导电性和腐蚀性。
酸溶液中的氢离子(H+)能与溶液中的水分子结合形成氢氧根离子(OH-),使溶液呈现酸性。
2. pH值:用于表示溶液酸碱性的指标,pH值小于7表示酸性。
pH值的计算公式为pH=-log[H+],其中[H+]表示氢离子的浓度。
3. 酸的酸度:酸度是指酸溶液中酸性物质的浓度。
酸溶液的酸度越高,其具有的酸性质越强。
三、酸的性质1. 腐蚀性:酸能够腐蚀金属,使其产生气体。
例如,盐酸与铁反应生成氯化铁和氢气。
2. 反应性:酸与碱之间能够发生中和反应。
酸中的氢离子与碱中的氢氧根离子发生结合,形成盐和水。
3. 酸的强弱:酸的强弱与酸解离度有关,解离度高的酸为强酸,解离度低的酸为弱酸。
例如,盐酸是一种强酸,柠檬汁中的柠檬酸是一种弱酸。
四、酸的应用1. 酸的制备:酸可通过各种化学反应制备得到,比如酸性氧化物与水反应形成的酸性溶液。
2. 酸的家用:酸在生活中有着广泛的应用,例如,柠檬酸可用于调味料、醋可用于制作食品等。
3. 工业应用:酸在工业生产中也具有重要作用,例如,硫酸广泛应用于电池、化肥和塑料的制造。
总结:通过对九年级科学课程中酸的个性的深入了解,我们可以明确酸的定义、特性、性质以及其在实际应用中的作用。