(完整版)水的电离和溶液的酸碱性知识点
- 格式:docx
- 大小:450.11 KB
- 文档页数:7


知识点一 水的电离和水的离子积
、 水的电离
1. 电离平衡和电离程度
① 水是极弱的电解质,能微弱电离:
H 2O+H 2O
H 3O ++OH -,通常简写为 H 2O H ++OH -;ΔH >0
② 实验测得:室温下 1LH2O (即 55.6mol )中只有 1×10-7mol 发生电离,故 25℃时,纯水中 c(H +)=c(OH -)=1 ×10-7mol/L ,平衡常数 K 电离
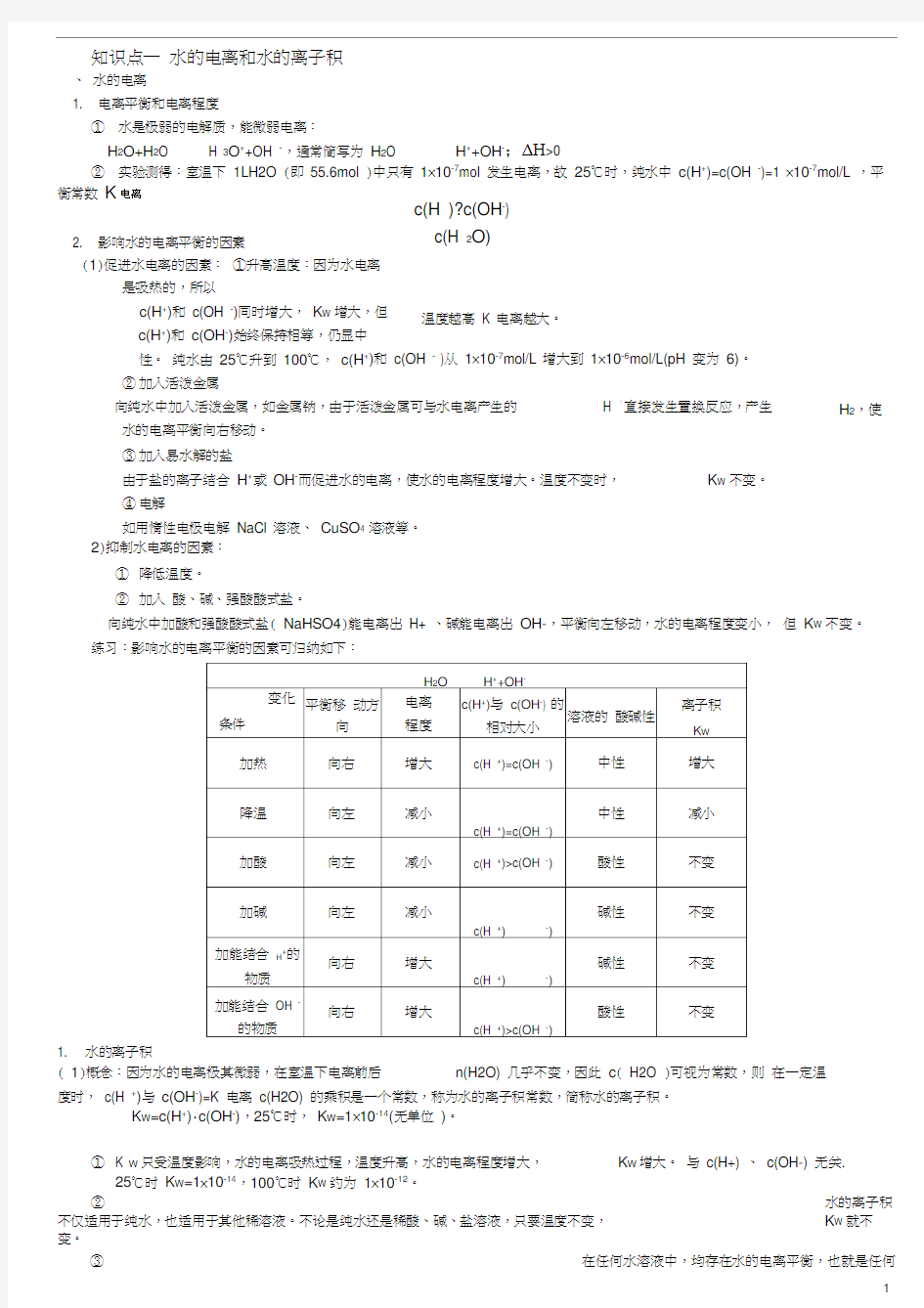
2. 影响水的电离平衡的因素
(1)促进水电离的因素: ①升高温度:因为水电离
是吸热的,所以
c(H +)和 c(OH -)同时增大, K W 增大,但 c(H +)和 c(OH -)始终保持相等,仍显中
性。 纯水由 25℃升到 100℃, c(H +)和 c(OH - )从 1×10-7mol/L 增大到 1×10-6mol/L(pH 变为 6)。 ② 加入活泼金属
向纯水中加入活泼金属,如金属钠,由于活泼金属可与水电离产生的 H +直接发生置换反应,产生
水的电离平衡向右移动。 ③ 加入易水解的盐
由于盐的离子结合 H +或 OH -而促进水的电离,使水的电离程度增大。温度不变时, K W 不变。
④ 电解
如用惰性电极电解 NaCl 溶液、 CuSO 4 溶液等。 2)抑制水电离的因素:
① 降低温度。
② 加入 酸、碱、强酸酸式盐。
向纯水中加酸和强酸酸式盐( NaHSO4)能电离出 H+ 、碱能电离出 OH-,平衡向左移动,水的电离程度变小, 但 K W 不变。 练习:影响水的电离平衡的因素可归纳如下:
1. 水的离子积
( 1)概念:因为水的电离极其微弱,在室温下电离前后
n(H2O) 几乎不变,因此 c ( H2O )可视为常数,则 在一定温
度时, c(H +)与 c(OH -)=K 电离 c(H2O) 的乘积是一个常数,称为水的离子积常数,简称水的离子积。
K W =c(H +)·c(OH -),25℃时, K W =1×10-14(无单位 )。
① K W 只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大, K W 增大。 与 c(H+) 、 c(OH-) 无关.
25℃时 K W =1×10-14,100℃时 K W 约为 1×10-12。 ② 水的离子积不仅适用于纯水,也适用于其他稀溶液。不论是纯水还是稀酸、碱、盐溶液,只要温度不变, K W 就不变。
③
在任何水溶液中,均存在水的电离平衡,也就是任何
c(H )?c(OH -) c(H 2O)
温度越高 K 电离越大。
H 2,使
水溶液中都是H+、OH-共存的。由水电离产生的c(H+) 、
c(OH-) 总是相等的。任何水溶液中都存在Kw=c(H+) . c(OH-)
4.水电离的离子浓度计算酸:C(OH—)溶液= C(OH —)水碱:C(H +)溶液= C(H+)水盐:酸性C(H +)溶液= C(H +)水碱性C(OH —) 溶液= C(OH —)水知识点二溶液的酸碱性与pH 1、溶液酸碱性的判断
溶液呈酸性、碱性还是中性,应看c(H ) 和c(OH )的相对大小,判断溶液酸碱性的依据主要有三点:判据1 在25℃时的溶液中:c(H +)>1×10-7 mol/L 溶液呈酸性c(H+)=1×10-7 mol/L 溶液呈中性
c(H+)<1×10-7 mol/L 溶液呈碱性
常温下,c(H+)>10-7 mol/L 时,溶液呈酸性,且c(H+)越大,酸性越强;c(OH -)越大,碱性越强。判据2 在25℃时的溶液中:pH<7 溶液呈酸性
pH=7 溶液呈中性
pH>7 溶液呈碱性
判据3 在任意温度下的溶液中:c(H+)>c(OH -) 溶液呈酸性c(H+)=c(OH -) 溶液呈中性c(H+) 注意用pH判断溶液酸碱性时,要注意条件,即温度。不能简单地认为pH等于7的溶液一定为中性,如100℃时,pH=6为中性,pH<6才显酸性,pH>6显碱性,所以使用pH时需注明温度,若未注明温度,一般认 为是常温,就以pH =7 为中性。 2、溶液的pH 对于稀溶液来说,化学上常采用pH 来表示酸碱性的强弱。 ⑴概念:表示方法 pH=-lgc(H +) c(H +)=10 -pH ⑵溶液的酸碱性与pH 的关系(常温时) ①中性溶液:c(H+)=c(OH -)=1 ×10-7mol ·L -1,pH=7 。 ②酸性溶液:c(H+)>1×10-7mol·L-1>c(OH-), pH<7 ,酸性越强,pH 越小。 ③碱性溶液:c(H+)<1×10-7mol·L-1>c(OH-), pH>7 ,碱性越强,pH 越大。 ⑶ pH 的适用范围 c(H +)的大小范围为:1.0 ×10-14mol ·L -1 当c(H+) ≥1mol ·-1L或c(OH -) ≥1mol ·-1时L,用物质的量浓度直接表示更方便。 ( 4)物理意义:pH越大,溶液的碱性越强;反之,溶液的酸性越强。pH 每增大一个单位c( H+ )减小至原来的1/10,c(OH-) 变为原来的10倍。 3、溶液pH 的测定方法 ② pH 试纸法:粗略测定溶液的pH。 pH 试纸的使用方法: 取一小块 pH 试纸放在玻璃片 (或表面皿 ) 上,用洁净的玻璃棒蘸取待测液滴在试纸的中部, 随即 (30s 内)与标准比色卡比色对照,确定溶液的 pH 。 测定溶液 pH 时, pH 试剂不能用蒸馏水润湿 (否则相当于将溶液稀释,使非中性溶液的 pH 测定产生误差 );不能 将 pH 试纸伸入待测试液中 ,以免污染试剂。 pH 一般为整数。 标准比色卡的颜色 按 pH 从小到大依次是:红 (酸性 ),蓝 (碱性 )。 ③ pH 计法:通过仪器 pH 计(也叫酸度计) 精确测定溶液 pH 。 知识点三 有关溶液 pH 的计算 有关 pH 的计算 基本原则: 一看常温,二看强弱(无强无弱,无法判断),三看浓度( pH or c ) 酸性先算 c (H +),碱性先算 c (OH —) 1.单一溶液的 pH 计算 ① 由强酸强碱浓度求 pH 。在 25℃ 强酸溶液 (H n A ) ,其物质的量浓度为 c mol/L ,则: c (H )=nc mol/L ,pH =- lgc (H )=- lgnc ; 1.0× 10 -14 强碱溶液 [B (OH ) n ] ,其物质的量浓度为 c mol/L ,则 c (OH )=nc mol/L ,c (H )= nc mol/L , pH =- lgc(H )= 14+ lg nc 。 ② 已知 pH 求强酸强碱浓度 2.加水稀释计算 ⑤ 酸、碱溶液无限稀释时, pH 只能约等于或接近于 7,酸的 pH 不能大于 7,碱的 pH 不能小于 7。 ⑥对于浓度(或 pH )相同的强酸和弱酸,稀释相同倍数,强酸的 pH 变化幅度 大。 先求 c (H +)余= c (H +) ·V (酸)-c (OH -) ·V (碱),再求 pH 。 ③碱过量: V (酸)+V (碱) ( 4)酸碱中和反应后溶液 pH 的判断: ①当酸与碱 pH 之和为 14,等体积混合后(常温下) 若为强酸与强碱,混合后 若为强酸与弱碱,混合后 若为弱酸与强碱,混合后 规律:谁弱谁过量,谁弱显谁 ① 强酸 pH=a ,加水稀释 ② 弱酸 pH=a ,加水稀释 ③ 强碱 pH=b ,加水稀释 10n 倍,则 pH=a+n 。 10n 倍,则 pH 10n 倍,则 pH=b-n 。 ④ 弱碱 pH=b ,加水稀释 10n 倍,则 pH>b-n 。 3.酸碱混合计算 (1)两种强酸混合 c (H +)混= V 1 V 2 注意:当二者 pH 差值≥ 2, [c (H+)] 相差 100 倍以上时,等体积混合时可用近似规律计算, (2)两种强碱混合 c (OH - )混= c(H )1V 1 c(H )2 V 2 pH 混 ≈pH 小 +0.3. c(OH )1V 1 c(OH )2 V 2 注意:当二者 pH 差值≥ 2, (3)强酸、强碱混合, ①强酸和强碱恰好完全反应, ②酸过量: V 1 V 2 [c (OH-)] 相差 100 倍以上时,等体积混合时可用近似规律计算, pH 混≈pH 大 -0.3. 溶液呈中性, pH=7. V (酸)+V (碱) 先求 c (OH -)余 = c (OH -)· V (碱)-c (H +)· V (酸) ,再求 c (H +)= K W - ,然后求 pH 。 c (OH ) pH=7 pH>7 pH<7