电导法测定弱电解质的电离常数实验数据处理
- 格式:docx
- 大小:182.62 KB
- 文档页数:4


五、实验数据记录与处理
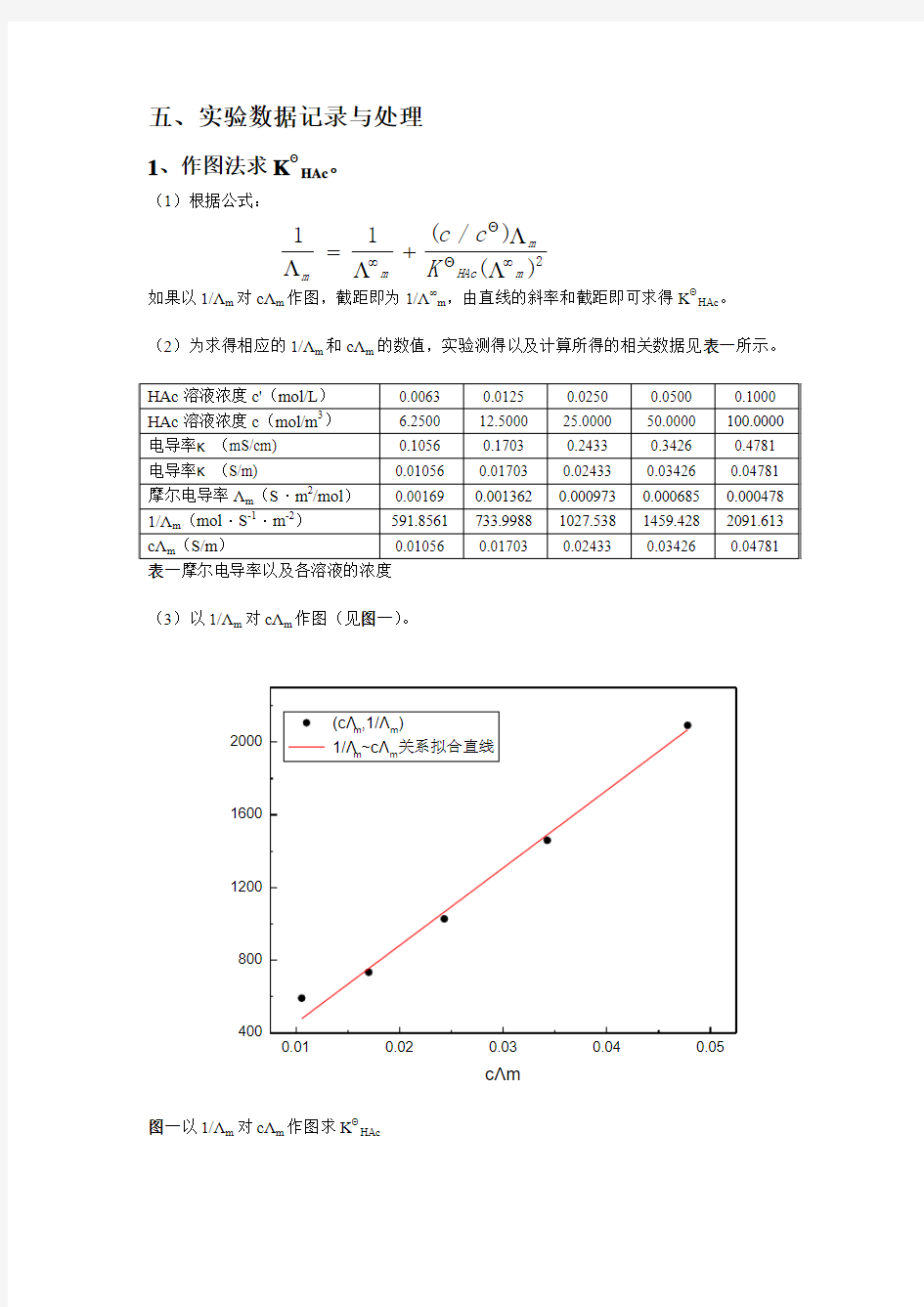
1、作图法求K ΘHAc 。
(1)根据公式:
2
)()/(1
1m HAc m m m K c c ∞Θ
Θ∞ΛΛ+Λ=Λ
如果以1/Λm 对cΛm 作图,截距即为1/Λ∞m ,由直线的斜率和截距即可求得K Θ
HAc 。
(2)为求得相应的1/Λm 和cΛm 的数值,实验测得以及计算所得的相关数据见表一所示。
表一摩尔电导率以及各溶液的浓度
(3)以1/Λm 对cΛm 作图(见图一)。
1/Λm
cΛm
图一以1/Λm 对cΛm 作图求K Θ
HAc
图二以1/Λm 对cΛm 作图拟合结果
根据拟合结果:
直线的斜率为:42664.10717;直线的截距为:28.1034 根据公式: K Θ
HAc =(截距)2*10-3/斜率 =1.85*10-5
通过查阅《普通化学原理》附表,知:25℃时,醋酸的K Θ
HAc =1.75*10-5 相对误差:5.71%
2、求醋酸的电离度α。
根据弱电解质的电离度与摩尔电导率的关系:
m
m ∞
Λ
Λ=
α
求出五组不同浓度的醋酸溶液的电离度,见表二。 其中25℃下的Λ∞m 由表三得到。
表二醋酸溶液的电离度
3、计算法求K ΘHAc
根据公式:
)
()/(2
m m m m
HAc c c K Λ-ΛΛΛ=
∞∞ΘΘ
通过计算的方法求得K Θ
HAc ,与作图法以及标准值比较,相关数据见表四。
表四计算的方法求得K HAc
根据计算的结果,只有c/16的K Θ
HAc 与其他数据相差较大,这与通过作图拟合时的数据一致,通过图一中对无根数据的拟合,可以看出也是c/16的数据点偏离拟合直线比较多,应该是实验误差所致。
4、对第一次实验数据的处理以及处理结果。
注:本次实验我们小组测量了两次,原因是第一次实验测量的数据通过拟合直线虽然斜率是可靠的,但是其截距是负值,这与直线方程的截距物理意义不符合,通过询问前面几组的数据,我们发现用右侧仪器的小组数据都出现了这样一个问题,因此我们决定用另外一个仪器第二次测量。
(1)实验数据:
表五第一次测量的实验数据及相关计算数值
(2)作图法求K Θ
HAc
1
/
Λ
m
cΛm
图三第一次实验数据以1/Λm对cΛm作图求KΘHAc
图四第一次实验数据以1/Λm对cΛm作图拟合结果
根据拟合结果:
直线的斜率为:36293.42452;直线的截距为:-266.69365
根据公式:
因为截距为负值无法加入计算,因此用表三中25℃时的摩尔电导率代入计算:求得KΘHAc=(1/0.03908)2/斜率=1.80*10-5
通过查阅《普通化学原理》附表,知:25℃时,醋酸的KΘHAc=1.75*10-5
相对误差:2.86%