物质在水溶液中的行为(第一讲)
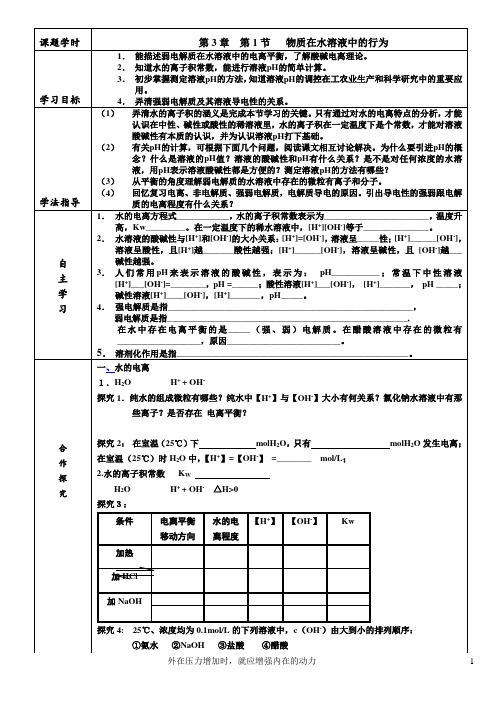
- 格式:ppt
- 大小:973.00 KB
- 文档页数:18


第3章物质在水溶液中的行为第1节水溶液【学习目标】1、了解水的电离过程及水的离子积常数的含义,并能应用水的离子积常数进行相关计算。
2、认识溶液的的酸、碱性与H+ OH-浓度,以及与pH的关系。
3、知道pH 的含义并进行有关pH 的简单计算。
(第一课时)【学习过程】一、水的电离1、水的电离思考1:水是不是电解质?它能电离吗?(1)实验发现水仍具有导电性,这说明纯水中存在的离子,它们是和,是由水分子电离产生的。
水的电离方程式为:(2)水的电离是个(填可逆或不可逆)过程,在一定条件下可以达到电离平衡,其电离平衡常数的表达式为。
思考2:计算水中H+和OH- 的浓度:实验测得,在室温下1L纯水中(即55.56mol)中只有1×10-7 mol H2O电离,则室温下C(H+)和C(OH-)分别为多少? C(H2O)?2、水的离子积常数在一定温度下,K与[H2O]都是常数,其乘积也必然是常数,因此[H+]●[OH-]也是,Kw= ,式中Kw称为,简称水的。
Kw反映了水中和的关系。
且室温下Kw= mol2•L-2观察思考①不同温度下水的离子积常数分析上表数据可得出结论:水的电离是热过程。
水的离子积常数只受温度的影响,与_______________的变化无关。
随着温度的升高,水的离子积常数(填增大、不变、减小),说明:(1)、水的电离是个吸热过程,故温度升高,水的Kw。
所以说Kw时要强调温度25℃时Kw=1.0× 10-14mol-2•L-2; 100℃时Kw=1.0× 10-12mol-2•L-2.(2)、对于中性水,尽管Kw增大,但仍是中性水,[H+]=[OH-].(3)、水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐稀溶液。
即溶液中[H+][OH-] = 1.0× 10-14mol-2•L-2。
(4)、任何水溶液中,由水所电离而生成的C(H+) C(OH-)。

鲁科版化学选修4《物质在水溶液中的行为》第1节《水溶液》第一课时教学设计鲁科版化学选修4《物质在水溶液中的行为》第1节《水溶液》第一课时教学设计一、教学目标确立依据(一)课标分析1. 课程标准要求:知道水的离子积常数,了解酸碱电离理论。
能进行溶液pH的简单计算,初步掌握测定溶液pH的方法,知道溶液pH的调控在工农业生产和科学研究中的主要应用。
2. 课程标准解读:第一句的行为动词为“知道”“了解”,意为“学生能够描述出、说出、辨认出、区分出、比较出”就是对学生知识技能水平的基本要求。
这部分内容以化学反应中可逆反应、化学平衡为基础,根据课标的要求,学生的原有认识能在这里发挥巨大的作用,同时水的电离教学把理论研究和实验探究都放到了十分重要的位置。
从单元整体教学的角度来说,水的电离的原理是学习物质在水溶液中的行为及应用的基础和前提。
对测定溶液pH的方法的要求层级相对提高,对于pH的计算,本节课课程标准的要求是“能够进行简单计算”,那么在这个要求下,结合高考考点要求,将pH计算分为4类进行计算。
另外,通过课下研究性学习等活动,要让学生体验pH的调控在工农业生产和科学研究中的重要应用,并能举例说明。
(二)教材分析第1课时主要解决3个问题:水的电离、水的离子积常数、溶液的酸碱性的判断。
只有认识水的电离平衡及其移动,才能从本质上认识溶液的酸碱性和pH。
本节的学习也为盐类的水解及弱电解质的电离等知识的教学奠定基础。
教材从实验事实入手,说明水是一种极弱的电解质,存在着电离平衡,由此引出水的电离平衡常数,进而引出水的离子积,并使学生了解水的离子积是个很重要的常数。
通过进一步的探讨,学生了解在室温时不仅是纯水,就是在酸性或碱性稀溶液中,其[H+]与[OH -]的乘积总是一个常数。
在酸性溶液中,不是没有OH - ,而是其中的[H+]> [OH -];在碱性溶液中,不是没有H+,而是其中[H+]< [OH -];在中性溶液中,并不是没有H+和OH -,而是[H+]= [OH -],最终引领学生理清溶液中H+浓度与OH -浓度的关系,明白溶液酸碱性的本质。

物质在水溶液中的行为第1节水溶液昌邑一中唐玉洁教学目标:⑴掌握水的离子积K W和PH的概念及电解质在水中的存在形态。
⑵掌握酸碱性溶液的特征与PH的关系。
教学重点:水的离子积K W、[H+]、[OH-]PH与溶液的酸碱性的关系。
教学难点:水的离子积K W,有关PH的简单计算。
教学过程:一、水的电离探究1.⑴常温(25℃)时,水电离出的[H+]=[OH-]=10-7mol/L,水的离子积K W=[H+] [OH-]= 1.0×10-14。
⑵任何水溶液中均存在着水的电离平衡,即任何水溶液中均存在着H+和OH-。
水的离子积是水电离平衡时具有的性质,不仅适用于纯水,也适用于其它稀的水溶液。
如酸、碱、盐溶液中都有K W=[H+] [OH-]=1.0×10-14。
(常温)。
其中 [H+]、[OH-]表示整个溶液中的[H+]和[OH-]⑶K W是温度函数,温度升高,K W增大;温度降低,K W减小。
从电离平衡的角度来看,水的电离是吸热的,故升温,水的电离平衡向电离的方向移动,[H+]和[[OH-]都增大,K W也增大;反之,则减小。
如100℃时,K W= 1.0×10-12。
⑷一定温度下,在不同的溶液中都有K W =[H+] [OH-],故[H+]和[OH-]成反比,但在任何溶液中,由水电离的[H+]和[OH-]的浓度一定相等。
[误区警示]⑴溶液的酸碱性与酸和碱的酸碱性含义不同:溶液的酸碱性是指溶液中的[H+]与[OH-]的相对大小;而酸和碱的酸碱性是指酸或碱电离出的H+或OH-的能力。
⑵强酸溶液的酸性不一定比弱酸溶液的酸性强;酸性强的溶液不一定是强酸溶液。
2.探究溶液的酸碱性的表示方法—PH 值⑴PH值的定义用[H+]的负对数来表示溶液的酸碱性的强弱。
用PH试纸粗略地测定其使用方法是:取一小块试纸放在玻璃片或点滴板上,用洁净的玻璃棒蘸取溶液点在试纸的中央,等颜色变化后与标准比色卡对比来判断溶液的PH值的大小。

《物质在水中的行为》(1)水溶液一、水的电离:1.水是一中很弱的电解质,它能微弱的电离成H3O+和OH—,电离方程式为:,可以简写为:。
水的电离过程是过程。
2.水的离子积常数:在25℃时的纯水中,c(H+)= c(OH―)= ,此时水的离子积K W= 。
在100℃时的纯水中,c(H+)= c(OH―)= ,此时水的离子积K W= 。
注意:(1)任何物质的水溶液中,在常温时,K W= ,K W与溶液的酸碱性无关,只与有关。
当温度升高,水的离子积:;当温度降低,水的离子积:。
(2)在酸溶液中,[H+]近似看成是酸电离出来的H+浓度,[OH-]则来自于水的电离。
(3)在碱溶液中,[OH-]近似看成是碱电离出来的OH-浓度,而[H+]则是来自于水的电离。
(4)任何水溶液中,由水所电离而生成的c(H+)水电离c(OH―)水电离。
3.影响水电离平衡的因素:(1)温度的影响:水的电离是过程(填吸热或放热),升高温度,水的电离程度,K w。
(2)酸或碱的影响:向水中加入酸或碱,(填促进或抑制)水的电离,水的电离程度,K w,此时,c(H+)水电离=c(OH―)水电离10-7mol·L-1(填“大于”、“小于”或“等于”以下同)。
(3)可溶性盐的影响:在水中加入某些可溶性盐(例FeCl3、Na2CO3等),水的电离程度,K w。
此时,c(H+)水电离=c(OH―)水电离10-7mol·L-1(填“大于”、“小于”或“等于”以下同)。
(4)加入活泼金属:活泼金属与水是离出来的H+反应,促进水的电离,水的电离程度,K w。
此时,c(H+)水电离=c(OH―)水电离10-7mol·L-1(填“大于”、“小于”或“等于”以下同)。
【巩固练习1】1.向纯水中加入硫酸(温度不变),则溶液中(1)c(H+)·c(OH-) ,(2)c(H+) ,(3)c(OH-) (填“增大”、“减小”或“不变”)2.某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH―)为;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH―)为,由水电离出来的c(H+)为。
第三单元 物质在水溶液中的行为 第1节 水溶液 第1课时【教学目标】学问与技能1.理解水的电离、水的电离平衡和水的离子积2、了解电解质在溶液中的电离,会书写电离方程式过程与方法1.通过对水的离子积相关数据的分析,加深对离子积常数的生疏2.通过对水的电离平衡的分析,提高同学分析问题、解决问题的力量情感态度价值观通过对水的电离过程中H +、OH -关系的分析,理解冲突对立统一的辩证关系 【教学过程】 一、水的电离 1.水的电离水是一种极弱的电解质,能发生微弱电离,其电离方程式为H 2O+H 2OH 3O ++OH —,也可以简写为H 2OH ++OH —。
2.水的离子积常数水的电离过程也是一个可逆过程,因此也存在电离常数:K 电离=2cH cOH cH O+-•,则cH cOH +-•= K 电离⨯cH 2O 。
从试验可知,在25℃时1L 纯水中只有71.010-⨯ H 2O 电离,而c (H 2O )=55.6mol/L 可视为一常数,K 电离也为一常数,所以K 电离⨯cH 2O 必定也为常数,用Kw 表示,因此有cH cOH +-•=K W 。
K W 为水的离子积常数,简称为水的离子积。
在25℃时,水电离的c (H +)= c (OH —)=71.010-⨯mol/L ,所以K W =cH cOH +-•=141.010-⨯。
3.水的离子积常数与温度的关系K W 随着温度的上升而增大,但是在室温下,可忽视温度的影响,K W 为141.010-⨯,即K W =cH cOH +-•=141.010-⨯。
『特殊提示』(1)在任何水溶液中均存在水的电离平衡,H +和OH —共存,只是相对含量不同而已;(2)K W 只与温度有关。
(3)K W 不仅适用于纯水,还适用于酸碱的稀溶液,且由水电离的22+-H O H O c(H ) c(OH )=,此时水溶液中水的离子积常数不变。
在实际运算时,通常忽视算碱溶液中水电离产生的H +,碱溶液中忽视水电离产生的OH —。