原花色素的含量测定研究
- 格式:pdf
- 大小:160.16 KB
- 文档页数:3

马占相思树皮中原花色素提取工艺及其生物活性的研究许蕊;姜萍;张颖茵;陆婷婷;李根;张萌卫【摘要】The optimum extraction conditions of three extraction methodsof proanthocyanidins from Acacia mangium Bark were investigated by using orthogonal experiment. The extracted results were compared. Then, the vitro antioxidant and anti-tumor activities of different solvent extracts from ultrasonic extracts were studied. The optimum crafts for traditional solvent extraction method were 60% ethanol,70℃,70 min and ratio of material-liquid 1∶18 (g∶mL,the same belo w),and the obtained yield of proanthocyanidin was 7.42%.The optimum crafts for microwave-assisted extraction were 60% ethanol,8 min for microware time, ratio of material-liquid 1∶18, microwave power 200 W, with the yield of proanthocyanidin 7. 05%. And the optimum crafts for ultrasonic-assisted extraction method were 70 % ethanol, ultrasonic time 50 min, ratio of material-liquid 1∶16, extraction temperature 50℃,and the yield of proanthocyanidin was8.57%.Result of ultrasonic-assisted extraction was the best,due to the low extract temperature and high yield.The results of antioxidant test showed that the ethyl acetate extracts from ultrasonic-assisted extracts exhibited the highest antioxidant activity,as well as the inhibitory concentration 50%( IC50 ) of DPPH.radical scavenging was 17. 94 mg/L, and it was lower than that of vitamin C ( Vc ) . Experimental results of antitumor activity of different solvent extracts showed that the ethyl acetate extract possessed highest antitumor activity for human hepatoma cell Bel-7404 with the IC50of 4.86 mg/L,which was similar to antitumor medicine etoposide.%通过正交试验优化了马占相思树皮中原花色素的3种提取方法的最佳提取工艺条件。

原花色素的提取纯化和测定思考题引言原花色素是一种天然的有机化合物,广泛存在于植物中的各种花朵中。
由于其具有丰富的颜色和生物学活性,因此在食品、医药和化妆品等领域有重要的应用价值。
本文将探讨原花色素的提取纯化和测定方法,以期为相关领域的研究提供参考。
提取原花色素的方法1.传统提取方法–固液萃取:将花朵样品与适量的溶剂(如乙醇、乙酸乙酯等)混合,静置一段时间,然后使用过滤或离心等方法分离出液相,即为提取得到的原花色素。
–水蒸气蒸馏:将花朵样品置于蒸馏设备中,用水蒸气蒸馏的方式提取原花色素,得到蒸馏液后,经过适当的提取和分离处理,即可得到纯化的原花色素。
2.现代提取方法–超声波辅助提取:将花朵样品与溶剂混合后,利用超声波的作用,加速花色素的释放和溶解,提高提取效率。
–超临界流体萃取:利用超临界流体(如二氧化碳)的特殊性质,对花朵样品进行提取,此方法不仅能高效提取原花色素,还可避免有机溶剂残留的问题。
原花色素的纯化方法1.溶剂萃取–采用不同极性的溶剂进行多次萃取,可以去除掉一部分杂质,提高原花色素的纯度。
–萃取后的溶液通过旋转蒸发、冷冻干燥等方法去除溶剂,得到浓缩的原花色素溶液。
2.色谱技术–薄层色谱:将原花色素溶液均匀涂在薄层色谱板上,然后将色谱板放入移动相中,通过移动相的上升,原花色素在色谱板上形成斑点,根据斑点的迁移距离和色谱板杂质的位置,可进行分离和纯化。
–高效液相色谱:利用色谱柱和液相色谱设备,通过不同溶液的分配比例,控制原花色素的迁移和分离,从而获得高纯度的原花色素。
原花色素的测定方法1.分光光度法–利用原花色素在特定波长下的吸光度特性,通过分光光度计测量花色素溶液的吸光度,进而确定其浓度和纯度。
–需要制备一系列不同浓度的标准溶液,以建立标准曲线,并通过曲线拟合计算未知样品的浓度。
2.高效液相色谱法–利用高效液相色谱仪对原花色素进行定量测定。
–需要事先确定好色谱柱和流动相的适宜条件,并校准设备,以保证测定结果的准确性和可靠性。

花青素含量的测定实验报告目的:花青素是类黄酮类色素中最重要的一种,广泛存在于植物花、果实、茎叶中,对这些器官的观赏价值和商品形状有重要价值。
本实验学习花青素的提取及测定方法。
一、实验原理花青素在酸性溶液中呈红色,其颜色的深浅与花青素的浓度成正比。
花青素酸性溶液的吸收高峰波长是530nm,摩尔消光系数为4.62×10,故可用分光光度法测定其含量。
但是一些提取液中常有叶绿素存在,干扰测定。
因此,需同时测定提取液在620nm(可溶性糖)和650nm(叶绿素的吸收值)波长下的光密度值,并用Greey公式准确计算出花青素的光密度值,才能计算花青素的含量。
二、材料、设备及试剂1.材料:茶叶2.设备分光光度计、电子天平、水果刀、50ml具塞三角瓶、25ml容量瓶。
3.试剂0.1mol·L1的盐酸乙醇溶液(8.3ml浓盐酸用95%乙醇稀释成11)。
三、操作方法1.花青素的提取取0.100g一串红和0.116g红花继木分别放在编号为1、2的三角瓶中,加10ml盐酸乙醇溶液,在60℃水浴中加10ml提取液浸提30min,把溶液倒入25ml容量瓶中,再加5ml提取液浸提15min,把溶液倒入25ml 容量瓶中,再加5ml提取液浸提15min,把溶液倒入25ml容量瓶中,共浸提1h,最后定溶到25ml。
2.测定以0.1mol·L1的盐酸乙醇溶液做参比液,在分光光度计测定提取液在530nm、620nm、650nm波长下的光密度值。
四、实验结果依据公式1.计算花青素的光密度值ODA=(OD530-OD620)-0.1(0D650-OD620)2.计算花青素含量0D元花青素含量(mmol/g)=V×1000000cm ODx:花青素在530nm波长下的光密度E:花青素摩尔消光系数4.62×106v:提取液总体积(ml)m:取样质量(g)1000000:计算结果换算成nmol的倍数由一串红测得结果则有:ODA=(1.360-0.024)-0.1(0.043-0.024)=1.3341 所以,花青素含量(nmol/g)=1.3341/4.62/101×25/0.100×106-7219.156 由红花继木测得结果则有:ODx=(0.370-0.062)-0.1(0.183-0.062)=0.2959 所以,花青素含量(nmol/g)=0.2959/4.62/101×25/0.116×105=1380.337 五、结果分析与讨论从实验实验可以看出,一串红的花青素含量比红花继木的花青素含量高很多。


原花青素在不同酸度条件下的稳定性研究原花青素是一种天然的花色素,广泛存在于植物中,具有丰富的生物活性和营养保健作用。
然而,在不同的酸度条件下,原花青素的稳定性可能会发生变化,影响其在食品加工和储存中的应用。
因此,对原花青素在不同酸度条件下的稳定性进行研究非常重要。
以下是可能采取的一些研究方法和技术:1.pH值调节:可以通过改变溶液的pH值来模拟不同的酸度条件,一般采用稀酸溶液来模拟食品酸度环境。
2.分析方法:可以采用紫外-可见光谱、高效液相色谱、质谱等方法来测定样品中原花青素的含量和稳定性。
3.试样制备:将原花青素与不同的食品基质混合,制备成试样,并存放在不同酸度条件下。
4.稳定性评价:通过测定不同酸度条件下试样中原花青素的含量变化、颜色变化、光谱特征变化等来评价其稳定性。
5.影响因素研究:研究不同因素对原花青素稳定性的影响,如光照、温度、氧气、金属离子等。
综上所述,研究原花青素在不同酸度条件下的稳定性需要采用多种方法和技术,以评价其在食品加工和储存中的应用前景,并为其进一步开发和利用提供科学依据。
再写一个针对原花青素在不同酸度条件下的稳定性研究,以下是另一些可能的研究方法和技术:1.不同酸度条件下原花青素的降解动力学:可以通过测定原花青素在不同酸度条件下的降解速率常数,来比较不同酸度条件下的降解动力学,以确定最适宜的pH值范围。
2.抗氧化性评价:由于氧气可以促进原花青素的降解,因此可以采用不同的抗氧化评价方法来评估原花青素在不同酸度条件下的稳定性,如DPPH自由基清除能力、还原能力等。
3.复合物的形成:在食品加工和储存过程中,原花青素可能会与其他成分形成复合物,这可能会影响其稳定性。
因此,可以研究原花青素与其他成分的相互作用和复合物的形成,以评估其对稳定性的影响。
4.模拟胃肠道消化:可以通过模拟胃肠道消化过程来研究原花青素在不同酸度条件下的稳定性。
这可以帮助我们更好地了解原花青素在人体内的吸收和代谢过程。

原花青素的研究进展原花青素是一种天然生物活性物质,在植物中广泛分布。
近年来,原花青素因其独特的化学组成和多种生物活性而备受。
本文将综述原花青素的研究现状、研究方法及未来研究方向。
一、原花青素概述原花青素(Proanthocyanidins,简称PAs)是天然酚类化合物中的一种,由不同数量的儿茶素或表儿茶素通过C-C键连接而成。
原花青素在植物中主要分布于种子、果实、花瓣和叶片等部位,具有抗氧化、抗炎、抗肿瘤、降血脂等多种生物活性。
二、原花青素的研究现状随着人们对原花青素的度不断提高,其研究已经涉及多个领域。
目前,研究者们主要原花青素的抗氧化、抗炎、抗肿瘤等生物活性。
研究表明,原花青素能够清除自由基、抑制脂质过氧化,具有明显的抗氧化作用。
此外,原花青素还具有明显的抗炎作用,能够抑制炎症因子的表达,减轻炎症反应。
抗肿瘤方面,原花青素能够抑制癌细胞增殖、诱导癌细胞凋亡,对多种癌症具有治疗和预防作用。
三、原花青素的研究方法原花青素的提取方法有多种,包括溶剂提取法、微波辅助提取法、超声波辅助提取法等。
其中,溶剂提取法是最常用的方法,以乙醇、甲醇等有机溶剂为主。
原花青素的分离方法包括高速逆流色谱、高效液相色谱等。
对于原花青素的结构测定,常用的方法有核磁共振、质谱等。
另外,为了明确原花青素的生物活性,研究者们还采用了细胞生物学、分子生物学等技术手段。
四、结论与展望原花青素作为一种天然活性物质,具有抗氧化、抗炎、抗肿瘤等多重生物活性,在预防和治疗多种疾病方面具有潜在的应用价值。
然而,目前关于原花青素的研究仍然存在一些不足之处,如提取纯度不高、体内代谢机制不明等问题。
未来研究方向之一是优化原花青素的提取纯度和方法,以提高其在实践中的应用效果。
另外,深入研究原花青素的体内代谢机制和生物活性也是非常重要的方向,有助于揭示其作用机理和实际应用效果。
同时,开展原花青素的构效关系研究,明确其作用的关键结构和活性基团,对于发现新的原花青素类药物和功能食品具有重要意义。

原花色素的提取和测定思考题引言原花色素是一类存在于植物中的天然色素,具有多种生物活性和营养价值,被广泛用于食品、医药、化妆品等领域。
本文将深入探讨原花色素的提取和测定方法以及其应用。
原花色素的提取方法原花色素的提取方法通常分为物理方法和化学方法两大类。
物理方法1.水浸提取法–将鲜花、花瓣等植物组织浸入水中,利用植物组织中的原花色素溶解于水中的特性进行提取。
–该方法简单易行,但提取效率较低。
2.酸碱浸提法–将植物组织浸泡在酸性或碱性溶液中,使原花色素与酸碱反应生成可溶于溶液中的化合物,再通过过滤或分离提取原花色素。
–该方法可以提高提取效率,但需要注意溶液浓度和温度的控制。
化学方法1.有机溶剂提取法–利用某些有机溶剂如乙醚、苯等,可以与原花色素有较好的亲和力,将原花色素从植物组织中提取出来。
–该方法提取效率较高,但需要注意有机溶剂的选择和使用条件。
2.超声波提取法–利用超声波的机械振动作用,可以促使原花色素从植物组织中释放出来。
–该方法提取效果较好,但需要注意超声波的频率、功率和时间的选择。
原花色素的测定方法原花色素的测定方法通常分为光度法、色谱法和质谱法三大类。
光度法1.分光光度法–利用原花色素对特定波长的光的吸收特性,通过测定吸光度来确定原花色素的含量。
–该方法操作简单,结果准确度较高。
2.滴定法–利用一定试剂与原花色素发生化学反应,根据反应的滴定终点来确定原花色素的含量。
–该方法对试剂选择和滴定条件有较高的要求。
色谱法1.薄层色谱法–利用原花色素在薄层色谱板上的分离迁移特性,通过对色谱板上的斑点进行扫描和测定来确定原花色素的含量。
–该方法分离效果较好,但需要注意色谱板的样品施加和显色条件的控制。
2.高效液相色谱法–利用液相色谱柱对原花色素进行分离,并通过检测器测定其峰面积或峰高来确定原花色素的含量。
–该方法分离效果更好,且能够对不同种类的原花色素进行定量分析。
质谱法1.毛细管电泳质谱法–利用毛细管电泳将原花色素分离出来,再通过质谱仪器进行检测和定量分析。

植物原花青素(OPC)含量检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC1355规格:100T/48S产品内容:提取液:60%乙醇,自备,4℃保存。
试剂一:11%盐酸8mL,自备,4℃保存。
即2.4mL盐酸溶于5.6mL蒸馏水试剂二:粉剂×1瓶,4℃避光保存,临用前加8mL提取液溶解。
工作液:临用前按照用量将试剂一和试剂二按照1:1混合。
标准品:粉剂×1支,10mg原花青素。
产品说明:原花色素(Oligomeric Proantho Cyanidins,OPC)是一类黄烷醇单体及其聚合体的多酚化合物,广泛存在于植物的各种器官中,具有极强的抗氧化性和清除自由基的作用,广泛的应用于医药,食品,化妆品,保健品行业。
在酸性条件下,植物原花青素A环上的间苯二酚和间苯三酚与香草醛发生缩合反应,产生有色化合物,在500nm处有特征吸收峰,测定500nm光吸收值,可计算植物中原花青素的含量。
自备实验用品及仪器:天平、常温离心机、可见分光光度计/酶标仪、微量石英比色皿/96孔板、蒸馏水、11%盐酸和60%乙醇。
操作步骤:一、OPC提取:将样本烘干至恒重,粉碎,过40目筛之后,称取约0.1g,加入1mL提取液,用超声提取法进行提取,超声功率300W,破碎5s,间歇8s,提取,30min,12000rpm,25℃,离心10min,取上清,用提取液定容至1mL,待测。
二、测定操作表:1、分光光度计或酶标仪预热30min以上,调节波长至500nm,蒸馏水调零。
2、用提取液将原花青素配制成10mg/mL标准液,用提取液梯度稀释为5、2.5、1.25、0.625、0.3125、0.156、0.078、0.039、0.02、0.01mg/mL的标准溶液。
3、操作表对照管测定管标准管空白管样本(μL)4040标准溶液(mg/mL)40工作液(μL)160160160HO(μL)160402混匀,30℃水浴30min,立即于微量石英比色皿/96孔板中检测500nm处吸光值,计算∆A测定=A测定管-A对照管,∆A标准=A标准管-A空白管。

方法1:原花色素的测定方法(分光光度法)本方法适用于各种植物组织、器官及其制剂(如葡萄子与松树皮提取物)中原花色素含量的测定。
1. 方法提要原花色素(也称缩合单宁)是黄烷-3-醇的寡聚体与多聚体,属多酚类化合物。
与其他酚类化合物不同,黄烷醇(缩合单宁,单体,双体等)在酸性介质中可与香草醛反应,生成在500nm处有最大吸收的有色物质,可通过比色测其含量。
2. 仪器分光光度计。
3. 试剂所用水为去离子水或同等纯度蒸馏水。
(1)香草醛、甲醇、浓盐酸均为分析纯级。
(2)提纯的原花色素或儿茶素。
(3)4%香草醛甲醇液。
(4)标准使用液:将提纯的原花色素溶于蒸馏水,制成1mg/mL储备液,将储备液稀至浓度为1×10-2mg/mL至1mg/mL的标准使用液。
标准使用液应于测定当天配制。
如无提纯的原花色素,可用儿茶素代替,配制方法同上。
4. 测定步骤(1)样品中原花色素的制备:植物材料经4倍体积丙酮+水(7+3,体积比)或者经60%甲醇提取,40℃以下减压蒸馏去除有机溶剂,水相再经乙醚洗涤后定容。
冰冻干燥的固体原花色素制剂,直接溶于水中(先加少量甲醇助溶)制成原花色素液。
原花色素液于5℃下暗环境中保存备用。
(2)样品测定:用锡箔将试管(14mm×20mm)包裹严,仅留管口用于加样。
向管内加入试样0.5mL,再加3.0mL 4%香草醛甲醇液混合,然后加入1.5mL浓盐酸,彻底混匀,室温下显色15min。
也可在暗环境下进行以上操作。
最后在500nm处比色。
可按以上操作步骤制得标准曲线(即0.1mg原花色素在500nm处的吸收值为0.55)。
5. 结果计算计算原花色素量的公式,原花色素(1×10-3mg)=A500nm÷0.55×100×V式中 V——试样稀释体积(倍数)。
6. 注释(1)本方法的检测范围为(5~500)×10-3mg/0.5mL样液。

原花青素的资源及研究进展张小军1夏春镗1*吴建铭1谢正荣2(1.同济大学生命科学与技术学院上海 200092;2.昆山市农业局 215300)摘要:原花青素是花青素类物质的缩合物,从不同资源制备的原花青素其组分与结构各不相同,功能也有差异。
本文从分类学角度分析了原花青素资源的分布,并对其中的一些重要资源进行评价和分析,为新的原花青素资源的探索提供了方向,并为原花青素的开发提供参考。
关键词:原花青素;分类学;资源;收率;分布Research and Progress of ProanthocyanidinXiaojun Zhang1Chuntang Xia1*Jianming Wu1Zhengrong Xie2(1.School of Life Science and Technology,Tongji University,Shanghai,200092,China;2.Department ofAgriculture,Kunshan City,215300,China)Abstract:Proanthocyanidin could be seen as the polymer of cyanidin.There are different polymerization degree and molecular structure of proanthocyanidins, and therefore different biological functions in different resources. Our research analysis the distribution of proanthocyanidin resources by the manner of taxonomy. Evaluation for some important resources of proanthocyanidin could be provided as reference for the research and development of proanthocyanidin.Key words:proanthocyanidin;taxonomy;resources;yield; distribution原花青素(proanthocyanidin,PC)可视作花青素(cyanidin)类物质的聚合物,因其在加热的状态下能产生红色的花青素而得名,是一类在植物界广泛存在的多酚化合物。
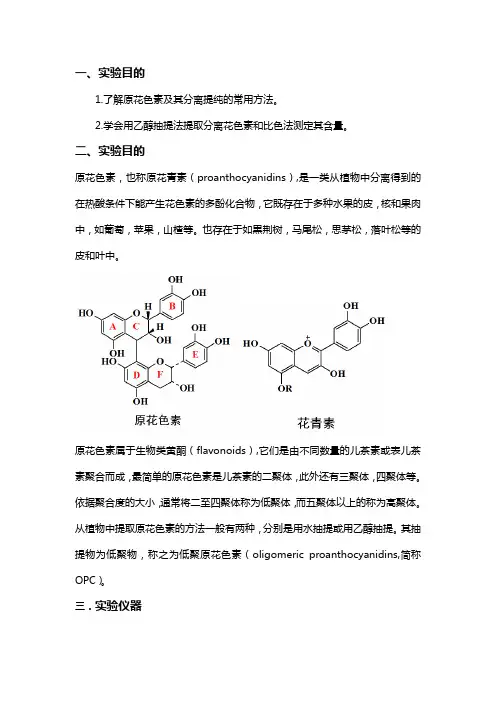
一、实验目的1.了解原花色素及其分离提纯的常用方法。
2.学会用乙醇抽提法提取分离花色素和比色法测定其含量。
二、实验目的原花色素,也称原花青素(proanthocyanidins),是一类从植物中分离得到的在热酸条件下能产生花色素的多酚化合物,它既存在于多种水果的皮,核和果肉中,如葡萄,苹果,山楂等。
也存在于如黒荆树,马尾松,思茅松,落叶松等的皮和叶中。
原花色素属于生物类黄酮(flavonoids),它们是由不同数量的儿茶素或表儿茶素聚合而成,最简单的原花色素是儿茶素的二聚体,此外还有三聚体,四聚体等。
依据聚合度的大小,通常将二至四聚体称为低聚体,而五聚体以上的称为高聚体。
从植物中提取原花色素的方法一般有两种,分别是用水抽提或用乙醇抽提。
其抽提物为低聚物,称之为低聚原花色素(oligomeric proanthocyanidins,简称OPC)。
三.实验仪器1.试剂:花色素标准样品;甲醇;0.1%HCL-95%乙醇(V:V=70:30);无水乙醇;石油醚;乙酸乙酯;HCL-正丁醇(浓HCL5.0ml加入正丁醇95.0ml,混合即可);2%硫酸铁氨(硫酸铁氨2.0g溶于2.0mol/L HCL 100.0ml即可)2.器材:冷冻干燥机;旋转蒸发仪;分光光度计;水浴锅;电炉;电子分析天平3.材料:新鲜勒杜鹃花四、实验操作(一)勒杜鹃原花色素的提取1.材料处理:称取新鲜勒杜鹃10.0g,剪碎,置于锥形瓶中,加入3倍体积的石油醚,室温浸泡,脱去脂质物质和叶绿素,过滤,将勒杜鹃样品晾干,备用。
a)花色素的提取:提取剂0.1%HCL-95%乙醇(V:V=70:30)料液比(m:V=1:150),提取时间30分钟,控制提取温度60℃,提取次数2次,即提取液分2次加入。
2.花色素的纯化:由于样品中还是会含有其他杂质,如:蛋白质,维生素(水溶性维生素易溶于水而不易溶于非极性有机溶剂;脂溶性维生素易溶于非极性有机溶剂,而不易溶于水。
3种显色反应对稻米籽粒中原花色素含量的检测分析刘丽莉;白宁宁;谢婧;严明理【摘要】利用二甲基乙酰胺二甲基缩醛(DMACA)染色法、铁铵矾染色法和香草醛染色法,测定了不同品种稻米籽粒中原花色素的含量。
用DMACA染色法测得谭农s/制21、R288、凡-14、12庚351、秦稻2号籽粒中原花色素的质量分数依次为0.136,0.183,0.085,4.115,24.736 mg/g;用铁铵矾染色法测得的质量分数依次为0.292,0.094,1.940×10-4,1.220,8.080 mg/g;用香草醛染色法测得的质量分数依次为1.349,1.363,1.093,3.733,15.153 mg/g。
检测结果表明:5种稻米品种中,秦稻2号的原花色素含量最高,是12庚351的4.1~6.6倍,凡-14中的含量最低;黑米品种(秦稻2号和12庚351)比白米品种(R288、谭农s/制21和凡-14)中原花色素的含量明显要高。
吸光度相对标准偏差(RSD)值表明,3种染色法测定原花色素含量的精密度由高到低依次为:香草醛染色法、DMACA 染色法、铁铵矾染色法。
%The proanthocyanidins content was determined in rice grain of different colors using dimethylamino-cinnamaldehyde (DMACA) staining, Ferric ammonium alum staining and Vanillin staining. Experimental studies showed that the proanthocyanidins mass fraction of five rice breeds (Tannong s/zhi21, R288, Fan-14, 12Geng351 and Qingdao2) detected by DMACA staining was successively as follows, 0.136, 0.183,0.085, 4.115 and 24.736 mg/g (dry weight); the result detected by Ferric ammonium alum staining was 0.292, 0.094, 1.940×10-4, 1.220 and 8.080 mg/g; and the result detected by Vanillin-HCl staining was 1.349, 1.363,1.093, 3.733 and 15.153 mg/g. The proanthocyanidins content ofQingdao2 was the highest, which was about 4.1 to 6.6 times of 12Geng351,and Fan-14 was the lowest in five rice breeds; the proanthocyanidins content of black rice breeds (Qingdao2 and 12Geng351) was higher than that of white rice breeds (Tannong s/zhi21, R288, Fan-14). The relative standard deviation (RSD) of the absorbency showed that the precision level of determining proanthocyanidins content as follow, the first was vanillin staining, the second was DMACA staining and the third was ferric ammonium alum staining.【期刊名称】《湖南工业大学学报》【年(卷),期】2015(000)005【总页数】6页(P96-101)【关键词】稻米;原花色素;显色反应;DMACA染色法;铁铵矾染色法;香草醛染色法【作者】刘丽莉;白宁宁;谢婧;严明理【作者单位】湖南科技大学生命科学学院,湖南湘潭 411201; 湖南科技大学重金属污染土壤生态修复与安全利用湖南省高校重点实验室,湖南湘潭 411201;湖南科技大学生命科学学院,湖南湘潭 411201;湖南科技大学生命科学学院,湖南湘潭 411201;湖南科技大学生命科学学院,湖南湘潭 411201; 湖南科技大学重金属污染土壤生态修复与安全利用湖南省高校重点实验室,湖南湘潭 411201【正文语种】中文【中图分类】Q819原花色素(proanthocyanidins,PCs)是一类广泛存在于各种植物中的具有特殊分子结构的生物类黄酮,由不同数量的儿茶素(catechin)或表儿茶素(epicatechin)结合而成[1]。
原花青素类化合物结构、含量测定及其功能研究进展1 简介原花青素(Proantho Cyanidins,PC),又名缩合鞣质,可视作花青素( cyanidin)类物质的聚合物,是自然界中广泛存在的一类多酚类化合物。
通常将从植物中分离得到的一切无色的、在无机酸存在和加热处理下能产生红色花青素( cyanidin)的一类多酚化合物统称为原花青素(赵平2011)。
最初是在20 世纪40 年代从花生仁的包衣中提取出来,在50 年代又被法国科学家从海松树皮中发现并提取出来,并将其提取率提高到达85%。
近来,研究证明原花青素是很强的抗氧化剂,可以清除自由基,其抗氧化、清除自由基的能力是维生素E的50 倍、维生素 C 的20 倍,能防治80 多种因自由基引起的疾病,包括心脏病、关节炎等,还具有改善人体微循环功能(张长贵2009)。
目前,原花青素作为营养强化剂、天然防腐剂、天然抗氧化剂、DNA 保护剂等,被广泛应用于食品、药品、化妆品等领域。
2 化学结构及分类原花青素是以黄烷-3-醇为结构单元通过C-C 键聚合而形成的化合物,起初称为黄烷醇类或归于缩合鞣质。
其结构分类主要取决于五方面:(1)黄烷-3-醇单元的类型;(2)单元之间的连接方式;(3)聚合程度(组成单元的数量);(4)空间构型;(5)羟基是否被取代(如羟基的酯化、甲基化等)。
根据原花青素的聚合程度可分为单倍体(monomer)、寡聚体(oligomer)和多聚体(polymer)(Alan et al 2008 )。
其中单倍体是基本结构单元,寡聚体由2~10 个单倍体聚合而成,多聚体则由10 个以上的单倍体聚合而成(张慧文2015)。
2.1 单倍体单倍体是构成原花青素的结构单元,属于黄烷-3-醇类化合物,该类成分可通过一定方式连接形成原花青素。
单倍体一般是儿茶素(catechin)和表儿茶素(epiactechin),但是也有其他的单倍体,如多一个羟基的表没食子儿茶素(epigallocatechin)或少一个羟基的表阿夫儿茶精(epiafzelechin)(LELONO et al 2013 )。
葡萄籽中原花色素的含量测定方法简述摘要:葡萄籽中的原花色素具有很多的生物活性,其含量的测定对于研究葡萄籽的生物活性以及开发葡萄籽的药用价值具有很大的意义。
本文介绍了葡萄籽中原花色素的含量测定方法,包括提取、纯化、检测等步骤,为研究葡萄籽的生物活性以及开发葡萄籽的药用价值提供了一定的参考。
关键词:葡萄籽;原花色素;含量测定;生物活性;药用价值一、引言葡萄籽是葡萄的种子,富含原花色素、多酚类物质、黄酮类物质等多种生物活性成分。
其中,原花色素是一种天然的生物活性成分,具有很多的生物活性,如抗氧化、抗炎、抗肿瘤等。
因此,研究葡萄籽中原花色素的含量及其生物活性具有很大的意义。
二、葡萄籽中原花色素的提取葡萄籽中原花色素的提取可采用乙醇提取法、水提取法、超声波提取法、微波辅助提取法等多种方法。
其中,乙醇提取法是一种常用的提取方法,其步骤如下:1、取适量的葡萄籽,粉碎成细粉。
2、将葡萄籽粉末加入适量的乙醇中,并加入一定量的氢氧化钠。
3、在室温下振荡提取2-3小时。
4、离心沉淀,取上清液。
5、重复以上步骤,直至提取液无色。
6、将提取液浓缩至一定体积,得到葡萄籽中原花色素的提取物。
三、葡萄籽中原花色素的纯化葡萄籽中原花色素的提取物中含有其他的杂质,需要进行纯化。
纯化方法可以采用硅胶柱层析法、逆流色谱法、高效液相色谱法等多种方法。
其中,高效液相色谱法是一种常用的纯化方法,其步骤如下:1、将葡萄籽中原花色素的提取物溶解在适量的溶剂中。
2、用C18柱进行分离,选择合适的流动相,进行梯度洗脱。
3、将纯化后的葡萄籽中原花色素的溶液收集起来,用氮气吹干。
4、将干燥后的纯化产物溶解在适量的溶剂中,得到纯化后的葡萄籽中原花色素。
四、葡萄籽中原花色素的检测葡萄籽中原花色素的检测可以采用紫外分光光度法、高效液相色谱法、质谱法等多种方法。
其中,高效液相色谱法是一种常用的检测方法,其步骤如下:1、将纯化后的葡萄籽中原花色素溶解在适量的溶剂中。