低级别胶质瘤
- 格式:doc
- 大小:21.50 KB
- 文档页数:3

胶质瘤分级特点-概述说明以及解释1.引言1.1 概述概述:胶质瘤是一种常见的中枢神经系统肿瘤,起源于神经胶质细胞,占颅内肿瘤的一部分。
随着医学技术的不断发展和深入研究,对胶质瘤的认识也日益深化。
胶质瘤的分级特点是指根据其病理学表现和生物学特性,将其分为不同的等级,以便为临床诊断和治疗提供参考依据。
在胶质瘤的分级中,常用的标准是根据世界卫生组织(WHO)的分类系统,将胶质瘤分为四个等级:I级、II级、III级和IV级。
这些等级主要基于肿瘤的细胞学特征、组织结构、增殖指标以及内分泌功能等方面的差异,从而对胶质瘤的预后和治疗方案进行评估。
胶质瘤分级的意义在于提供了对疾病的更准确的评估和定性。
通过对胶质瘤进行分级,医生可以更好地了解肿瘤的生物学特性和难以观察到的病理学特征,从而为患者的诊断和治疗方案提供更科学的依据。
不同等级的胶质瘤具有不同的生长方式、扩散能力和预后。
因此,对胶质瘤进行准确的分级可以帮助医生更好地了解疾病的发展趋势,选择合适的治疗方法,并对患者的预后做出合理的判断。
本文旨在介绍胶质瘤分级的特点和其在临床实践中的应用。
通过对胶质瘤分级标准的解析和相关研究的总结,我们将全面探讨不同胶质瘤分级之间的差异和临床意义,为医学界提供新的研究方向和发展趋势。
同时,我们还将展望胶质瘤分级领域未来的研究方向,以期为胶质瘤的治疗和预后评估提供更准确、个体化的指导。
1.2文章结构1.2 文章结构本文将按照以下顺序展开对胶质瘤分级特点的探讨:第二部分:正文2.1 胶质瘤的定义和分类这一部分将介绍胶质瘤的基本概念和分类方法。
首先,会对胶质瘤的定义进行阐述,包括描述其起源和基本特征。
然后,将详细介绍当前胶质瘤的分类方法,如WHO(世界卫生组织)分类系统,根据细胞类型和组织结构将胶质瘤分为不同的亚型。
这一部分的目的是为之后的分级特点讨论提供必要的背景知识,并为读者建立起对胶质瘤分类的整体认识。
2.2 胶质瘤分级的意义和目的在这一部分,将介绍胶质瘤分级的重要性以及分级的具体目的。

低级别胶质瘤英语Low-grade glioma, also known as low-grade astrocytoma,is a type of brain tumor that grows slowly and is less aggressive than high-grade gliomas. These tumors can occur in any part of the brain and are often found in the cerebral hemispheres. They are typically slow-growing and may not cause symptoms for many years.Low-grade gliomas are classified as World Health Organization (WHO) grade I or II, based on their appearance under a microscope and their growth pattern. Grade I tumors are the least aggressive, while grade II tumors areslightly more aggressive but still considered low-grade.Symptoms of low-grade gliomas can vary depending on the location of the tumor, but may include headaches, seizures, changes in vision or hearing, and cognitive or behavioral changes. However, some individuals with low-grade gliomas may not experience any symptoms until the tumor growslarger or affects surrounding brain tissue.Diagnosis of low-grade gliomas often involves a combination of imaging tests such as MRI or CT scans, aswell as a biopsy to examine the tumor cells under a microscope. Once diagnosed, treatment options for low-grade gliomas may include surgery to remove as much of the tumor as possible, radiation therapy, and chemotherapy.In some cases, a "watch and wait" approach may be recommended, particularly for slow-growing tumors that are not causing significant symptoms. This approach involves regular monitoring with imaging tests to track the growth of the tumor and assess whether treatment is necessary.Overall, the prognosis for individuals with low-grade gliomas can vary depending on factors such as the age of the patient, the location and size of the tumor, and the specific characteristics of the tumor cells. While these tumors are generally considered less aggressive than high-grade gliomas, they can still have a significant impact on quality of life and may require ongoing medical management.低级别胶质瘤,也称为低级别星形细胞瘤,是一种生长缓慢且比高级别胶质瘤更不具侵袭性的脑肿瘤。

脑胶质瘤诊疗指南(2022年版)一、概述脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,2021年版WHO中枢神经系统肿瘤分类将脑胶质瘤分为1~4级,1、2级为低级别脑胶质瘤,3、4级为高级别脑胶质瘤1。
本指南主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的成人高、低级别脑胶质瘤的诊治2,3。
我国脑胶质瘤年发病率为5~8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。
脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。
此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。
脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。
目前,临床诊断主要依靠CT及MRI等影像学诊断,弥散加权成像(diffusion weighted imaging,DWI)、弥散张量成像(diffusion tensor imaging,DTI)、灌注加权成像(perfusion weighted imaging,PWI)、磁共振波谱成像(magnetic resonance spectroscopy,MRS)、功能磁共振成像(functional magnetic resonance imaging,fMRI)、正电子发射体层成像(positron emission tomography,PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。
脑胶质瘤确诊需要通过肿瘤切除手术或活检手术获取标本,进行组织病理和分子病理整合诊断,确定病理分级和分子亚型。
分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。
脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。
手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。
手术治疗原则是最大范围安全切除肿瘤,而常规神经导航、功能神经导航、术中神经电生理监测和术中MRI实时影像等新技术有助于实现最大范围安全切除肿瘤。

胶质瘤手术有哪些并发症?胶质瘤手术及术后并发症。
胶质瘤一定要做手术吗?术后并发症有哪些?胶质瘤术后并发症多,还需要手术吗?胶质瘤手术有哪些并发症?由于影像技术、神经麻醉的进步,以及术中神经导航、神经监测、MRI等方法的应用,胶质瘤切除技术不断完善,但胶质瘤手术仍存在术后并发症的问题。
脑胶质瘤患者的管理重点是选择延长生存期的治疗方式,同时最大限度地降低并发症的风险,并保持适当的生活质量。
根据作者的经验,低级别胶质瘤患者最好进行全切除,以降低高级别病变复发的风险。
在高度胶质瘤患者中,年龄、卡诺夫斯基(Karuafsky)表现状态、组织学和放疗的使用是生存的主要预测因素。
手术切除的程度不如这些因素重要,但最近的一系列研究支持了接受更广泛手术的患者的生存优势。
手术切除的主要并发症是神经损伤。
在功能性核磁共振成像和术中定位的辅助下,仔细的术前计划有助于实现最大限度的安全切除。
胶质瘤手术有哪些并发症?胶质瘤手术有哪些并发症?由于高级别胶质瘤具有高侵袭性、难切除性和高复发性,胶质瘤的治疗和预后一直是胶质瘤患者及其家属非常关注的话题。
即使采用手术切除、放疗和化疗等综合治疗,高级别胶质瘤的预后仍然很差,2年生存率仅为26.5%。
低级别胶质瘤预后较好,5年生存率58-72%。
然而,在高级别胶质瘤中,越来越多的证据强调肿瘤体积对患者生存的重要性以及大范围切除在降低恶性肿瘤转化率中的作用。
胶质瘤手术有哪些并发症?1.血肿在现有的外科病例中,1-4%的患者因术后血肿而出现神经功能缺损。
这些患者通常存在意识水平、神经缺陷和术后癫痫发作的问题。
一旦患者出现颅内高压和出血,应立即治疗,以防止永久性神经功能缺损。
在手术过程中或由于肿瘤部分切除后瘤内出血和瘤周水肿而无意中留下肿瘤残留。
2.局部并发症局部并发症是指与手术部位(感染、假性脑膜膨出)或大脑(癫痫、脑积水、气脑)相关的并发症,不会导致神经功能缺损。
接受胶质瘤切除术的患者的发病率为3%至5%,并且与患者的年龄有关。

胶质瘤的分级
胶质瘤是一种原发性脑肿瘤,由神经胶质细胞形成。
根据肿瘤的病理学特征和临床表现,胶质瘤可分为四个等级:
一级胶质瘤:这是最低级别的胶质瘤,通常被认为是非恶性肿瘤。
这种肿瘤生长缓慢,通常可以通过手术完全切除。
一级胶质瘤的预后较好,患者生存率高。
二级胶质瘤:这种肿瘤已经变得更加恶性,其生长速度较快。
虽然手术可以去除部分肿瘤,但是很难完全清除,因为它们会扩散到周围组织中。
二级胶质瘤的预后相对较好,但患者的生存率比一级胶质瘤要低。
三级胶质瘤:这种肿瘤已经非常恶性,生长速度非常快。
手术通常只能去除部分肿瘤,因为它们已经扩散到周围组织中。
医生通常会采用化疗和放疗等方法来延长患者的生存期。
四级胶质瘤:这是最高级别的胶质瘤,也被称为恶性胶质母细胞瘤。
这种肿瘤非常危险,生长速度非常快。
手术只能去除部分肿瘤,而且肿瘤已经扩散到周围组织中。
患者的生存期非常短,通常只能延长几个月。
医生通常会使用放疗和化疗等方法来延长患者的生存期。
因此,胶质瘤的分级是非常重要的,它有助于医生制定最佳的治疗方案,并预测患者的预后。
- 1 -。

胶质瘤症状是怎样的?一级胶质瘤属于低级别胶质瘤,低级别胶质瘤发现的原因多种多样,有的患者是由于症状明显、有的是因为体检、还有一部分患者是由于其他疾病去医院检查发现……低级别一级胶质瘤临床都是怎么表现出来的?大脑半球的一级胶质瘤的发生率比恶性胶质瘤(如胶质母细胞瘤,原始神经外胚层肿瘤)低,青年人多见,但预后较好。
可能由于此类肿瘤的发生率低或者由于患者一般能生存较长时间的缘故,大脑半球一级胶质瘤的正规临床研究较少,对其自然病史的熟悉了解程度也不如高分级胶质瘤。
由于近年神经影像学的发展,能使临床医生在患者病变早期作出正确诊断,也使术前的临床病史有了根本上的改变。
在没有CT的年代中,大脑半球低分级胶质瘤患者常常表现为头痛,视乳头水肿及局灶性功能缺失。
反之,今天可仅仅因为几次抽搐而接受的手术治疗,但他们的神经功能却是很正常的。
Laws等报道:在1915~1975年期间接受治疗的病人中,40%患者有视乳头水肿,近半数患者主诉头痛,而51%患者表现运动障碍;Gol 报道另一组1960年前接受治疗的病人,72%患者于诊断时有头痛,59%有视乳头水肿,56%有偏身活动障碍及56%出现癫痫发作。
相比而言,在Piemelen报道中全组患者脑内病变均由CT诊断证实,患者中只有5%患者首发症状是头痛,15%有肢体活动障碍,而超过90%患者有癲痫发作(视乳头水肿比率未被记录)。
另外INC国际神经外科医生集团,致力于中外神经外科技术的交流、合作、促进和提高,同时针对高端人群及疑难手术病例,提供更好的诊疗和手术方案。
INC 国际神经外科医生集团,致力于中外神经外科技术的交流、合作、促进和提高,同时针对高端人群及疑难手术病例,提供更好的诊疗和手术方案。
Vertoack 等亦报道:16%患者有头痛,8%有视乳头水肿,16%肢体活动缺失,而92%为癲痫发作。
癲痫作为一级胶质瘤最早出现的症状,不仅在临床上而且在外科治疗上都显得很重要。




2021who胶质瘤的分级
胶质瘤在神经外科较为常见,世界卫生组织将其分为四个级别,其中I级和II级,偏良性,属于低度恶性、低级别的胶质瘤。
而III级和IV 级,属于偏恶性、高级别的肿瘤,具体如下:
1、I级:如毛细胞性的胶质瘤,可对其进行手术的完整切除,可以达到痊愈的目的,一般不影响患者的寿命,可以长期生存;
2、II级:如星形细胞瘤、少突胶质细胞瘤等,进行手术的完整切除,通常患者可以获得10年左右的生存期,部分患者还可以长期生存,达到治愈的目的;
3、III级:属于高度恶性的胶质瘤,如间变性星形细胞瘤等,对其进行手术切除,包括术后的放疗、化疗,患者一般能达到3-5年的平均生存时间;
4、IV级:属于级别最高、最恶性的胶质瘤,一般是多形性胶质细胞瘤,患者进行手术,包括术后的放疗、化疗、生物治疗、免疫治疗、中草药治疗等一系列综合性的治疗手段,一般也就能达到15个月左右的中位生存期。
胶质瘤的类型不同、级别不同,预后差别较大,患者一旦发现胶质瘤,应尽快到医院就诊。
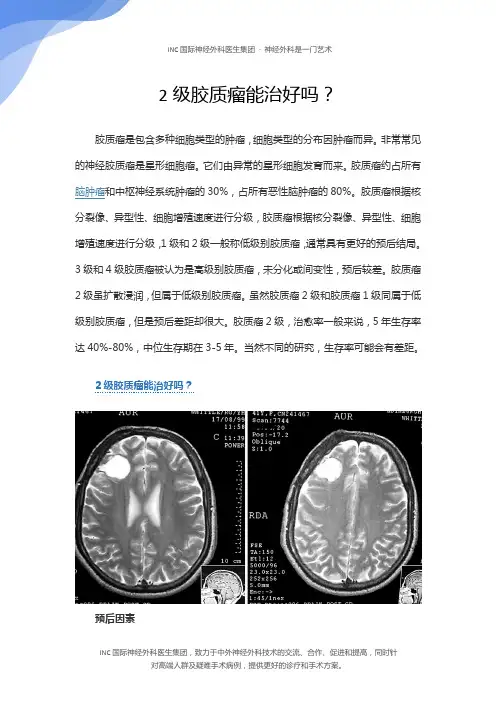
2级胶质瘤能治好吗?胶质瘤是包含多种细胞类型的肿瘤,细胞类型的分布因肿瘤而异。
非常常见的神经胶质瘤是星形细胞瘤。
它们由异常的星形细胞发育而来。
胶质瘤约占所有脑肿瘤和中枢神经系统肿瘤的30%,占所有恶性脑肿瘤的80%。
胶质瘤根据核分裂像、异型性、细胞增殖速度进行分级,胶质瘤根据核分裂像、异型性、细胞增殖速度进行分级,1级和2级一般称低级别胶质瘤,通常具有更好的预后结局。
3级和4级胶质瘤被认为是高级别胶质瘤,未分化或间变性,预后较差。
胶质瘤2级虽扩散浸润,但属于低级别胶质瘤。
虽然胶质瘤2级和胶质瘤1级同属于低级别胶质瘤,但是预后差距却很大。
胶质瘤2级,治愈率一般来说,5年生存率达40%-80%,中位生存期在3-5年。
当然不同的研究,生存率可能会有差距。
2级胶质瘤能治好吗?预后因素分子水平在低度胶质瘤的预后分层中起着至关重要的作用。
IDH突变和染色体1p/19q共缺失的预后和预测价值最初是由早期研究提出的,后来由EORTC、RTOG和NOA试验的结果证实。
本质上,idh突变型胶质瘤与更长的总生存期和对烷基化试剂更好的反应相关,而这些特征在包含1p/19q共缺失的肿瘤亚群中更为突出。
相比之下,idh-野生型胶质瘤的预后比idh-突变型胶质瘤差得多,只有MGMT启动子甲基化的肿瘤表现出有限的化学敏感性。
除了分子水平和WHO分级,其他一些患者和肿瘤特征也显示出预后价值。
2级弥漫性神经胶质瘤生存期与老年(⩾40年)诊断、星形细胞瘤组织学,较大的术前肿瘤直径(⩾6厘米),肿瘤越过中线,术前存在神经功能缺损等都存在关联。
在年龄、神经功能缺陷、Karnofsky功能状态(KPS)和诊断时肿瘤直径方面,其他研究也发现了类似的关联。
在间变性胶质瘤中,除了分子水平外,年龄和KPS是制定单独治疗策略时需要考虑的两个主要预后因素。
2级胶质瘤的治疗概述2级胶质瘤的医疗治疗包括手术、放疗和化疗的结合,最好由多学科团队进行。
外科手术是治疗这些肿瘤的基础,提供了组织诊断和肿瘤的大体细胞缩小。
儿童脑胶质瘤诊疗规范(2021年版)1 概述胶质瘤是儿童和青少年最常见的中枢神经系统肿瘤,占所有儿童颅内肿瘤的40%~60%。
胶质瘤起源于大脑和脊髓中的胶质前体细胞。
根据世界卫生组织(World Health Organization,WHO)对脑肿瘤的分类,胶质瘤又分为低级别(Ⅰ级和Ⅱ级)和高级别(Ⅲ级和Ⅳ级)肿瘤。
其临床表现非常广泛,大多数儿童胶质瘤表现为良性、生长缓慢的病变,WHO分类为Ⅰ级或Ⅱ级。
这些儿童低级别胶质瘤(low grade glioma,LGG)与成人LGG有着根本的区别,较少发生恶性转化,整体生存率良好。
然而,相当一部分胶质瘤在短时间内发展迅速,WHO Ⅲ级或Ⅳ级高级别胶质瘤(high grade glioma,HGG),基本上无法治愈,甚至在几个月内就会致命。
在过去的十年里,儿童胶质瘤的分子生物学方面取得了前所未有的进展。
全球范围内大规模合作研究已经对不同年龄、不同级别和不同组织学的胶质瘤基因组和表观遗传学改变进行了分类。
这些研究揭示了具有不同分子、病理和临床特征的生物亚群与胶质瘤患者的管理有着明显相关性。
虽然儿童脑肿瘤的病理分类是一门新兴的发展很快的特殊学科,但脑胶质瘤的分类目前仍参考2016年WHO 中枢神经系统肿瘤分类。
本规范主要涉及儿童常见LGG、HGG的诊治(儿童室管膜肿瘤有独立的规范)。
儿童脑胶质瘤治疗需要神经外科、影像科、病理科、放疗科、肿瘤内科和神经康复科等多学科合作,遵循循证医学原则,目的是改善儿童胶质瘤患者的日常管理,并对患者进行长期随访观察,以提高生活质量和预防LGG的长期后遗症。
为HGG患儿努力寻找有效的治疗手段,采取规范化、个体化综合治疗措施,以期达到最好的治疗效果,尽可能延长患儿的无进展生存期和总生存期。
2 适用范围根据病史、查体、影像学检查、病理形态学、免疫组化、基因检测、分子生物学等检查确诊的儿童脑胶质瘤。
其具体分类见《2016版WHO中枢神经系统肿瘤分类标准》(附表1)。
常见病鉴别诊断鉴别诊断:小脑半球占位:1.低级别胶质瘤:位于小脑半球,可呈囊性改变,但周围有水肿,头颅MRI提示长T1长T2,增强后可囊壁周围强化2.血管网织细胞瘤:位于小脑半球或桥脑小脑角,囊性为主血管网织细胞瘤,头颅MRI提示长T1长T2,增强后可见明显强化的瘤结节3.小脑脑膜瘤:肿瘤较小时可无明显症状,肿瘤较大时,可出现颅高压症状,压迫后组颅神经时,可出现后组颅神经症状,压迫引起脑积水时,可出现路脑压、肢体乏力、意识障碍、大小便失禁等症状。
在头颅CT上多呈高密度或等密度影,多密度均匀,无混杂信号,形状多规则,头颅MRI增强多可见增强肿瘤影,密度均匀,可见脑膜尾征。
嗜酸性肉芽肿:1、嗜酸性肉芽肿:多见于颅骨破坏,常呈虫蚀样,侵犯颅骨处常有软组织影。
局部呈炎性表现。
肿块质地韧,周围皮肤颜色正常,肿块无明显压痛。
2、黄脂瘤病:好发在5岁以下儿童,常为多发,亦可见单发,颅骨常有地图样破坏。
3、皮样囊肿:颅骨破坏多呈膨胀性损害。
肿块为囊性,可位于皮下及颅骨内。
4、颅骨血管瘤:好发于板障处,瘤体较大时,可见颅骨破坏明显。
行头颅MRI检查可见被破坏颅骨处有血液留空现象,或混杂信号。
鞍区占位:1.颅咽管瘤:多见于儿童及青少年,肿瘤常发生在鞍上,向第三脑室、鞍旁、鞍后等处发展.临床表现为下丘脑、垂体功能损害症状如尿崩,发育迟缓等,视野改变多不规则,常有颅内压增高.蝶鞍可正常或扩大,有时后床突破坏,附近骨质侵蚀,鞍内或鞍上有钙化斑块.CT检查可见鞍上囊性低密度病灶,囊壁呈蛋壳样钙化,实体肿瘤为高密度表现,可有强化.MR可见鞍区囊性占位,鞍内可见正常垂体.2.垂体瘤:以内分泌症状和视力视野障碍为主要表现,常有双颞侧偏盲,眼底可有原发性视神经萎缩,一般无颅内压增高症状,无生长发育迟缓。
MR示肿瘤囊性变少,多可均匀强化。
3.脑膜瘤:可发生于鞍结节、鞍旁、海绵窦、蝶骨嵴等处,多见于成年人,常有视力视野改变,头痛.内分泌改变不明显.蝶鞍大小改变不明显.CT 为均匀高密度病灶,增强明显.MR示T1相为等信号,T2相为高信号,增强后可见有典型脑膜尾征.4.异位松果体瘤:多发生于儿童及青春期,尿崩为首发,有时出现性早熟、发育停滞及视神经受损表现,蝶鞍大小正常.CT病变为类圆形高密度灶,边界清,内有散在钙化点,病变可有明显均匀增强.MR病变为长T1长T2信号.5.脊索瘤:多见于成年人,位于颅底斜坡,向鞍区侵犯,出现头痛视力视野改变及多组颅神经麻痹症状,内分泌症状不明显,头颅某线平片及CT可见斜坡、蝶鞍以及临近蝶骨体骨质破坏。
不同级别颅内胶质瘤能活多久?颅内胶质瘤是常见的原发性脑肿瘤之一,在广泛意义上,属于癌症。
颅内胶质瘤发端于颅内神经上皮组织,常生长在大脑额叶和颞叶,还可见于脑干、小脑、大脑其他部位,以及脊髓。
据美国癌症学会统计,颅内胶质瘤有三种类型,包括星形细胞瘤、少突胶质细胞瘤和室管膜瘤;胶质瘤按级别还有低级别和高级别的区分,根据胶质瘤的生物学行为和病理表现,世界卫生组织将胶质瘤分为四个等级。
1到2级为低级别胶质瘤,3级和4级则属于高级别胶质瘤,其中1级胶质瘤生长最慢,多见于儿童和青少年,成人中很少发生。
4级胶质瘤生长和蔓延的速度最快,多见于60至80岁年龄组的成年人。
胶质瘤的发病风险随年龄增长而增加,且男性发生胶质瘤的可能性稍高。
患者症状与其他脑肿瘤患者所产生的症状相似,取决于受影响的脑区。
最常见的症状是头痛及恶心呕吐,其他症状可包括记忆力减退、体力虚弱、肌肉控制丧失,平衡障碍、视力问题、言语困难、认知能力下降和性格改变、癫痫发作等。
随着肿瘤的继续生长和对脑细胞的持续破坏,会引起脑部肿胀和颅骨受压,症状可能会恶化或改变。
颅内胶质瘤的确切病因目前仍不清楚,一般认为,胶质瘤多是由于先天的遗传高危因素和环境的致癌因素相互作用所导致。
一些已知的遗传疾病,例如神经纤维瘤病(I型)以及结核性硬化疾病等,为脑胶质瘤的遗传易感因素。
有这些疾病的患者,其脑胶质瘤的发生机会要比普通人群高很多。
此外,一些环境的致癌因素也可能与胶质瘤的发生相关。
有研究表明,电磁辐射,例如手机的使用,可能与胶质瘤的产生相关。
大部分胶质瘤属于恶性肿瘤,在当前的医学条件下很难达到完全根治,只有少数胶质瘤可以达到真正的临床治愈。
胶质瘤尤其是高级别胶质瘤大多会复发,而且复发时大多级别会升高。
并且肿瘤生长的部位越来越深,部位越来越广泛,最后会侵犯最重要的脑内结构,会导致病人发生脑疝,从而死亡。
很多患者是在病情不断升级恶化中因各种并发症死亡。
当被诊断出患有颅内胶质瘤,患者或其家人最关注一个问题就是患者的生存期,换句话说,还能活多久。
Glioma patients group:two four nine one five eight seven seven eight胶质瘤病友群:2491587781. In patients with low grade glioma and controlled epilepsy as the single symptom, surgery may be deferred until clinical or radiological progression. (Level of Evidence 4- Recommendation grade C)当可控的癫痫作为唯一症状的低度恶性胶质瘤患者,在没有出现临床上或者影像上的进展的时候,手术可以推迟。
上海东方医院神经外科魏社鹏In one retrospective study by van Veelen et al, it was shown that in patients with controlled seizures as the single symptom, the prognosis is not influenced by the timing of the surgery. It could be, therefore, safe to defer surgery until clinical or radiological progression in patients with controlled epilepsy only.Veelen等一项回顾性研究发现,以癫痫发作为单一症状的胶质瘤病人,其预后并没有被手术的时机所影响,故建议在病人的临床症状和影像学结果没有出现进展之前,尽可能的推迟手术也是很安全的。
In 1994 Berger et al analyzed the effect of extent of resection on recurrence in patients with low grade gliomas. They found that for tumours greater than 10 cm3 a greater percent of resection and a smaller volume of residual disease convey a significant advantage in terms of recurrence, compared to those that had a less aggressive resection or biopsy. For tumours smaller than 10 cm3 no recurrence was detected over 3 to 4 years, regardless of percent of resection.1994年,Berger等发现那些体积大于10立方厘米的肿瘤,术中切除越多,则复发越迟,而那些体积小于10立方厘米的肿瘤,切除程度和复发则没有联系。
2. In patients with increased intracranial pressure, neurological deficits, uncontrollable seizures, or in those who have clinical or radiological progression, maximal resection, when safe, should be attempted. (Level of Evidence 3- Recommendation grade B)对于有颅内压增高症状的病人,以及有神经功能缺损,未控制的癫痫,或者临床或者影像上出现进展的病人,在安全的前提下,尽可能做根治性的切除。
3. Postsurgical radiation therapy may be deferred until clinical or radiological progression. When Radiation therapy is indicated, the dose should be between 45 and 54 Gy. (Level of Evidence 1- Recommendation grade A)术后放疗可以被推迟,直到出现临床或者影像上的进展。
当施行放疗时,剂量应当在45-54Gy 之间。
A clinical trial (EORTC 22845) performed in 2002 compared immediate RT given after surgery versus RT after tumour recurrence. Although the progression-free survival time was 5.3 years for immediate RT versus 3.4 years for RT deferred and the seizures were better controlled in the first group, using the “wait and see” approach and delaying the RT had no adverse impact on medi an survival.2002年的一项临床试验,将术后立即放疗和那些出现进展后再行放疗的病人进行了比较发现,尽管术后立即放疗的病人有5.3年的稳定期,延迟放疗的群体有3.4年的稳定期,而且癫痫的控制在前者海较为容易。
但是,和术后立即放疗相比,观察随访以及延迟放疗对中位生存期并没有不利的影响。
Based on these data it seems appropriate to defer the post-surgical RT until progression of disease. When RT is indicated, the dose should be 45Gy to 54 Gy.由此,延迟放疗至出现进展可行,剂量控制在45-54Gy之间较为妥当。
4. Radiotherapy alone may be offered in patients with progressive tumours. (Level of Evidence 1- ecommendation grade A) 进展性的低度恶性胶质瘤患者可以单给放疗。
5. Chemotherapy should not be added to radiation therapy, since the combination shows no benefit in comparison to RT alone and increases the toxicity. (Level of Evidence 1- Recommendation grade A). 化疗不建议跟放疗联合,因为此种协同和单纯放疗相比,并没有任何好处,反而增加了治疗的毒性。
6. Chemotherapy such as temozolomide may be offered in patients with progressive tumours that harbour combined 1p/19q loss of heterozygosity. (Level of Evidence 4- Recommendation grade C)化疗药物例如替莫唑胺可以给予那些处在进展期中的且含有1p/19q的肿瘤患者The largest study to date was performed by Kaloshi et al. They retrospectively reviewed their experience of 149 patients with progressive low grade gliomas who received temozolomide as their initial treatment after surgery. Fifty-three percent of the patients had objective response, themedian PFS was 28 months, and the 3-year survival was 69.8%. The treatment was well tolerated. Interestingly, combined 1p/19q loss of heterozygosity (LOH) was significantly associated with a higher rate (p=0.02) and longer objective response to chemotherapy (p=0.0017), and longer PFS (p=0.00041) and overall survival (p=0.04). This study was limited by its retrospective design, but adds evidence that low grade gliomas respond to temozolomide, and that 1p/19q LOH is associated with chemosensitivity and improved outcome. Kaloshi等组织的一项回顾性的研究发现,149例进展性的低度恶性胶质瘤患者在术后接受了替莫唑胺为首次治疗,有53%的病人有了客观的反应,无症状期为28个月,3年的生存期为69.8%,并且治疗耐受性良好。
那些有1p和19q缺失的的患者反应尤其良好。
7. For high risk patients (criteria defined in discussion) inclusion in a clinical trial is recommended. In the absence of a clinical trial adjuvant chemotherapy and radiation therapy may be considered on an individual basis.有高危险因素的正在进行临床试验的病人,可以给化疗。
对于那些未进行临床试验的患者,放疗联合化疗的给予要按照个体化原则来进行。