已批准通过仿制药质量和疗效一致性评价品种目录 批
- 格式:xls
- 大小:28.00 KB
- 文档页数:3

总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)颁布时间:20170825为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。
建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
对国家食品药品监督管理总局已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案;对已公布的参比制剂存疑的,可向国家食品药品监督管理总局药品审评中心提出异议并说明理由,国家食品药品监督管理总局召开专家咨询委员会会议公开审议,并公开审议结果。
二、企业报国家食品药品监督管理总局备案的参比制剂全部向社会公开。
对国家食品药品监督管理总局未公布参比制剂的品种,由国家食品药品监督管理总局组织专家咨询委员会讨论后区别情况提出如下指导性意见:(一)可以确认符合参比制剂条件的;(二)存疑的;(三)明显不符合条件的。
对于(二)(三)两种情况是否继续进行研究或重新选择参比制剂,由企业自主决定并承担相应的责任。
三、企业自行从境外采购的参比制剂产品,在提交一致性评价资料时需提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明所用参比制剂是标明企业的产品。
企业发现所使用的参比制剂产品为假冒产品的,应终止正在进行的研究工作,已申报的,应及时向国家食品药品监督管理总局药品审评中心报告并撤回一致性评价申请,视情况免于责任;监管部门发现企业使用的参比制剂产品为假冒产品的,应及时通报相关企业,终止审评审批;已批准上市的要撤销批准文件并向社会公开信息,责成企业作出解释并根据情况立案调查。

附件2《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》收载程序和要求(试行)(征求意见稿)起草说明为配合《药品注册管理办法》(国家市场监督管理总局令第27号,以下简称《办法》)的贯彻实施,国家药品监督管理局药品审评中心(以下简称药品审评中心)起草了《<新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集>收载程序和要求(试行)(征求意见稿)》(以下简称《收载程序和要求》(征求意见稿))。
现将有关情况说明如下:一、起草背景2017年12月29日,原国家食品药品监督管理总局发布《总局关于发布<中国上市药品目录集>的公告》(2017年第172号,以下简称172号公告),明确由原国家食品药品监督管理总局组织制定《中国上市药品目录集》,“收录批准上市的创新药、改良型新药、化学药品新注册分类的仿制药以及通过质量和疗效一致性评价药品的具体信息,指定仿制药的参比制剂和标准制剂,对新批准上市的新注册分类药品以及通过仿制药质量和疗效一致性评价的药品直接纳入《中国上市药品目录集》,实时更新。
”根据原国家食品药品监督管理总局要求,药品审评中心自2017年12月29日起负责《中国上市药品目录集》品种收载和日常管理工作,并根据172号公告的规定,通过《中国上市药品目录集》指定仿制药的参比制剂和标准制剂。
2019年3月28日,国家药品监督管理局发布《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号,以下简称25号公告),25号公告规定了化学仿制药参比制剂遴选与确定的新程序,即由企业及行业协会提出申请或由药品审评中心推荐,经药品审评中心审核与专家委员会审议通过并对外公示后,由国家药品监督管理局发布确定(即以公告形式逐批发布《仿制药参比制剂目录》)。
25号公告同时规定“本公告自发布之日起实施,原发布的参比制剂相关文件与本公告不一致的,以本公告为准”。
故自25号公告发布之日起,《中国上市药品目录集》不再具备指定仿制药参比制剂的功能,参比制剂统一按25号公告规定的程序确定,《中国上市药品目录集》仅对国家药品监督管理局公布的中国境内已上市的参比制剂进行收载。

国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2013.02.16•【文号】国食药监注[2013]34号•【施行日期】2013.02.16•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知(国食药监注[2013]34号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),新疆生产建设兵团食品药品监督管理局:开展仿制药质量一致性评价,全面提高仿制药质量是《国家药品安全“十二五”规划》的重要任务,是持续提高药品质量的有效手段,对提升制药行业整体水平,保障公众用药安全具有重要意义。
为此,国家食品药品监督管理局决定,对2007年修订的《药品注册管理办法》实施前批准的基本药物和临床常用仿制药,分期分批进行质量一致性评价。
现将有关事宜通知如下:一、充分认识重要意义。
各省级药品监督管理部门务必高度重视仿制药质量一致性评价工作,充分认识该项工作的重要性、复杂性和长期性,充分认识开展仿制药质量一致性评价对确保药品质量安全,促进医药经济结构调整和产业升级,进一步增强我国医药产业国际竞争能力的重要意义。
应将仿制药质量一致性评价工作纳入“十二五”期间药品监管工作重点,加强组织领导,落实工作责任,按照国家食品药品监督管理局工作部署,结合本行政区域实际情况,制定具体实施方案,确保各项工作落到实处。
二、积极宣传有关政策。
国家食品药品监督管理局制定了《仿制药质量一致性评价工作方案》(以下简称《工作方案》,附件),明确了质量一致性评价的工作目标、原则、内容和程序,对工作进行了总体部署。
国家食品药品监督管理局还将陆续下发相关技术指导原则,规范质量一致性评价的研究和技术审查。
各省级药品监督管理部门要积极落实《工作方案》,做好质量一致性评价工作的宣贯和培训,及时传达有关政策,使药品生产企业深刻认识质量一致性评价的重要性和必要性,引导药品生产企业积极开展研究,合理安排工作进度、主动作为。


国家药监局关于无参比制剂品种仿制研究的公告文章属性•【制定机关】国家药品监督管理局•【公布日期】2023.10.12•【文号】国家药监局公告2023年第130号•【施行日期】2023.10.12•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局公告2023年第130号关于无参比制剂品种仿制研究的公告为满足患者临床用药需求,保障药品安全、有效、质量可控,鼓励申请人选择国家药品监管部门公布的参比制剂目录中收载的品种进行仿制研究。
对于参比制剂目录中未收载的品种,即无参比制剂品种,经评估如有预期临床价值,申请人可开展仿制研究。
现就无参比制剂品种仿制研究有关要求公告如下:一、坚持高标准、严要求。
以问题为导向,深化药品审评审批制度改革,按照为公众提供高质量的仿制药、促进仿制药产业高质量发展的原则开展相关工作。
二、坚持以临床价值为导向。
所仿制的品种应符合当前科学认识和临床诊疗需求及实践,作为主流药品被广泛使用,且具备不可替代性特征,同时有足够临床试验数据支持临床获益大于风险。
申请人应充分评估拟申报品种的预期临床价值,并通过良好设计的临床试验证明其预期临床价值。
三、坚持最严谨的标准,提升产品质量。
申请人应基于现行技术要求开展仿制研究,并对已上市同品种药品开展全面质量评估。
仿制药品质量不低于研究充分、上市基础好或在相应疾病领域市场份额较大的已上市品种。
四、申请人在充分评估无参比制剂品种的预期临床价值的基础上,如拟仿制,应向国家药监局药品审评中心(以下简称药审中心)提出沟通交流申请(Ⅲ类),提交相关研究资料。
药审中心应在规定时间内组织专家和申请人对药品预期临床价值进行沟通,沟通交流结果供申请人参考,并以适当形式公开。
后续相同品种如无特殊情况,可参考已公开的沟通交流结果。
五、对于经初步判断具有预期临床价值的品种,申请人完成相关研究后,按照现行临床试验申请程序提出临床试验申请,临床试验申请审评过程中将充分参考沟通交流结果。
国家食品药品监管总局对《关于仿制药质量和疗效一致性评价工作有关事项的公告》的政策解读一.《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号,以下简称《公告》)出台的背景和意义?自《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)发布以来,仿制药质量和疗效一致性评价(以下简称一致性评价)工作扎实推进,有的企业已经完成了部分品种研究工作,进入申报审评阶段。
为进一步加强对企业的指导,提高工作效率,我局对前期工作进行了总结和分析,研究制定了本《公告》,对一致性评价工作各环节进行了优化调整,旨在保障受理、检查、检验和审评等环节顺畅衔接,保障评价标准统一。
二.针对参比制剂确定和获得,《公告》中提出了哪些优化措施?为了便于企业开展研究工作,总局目前已发布8批610个品种规格的参比制剂,包括《关于落实﹤国务院办公厅关于开展仿制药质量和疗效一致性评价的意见﹥有关事项的公告》(2016年第106号)中公布的《2018年底前须完成仿制药一致性评价品种目录》(以下简称《289品种目录》)中的163个品种(219个品规)。
该目录中另约有90左右品种为改规格、改剂型、改盐基的品种,按照《仿制药质量与疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量与疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量与疗效一致性评价工作中改盐基药品评价一般考虑》等技术指南,上述改规格、改剂型、改盐基的约90左右品种的参比制剂选择依据也已明确。
至此,已经对《289品种目录》中大多数品种的参比制剂选择给出指导。
《公告》一方面对参比制剂选择顺序进一步明确,另一方面明确我局将继续对企业备案的参比制剂进行遴选和确认,符合参比制剂要求的发布参比制剂目录。
关于参比制剂获得事宜,企业可以通过申报一次性进口申请及进口备案、通关等程序来获得参比制剂,除此之外,《公告》明确企业还可以通过其他方式获得参比制剂,在提交一致性评价资料时,仅需在资料中提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明参比制剂真实性即可。
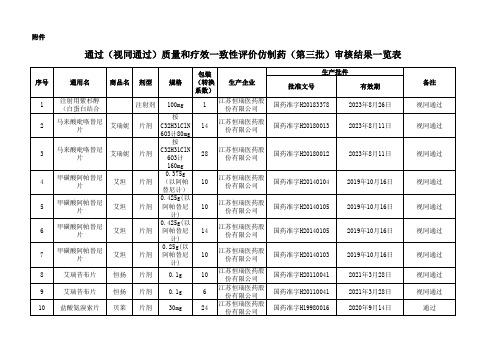
国家药监局关于发布仿制药参比制剂目录(第三十八批)的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药品监督管理局通告2021年第18号国家药监局关于发布仿制药参比制剂目录(第三十八批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十八批)。
特此通告。
附件:仿制药参比制剂目录(第三十八批)国家药监局2021年2月20日附件仿制药参比制剂目录(第三十八批)序号药品通用名称英文名称/商品名规格持证商备注1备注238-1噻托溴铵奥达特罗吸入喷雾剂Tiotropium Bromide and Olodaterol Hydrochloride Inhalation Spray/Spiolto(思合华)每瓶60喷,每喷含噻托铵2.5μg(相当于噻托溴铵一水合物3.124μg)和奥达特罗2.5μg(相当于盐酸奥达特罗2.736μg)Boehringer Ingelheim International GmbH国内上市的原研药品原研进口38-2噻托溴铵喷雾剂Tiotropium Bromide Spray每瓶60喷,每喷含噻托铵2.5μg,药液浓度含噻托铵0.2262mg/mlBoehringer Ingelheim International GmbH国内上市的原研药品原研进口38-3硝酸咪康唑阴道软胶囊Miconazole Nitrate Vaginal Soft Capsules/Gyno-Daktarin(达克宁)0.4gJanssen-Cilag N.V.国内上市的原研药品原研进口38-4硝酸咪康唑阴道软胶囊Miconazole Nitrate Vaginal Soft Capsules/Gyno-Daktarin(达克宁)1.2gJanssen-Cilag N.V.国内上市的原研药品原研进口38-5丁丙诺啡纳洛酮舌下片Buprenorphine Hydrochloride and Naloxone Hydrochloride Sublingual Tablets 丁丙诺啡2mg/纳洛酮0.5mg(均以碱基计)Indivior UK Limited国内上市的原研药品原研进口38-6丁丙诺啡纳洛酮舌下片Buprenorphine Hydrochloride and Naloxone Hydrochloride Sublingual Tablets 丁丙诺啡8mg/纳洛酮2mg(均以碱基计)Indivior UK Limited国内上市的原研药品原研进口38-7羧甲基纤维素钠滴眼液Carboxymethylcellulose Sodium Eye Drops0.4ml:2mgAllergan Pharmaceuticals Ireland国内上市的原研药品原研进口38-8复方倍他米松注射液Compound Betamethasone Injection/得宝松1ml:二丙酸倍他米松(以倍他米松计)5mg与倍他米松磷酸钠(以倍他米松计)2mg MSD Merck Sharp & Dohme AG国内上市的原研药品原研进口38-9注射用全氟丁烷微球Perflubutane Microspheres for Injection/Sonazoid(示卓安)每瓶中含微球的体积为16μlGE Healthcare AS国内上市的原研药品原研进口38-10索磷维伏片Sofosbuvir,Velpatasvir and Voxilaprevir tablets/Vosevi(沃士韦)每片含 400mg 索磷布韦、100mg 维帕他韦和 100mg 伏西瑞韦Gilead Sciences Ireland UC国内上市的原研药品原研进口38-11复合维生素片Vitamin Complex Tablets/ Elevit Pronatal(爱乐维)复方制剂Bayer S.A.国内上市的原研药品原研进口38-12盐酸奥洛他定鼻喷雾剂Olopatadine Hydrochloride Nasal Spray/Patanase0.665mg/sprayNovartis Pharmaceuticals Corp未进口原研药品美国橙皮书38-13盐酸环丙沙星滴眼液Ciprofloxacin Ophthalmic Solution/Ciloxan0.30%Novartis Pharmaceuticals Corp未进口原研药品美国橙皮书38-14硫酸麻黄碱注射液Ephedrine Sulfate Injection/Akovaz50mg/mlExela Pharma Sciences LLC未进口原研药品美国橙皮书38-15艾考糊精腹膜透析液Icodextrin Peritoneal Dialysis Solution/Extraneal 含7.5%艾考糊精(2L/袋、2.5L/袋)Baxter Healthcare Corporation未进口原研药品美国橙皮书38-16艾考糊精腹膜透析液Icodextrin Peritoneal Dialysis Solution/Extraneal 含7.5%艾考糊精(1.5L/袋、2L/袋、2.5L/袋)Baxter A/S未进口原研药品欧盟上市38-17氨基酸(15)腹膜透析液Amino Acids (15) Peritoneal Dialysis Solution 2.0LBaxter Healthcare Ltd.未进口原研药品欧盟上市38-18氨基酸(15)腹膜透析液Amino Acids (15) Peritoneal Dialysis Solution 2.5LBaxter Healthcare Ltd.未进口原研药品欧盟上市38-19麦芽酚铁胶囊Ferric Maltol Capsules /Feraccru每片含铁30mgNorgine B.V.未进口原研药品欧盟上市38-20氯甲西泮注射液Lormetazepam Injection/ Sedalam10ml:2mgDr. Franz K?hler Chemie GmbH未进口原研药品欧盟上市38-21硝酸异康唑阴道片Isoconazole Nitrate Vaginal Tablets300mgバイエル薬品株式会社未进口原研药品日本上市38-22盐酸头孢卡品酯片Cefcapene Pivoxil Hydrochloride Tablet/Flomox 100mg塩野義製薬株式会社未进口原研药品日本上市38-23氧氟沙星滴耳液Ofloxacin Ear Drops0.30%アルフレッサファーマ株式会社/第一三共株式会社未进口原研药品日本上市38-24氟骨化三醇片Falecalcitriol Tablets/Fulstan0.15μg大日本住友製薬株式会社未进口原研药品日本上市38-25氟骨化三醇片Falecalcitriol Tablets/Fulstan0.3μg大日本住友製薬株式会社未进口原研药品日本上市38-26注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 10mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-27注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 20mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-28注射用盐酸吡柔比星Pirarubicin Hydrochloride for Injection/Pinorubin 30mg日本マイクロバイオファーマ株式会社未进口原研药品日本上市38-29注射用盐酸多柔比星Doxorubicin Hydrochloride for Injection /Adriacin 10mgアスペンジャパン株式会社未进口原研药品日本上市38-30美沙拉秦缓释颗粒Mesalazine Sustained-release Granules /Pentasa 1g,按美沙拉秦(C7H7NO3)计Ferring S.A.S未进口原研药品法国上市38-31美沙拉秦缓释颗粒Mesalazine Sustained-release Granules /Pentasa 2g,按美沙拉秦(C7H7NO3)计Ferring S.A.S未进口原研药品法国上市38-32富马酸伏诺拉生片Vonoprazan Fumarate Tablets /Vocinti(沃克)10mgTakeda Pharmaceutical Company Limited国内上市的原研药品原研进口38-33富马酸伏诺拉生片Vonoprazan Fumarate Tablets /Vocinti(沃克)20mgTakeda Pharmaceutical Company Limited国内上市的原研药品原研进口38-34碳酸镧颗粒Lanthanum Carbonate Oral Powder/ Fosrenol 1000mgShire Development LLC/Takeda Pharmmaceuticals USA INC 未进口原研药品美国橙皮书38-35尼莫地平口服溶液Nimodipine Oral Solution / Nymalize6mg/mlArbor Pharmaceuticals, LLC未进口原研药品美国橙皮书38-36氟尿嘧啶注射液Fluorouracil Injection/ Fluorouracil500mg/10mlAccord Healthcare, Inc国际公认的同种药品美国橙皮书38-37小儿复方氨基酸注射液(19AA-Ⅰ)10% Amino Acid Injection /Trophamine 10%10%(500ml)B Braun Medical Inc未进口原研药品美国橙皮书38-38氯化钾缓释片Potassium Chloride Extended Release Tablets/K-Tab20mEq(相当于1.5g氯化钾)Abbvie Inc未进口原研药品美国橙皮书38-39盐酸吡格列酮片Pioglitazone Hydrochloride Tablets/Actos45mgTakeda Pharmaceuticals USA Inc未进口原研药品美国橙皮书38-40盐酸丁螺环酮片Buspirone Hydrochloride Tablet15mgTeva Pharmaceuticals USA Inc.国际公认的同种药品美国橙皮书38-41盐酸罗匹尼罗缓释片Ropinirole Hydrochloride Sustained-release Tablets 8mgGLAXO SMITHKLINE/SmithKline Beecham Limited未进口原研药品欧盟上市38-42亚叶酸钙注射液Calcium Folinate Injection5ml:50mgHospira UK Ltd未进口原研药品欧盟上市38-43苯磺酸氨氯地平片Amlodipine Besylate Tablets10mg(以C20H25CLN2O5计)Pfizer未进口原研药品欧盟上市38-44甲氨蝶呤注射液Methotrexate Injection2ml:50mgPfizer Pharma Pfe GmbH未进口原研药品欧盟上市38-45多西他赛注射液Docetaxel Injection/Taxotere20mg/1mlSanofi Mature IP未进口原研药品欧盟上市38-46盐酸罗哌卡因注射液Ropivacaine Hydrochloride Injection/Naropin/Naropeine/Naropina20mg/10mlAspen Pharma Trading Limited未进口原研药品欧盟上市38-47盐酸坦索罗辛口崩缓释片Tamsulosin Hydrochloride Oral Dispersible Sustained Release Tablets0.2mgAstellas Pharma Inc/アステラス製薬株式会社未进口原研药品日本上市38-48钆特醇注射液Gadoteridol Injection/ ProHance10ml:2.793gブラッコスイス株式会社未进口原研药品日本上市38-49钆特醇注射液Gadoteridol Injection/ ProHance15ml:4.1895gブラッコスイス株式会社未进口原研药品日本上市38-50注射用头孢他啶Ceftazidime For Injection/Modacin1.0gグラクソ?スミスクライン株式会社未进口原研药品日本上市38-51注射用氨曲南Aztreonam For Injection1.0g日本エーザイ株式会社未进口原研药品日本上市5-19卡托普利片Captopril Tablets/Captopril12.5mgDaiichi Sankyo Espha Co., Ltd./アルフレッサファーマ株式会社日本橙皮书增加持证商アルフレッサファーマ株式会社5-20卡托普利片Captopril Tablets/Captopril25mgDaiichi Sankyo Espha Co., Ltd./アルフレッサファーマ株式会社日本橙皮书增加持证商アルフレッサファーマ株式会社21-102注射用环磷酰胺Cyclophosphamide for Injection/Endoxan(安道生)1gBaxter Oncology GmbH/Baxter Healthcare Ltd国内上市的原研药品增加持证商Baxter Healthcare Ltd23-48阿普司特片Apremilast Tablet /Otezla10mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc23-49阿普司特片Apremilast Tablet /Otezla20mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc27-412阿普司特片Apremilast Tablet /Otezla30mgCelgene Corp/Amgen Inc未进口原研药品增加持证商Amgen Inc27-372苯磺酸氨氯地平片Amlodipine Besylate Tablets5mg(以C20H25CLN2O5计)Pfizer Luxembourg Sarl/Pfizer Limited/Pfizer未进口原研药品增加持证商Pfizer Luxembourg Sarl/Pfizer;不限定商品名8-175盐酸齐拉西酮胶囊Ziprasidone Hydrochloride Capsules/Zeldox20mg(按齐拉西酮计)Pfizer Australia Pty Limited / Pfizer Pharma PFE GmbH原研进口持证商变更,增加变更后持证商Pfizer Pharma PFE GmbH8-225盐酸齐拉西酮胶囊Ziprasidone Hydrochloride Capsules/Zeldox40mg(按齐拉西酮计)Pfizer Australia Pty Limited / Pfizer Pharma PFE GmbH原研进口持证商变更,增加变更后持证商Pfizer Pharma PFE GmbH21-111沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/100ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-112沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/250ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-113沙美特罗替卡松吸入粉雾剂Salmeterol Xinafoate and Fluticasone Propionate Powder for Inhalation/Seretide(舒利迭)50ug/500ug/泡Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入粉雾剂”21-116沙美特罗替卡松吸入气雾剂Salmeterol Xinafoate and Fluticasone Propionate Aerosol/Seretide(舒利迭)25ug/125ug/揿Laboratoire GlaxoSmithKline国内上市的原研药品药品通用名称修订为“沙美特罗替卡松吸入气雾剂”22-122氟维司群注射液Fulvestrant Injection/Faslodex(芙仕得5ml:0.25gAstraZeneca UK Limited/AstraZeneca AB国内上市的原研药品持证商发生变更,增加变更后持证商AstraZeneca AB23-217中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection625mlB. Braun melsungen ag国际公认的同种药品英文名称修订为“Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection”23-218中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection1250mlB. Braun melsungen ag国际公认的同种药品英文名称修订为“Medium and Long Chain Fat Emulsion,Amino Acids(16)and Glucose(36%) Injection”27-326琥珀酸索利那新片Solifenacin Succinate Tablets/Vesicare5mgAstellas Pharma US Inc未进口原研药品更新持证商为Astellas Pharma US Inc27-327琥珀酸索利那新片Solifenacin Succinate Tablets/Vesicare10mgAstellas Pharma US Inc未进口原研药品更新持证商为Astellas Pharma US Inc备注1.未在国内上市品种,需参照原总局2015年第230号公告等的相关要求开展研究,通用名、剂型等经药典委核准后为准。
2023年执业药师之药事管理与法规题库附答案(典型题)单选题(共30题)1、属于濒临灭绝状态,稀有珍贵野生药材物种实行( )。
A.二级保护B.三级保护C.限量出口D.一级保护【答案】 D2、根据《中华人民共和国反不正当竞争法》A.商业贿赂行为B.虚假宣传和虚假交易行为C.混淆行为D.互联网不正当竞争行为【答案】 C3、根据《药品经营质量管理规范》,关于药品经营企业人工作业库房的药品储存和养护的说法,正确的是A.储存药品按种类堆码,同种药品不同批号可以放在一起B.储存药品时按质量状态实行色标管理,合格的药品为绿色,不合格的为红色C.中药材和中药饮片可放置在同一库房D.储存药品库房的相对湿度应控制在30%~70%【答案】 B4、为城镇职工基本医疗保险参保人员提供处方外配服务的零售药店实行A.轮换制B.定点制C.终身制D.责任制【答案】 B5、关于药品零售企业药学服务行为的说法,正确的是A.用药对象为儿童、老人、孕妇、哺乳期妇女、过敏体质、肝肾功能不全和慢性疾病患者等人群的,药学服务人员应当进行重点关注、跟踪随访B.药品零售企业应当在营业场所外开展合理用药、安全用药的科普宣传,防止影响营业场所内的经营活动C.药品零售企业应当安排专职或兼职人员收集、传递药学服务信息D.药品零售企业驻店药学服务人员应当开展“面对面”药学服务,暂不允许通过网络或计算机智能辅助系统向个人消费者提供药学服务【答案】 C6、可作为医疗机构制剂申报的品种是A.溴化钾苯甲酸钠咖啡因合剂B.鱼腥草注射液C.格列本脲黄芪胶囊D.鱼金注射液【答案】 A7、下列属于卫生行政部门的职责的是A.负责检测和管理药品宏观经济B.负责药品价格的监督管理工作C.负责拟定中医药和民族医药事业发展的规划D.负责制订中医药事业的发展规划,制定有关规章和政策【答案】 D8、属于非限制使用级抗菌药物特点的是A.经长期临床应用证明安全.有效,对细菌耐药性影响较小,价格相对较低B.价格相对较高C.价格昂贵D.具有药品不良反应【答案】 A9、药品包装或药品使用说明书上A.生产企业将药品的警示语或忠告语醒目地印制在B.非处方药警示语或忠告语为C.处方药和非处方药D.非处方药【答案】 A10、国务院常务会议通过的《麻醉药品和精神药品管理条例》(国务院令第442号)是A.法律B.行政法规C.地方政府规章D.部门规章【答案】 B11、用药过程中应定期检查血象的内容应列在A.【药物相互作用】B.【不良反应】C.【注意事项】D.【适应症】【答案】 C12、2017年初,某医院召开药事管理与药物治疗学委员会会议和抗菌药物管理工作组审议会议,会议通报了医院合理用药情况,拟定了2017年全院抗菌药物专项整治工作方案,并对院内抗菌药物品种遴选、采购、清退、更换等事宜进行表决。