2010版《中国药典》纯化水检测标准
- 格式:pdf
- 大小:13.23 MB
- 文档页数:4

制药用水水是药物生产中用量大、使用广的一种辅料,用于生产过程及药物制剂的制备。
本版药典中所收载的制药用水,因其使用的范围不同}fu分为饮用水、纯化水、注射用水及灭菌注射用水。
一般应根据各生产工序或使用目的与要求选用适宜的制药用水。
药品生产企业应确保制药用水的质量符合预期用途的要求。
制药用水的原水通常为饮用水。
制药用水的制备从系统设计、材质选择、制备过程、贮存、分配和使用均应符合药品生产质量管理规范的要求。
制水系统应经过验证,并建立口常监控、检测和报告制度,有完善的原始记录备查制药用水系统应定期进行清洗与消毒,消毒可以采用热处理或化学处理等方法。
采用的消毒方法以及化学处理后消毒剂的去除应经过验证。
饮用水为天然水经净化处理所得的水,其质量必须符合现行中华人民共和国国家标准《生活饮用水卫生标准》饮用水可作为药材净制时的漂洗、制药用具的粗洗用水。
除另有规定外,也可作为药材的提取溶剂。
纯化水为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制备的制药用水.不含任何附加剂,其质量应符合二部纯化水项下的规定。
纯化水可作为配制普通药物制剂用的溶剂或试验用水;可作为中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂;口服、外用制剂配制用溶剂或稀释剂;非灭菌制剂用器具的精洗用水.也用作非灭菌制剂所用药材的提取溶剂。
纯化水不得用于注射剂的配制与稀释.纯化水有多种制备方法,应严格监测各生产环节,防止微生物污染,确保使用点的水质。
注射用水为纯化水经蒸馏所得的水,应符合细菌内毒素试验要求.注射用水必须在防止细菌内毒素产生的设计条件下生产、贮藏及分装.其质量应符合注射用水项下的规定.注射用水可作为配制注射剂、滴眼剂等的溶剂或稀释剂及容器的精洗。
为保证注射用水的质量,应减少原水中的细菌内毒素,监控蒸馏法制备注射用水的各生产环节,并防止微生物的污染.应定期清洗与消毒注射用水系统。
注射用水的储存方式和静态储存期限应经过验证确保水质符合质量要求,例如可以在80℃以上保温或70 ℃以上保温循环或4 ℃以下的状态下存放。

水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。

上海贝灵生物科技有限公司GMP管理文件一、目的:建立一个纯化水的质量标准。
二、适用范围:纯化水的质量标准。
三、责任者:质量保证部。
四、正文:1 检验依据《中国兽药典》2010年版一部本品为蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何附加剂。
2. 性状本品为无色的澄清液体;无臭,无味。
3. 检查3.1. 酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得县蓝色。
3.2. 硝酸盐取本品5ml置试管中,于冰浴中放冷,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)] 0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
3.3 亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μg NO2)] 0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。
3.4 氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00003%)3.5 电导率应符合规定(附录89页)。

水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。

附录ⅩⅥ 制 药 用 水水是药物生产中用量最大、使用最广的一种辅料,用于生产过程及药物制剂的制备。
本版药典中所收载的制药用水,因其使用的范围不同而分为饮用水、纯化水、注射用水及灭菌注射用水。
一般应根据各生产工序或使用目的与要求选用适宜的制药用水。
药品生产企业应确保制药用水的质量符合预期用途的要求。
制药用水的原水通常为饮用水,为天然水经净化处理所得的水,其质量必须符合中华人民共和国国家标准GB 5749—85《生活饮用水卫生标准》。
制药用水的制备从生产系统设计、材质选择、制备过程、贮存、分配和使用均应符合药品生产质量管理规范的要求。
制水系统应经过验证,并建立日常监控、检测和报告制度,有完善的原始记录备查,建立微生物限度的警戒限和行动限并进行趋势分析。
贮缸和管道应采用适宜方法(紫外灯管照射、加热灭菌等)定期清洗和灭菌。
建立微生物限度的警戒限和行动限并进行趋势分析。
制药用水系统应定期进行清洗与消毒,消毒可以采用热处理或化学处理等方法。
采用的消毒方法以及化学处理后消毒剂的去除应经过验证。
饮用水 为天然水经净化处理所得的水,其质量必须符合现行中华人民共和国国家标准《生活饮用水卫生标准》饮用水可作为药材净制时的漂洗、制药用具的粗洗用水。
除另有规定外,也可作为药材的提取溶剂。
纯化水为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制备的制药用水。
不含任何附加剂,其质量应符合二部纯化水项下的规定。
纯化水可作为配制普通药物制剂用的溶剂或试验用水;可作为中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂;口服、外用制剂配制用溶剂或稀释剂;非灭菌制剂用器具的精洗用水。
也用作非灭菌制剂所用药材的提取溶剂。
纯化水不得用于注射剂的配制与稀释。
纯化水有多种制备方法,应严格监测各生产环节,防止微生物污染。
,确保使用点的水质。
用作溶剂、稀释剂或精洗用水,一般应临用前制备。
注射用水为纯化水经蒸馏所得的水,应符合细菌内毒素试验要求。

中国药典纯化水检验标准一、酸碱度按照中国药典规定,纯化水的酸碱度应该符合以下要求:pH值在5.0-7.0之间,以保证其符合药典规定的范围。
测试酸碱度的样品应该在使用之前进行取样,并且使用酸碱度试纸进行检测。
二、硝酸盐硝酸盐是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的硝酸盐含量不得超过0.00005%。
测试硝酸盐的样品应该在使用之前进行取样,并且使用硝酸盐试纸进行检测。
三、亚硝酸盐亚硝酸盐也是纯化水中常见的污染物之一,其含量过高会对人体健康产生影响。
因此,中国药典规定纯化水中的亚硝酸盐含量不得超过0.00001%。
测试亚硝酸盐的样品应该在使用之前进行取样,并且使用亚硝酸盐试纸进行检测。
四、氨氨是一种有毒物质,其含量过高会对人体健康产生影响。
因此,中国药典规定纯化水中的氨含量不得超过0.00005%。
测试氨的样品应该在使用之前进行取样,并且使用氨试纸进行检测。
五、氯化物氯化物是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的氯化物含量不得超过0.001%。
测试氯化物的样品应该在使用之前进行取样,并且使用氯化物试纸进行检测。
六、硫酸盐硫酸盐是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的硫酸盐含量不得超过0.001%。
测试硫酸盐的样品应该在使用之前进行取样,并且使用硫酸盐试纸进行检测。
七、钙钙是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的钙含量不得超过0.002%。
测试钙的样品应该在使用之前进行取样,并且使用钙试纸进行检测。
八、镁镁是纯化水中常见的污染物之一,其含量过高会对药品的质量产生影响。
因此,中国药典规定纯化水中的镁含量不得超过0.002%。
测试镁的样品应该在使用之前进行取样,并且使用镁试纸进行检测。

纯化水检验规范1目的:为纯化水日常监测和周期检测制定依据,以便有效控制纯化水质量;2范围:适用于纯化水日常监测和周期检测管理。
3日常监测3.1正常取水时,操作人员观察纯水机电导率、水温、TOC等数据显示,每班记录一次,并依据《中国药典》纯化水相关规定(附件1),判定结果;3.2如果操作过程中出现指标不合格等异常状况,应协同相关技术或负责人员,参阅《使用说明书》等资料,及时处理和维修,难以解决的疑难问题,联系厂家来完成;4周期检测4.1每周检验人员,在正常使用情况下,出水口和蓄水处取样一次,对电导率进行离线检测,并依据《中国药典》纯化水相关规定(附件1),判定结果,出具报告;4.2在经过必要验证确认的前提下,每年至少按照《中国药典》纯化水相关规定(附件1),做一次全项检测,并依据《中国药典》纯化水相关规定(附件1),判定结果,出具报告;附件12010版《中国药典》纯化水质量标准本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【性状】本品为无色的澄清液体;无臭,无味。
【检查】酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5ml置试管中,于水浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
亚硝酸盐取本品10ml,置纳氏管中,对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.75g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ugNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。

纯化水质量标准1.本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
纯化水质量标准性状无色的澄清液体;无臭,无味。
酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释至100ml,再精密量取10ml,加水稀释至100ml,摇匀,即得(每1ml相当)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 于1ugNO3006%)。
亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g (按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇)]0.2ml,加无匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ug NO2亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000 002%)。
氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 003%)。
电导率应符合规定(中国药典2010年版附录Ⅶ S)总有机碳不得过0.5mg/L(中国药典2010年版附录Ⅶ R)易氧化物取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
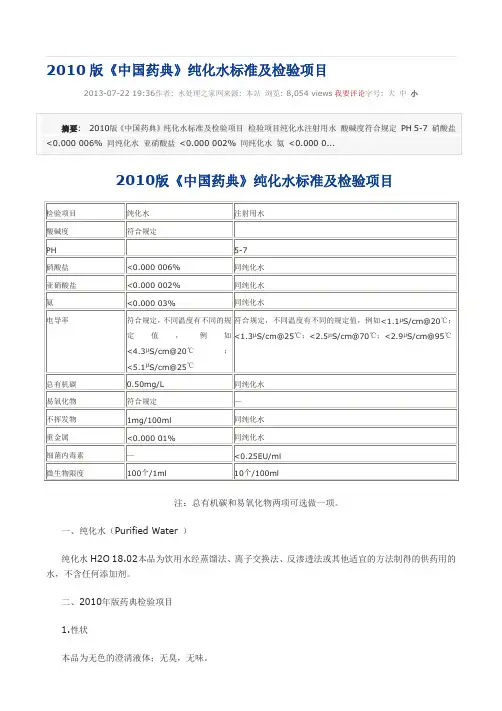
2010版《中国药典》纯化水标准及检验项目2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目1.性状本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。

中国药典纯化水电导率警戒限
摘要:
1.纯化水电导率的概念和重要性
2.中国药典对纯化水电导率的规定
3.纯化水电导率超标的原因和处理方法
4.纯化水电导率检测设备的应用和局限性
5.结论
正文:
一、纯化水电导率的概念和重要性
纯化水电导率是指水中电解质浓度的指标,通常用来衡量水的纯净程度。
在制药行业中,纯化水的电导率是一项非常重要的质量指标,因为它直接影响到制药过程的质量和药品的最终质量。
二、中国药典对纯化水电导率的规定
在我国,制药纯化水的电导率只要符合2010 版《中国药典》里规定的纯化水质量标准即可。
在2010 版药典中对电导率的规定如下(来自科瑞环保资料):10 3.6s/cm, 20 4.3s/cm,25 5.1s/cm。
同时对制药行业用纯化水设备的设计需要符合GMP 认证要求。
三、纯化水电导率超标的原因和处理方法
当纯化水电导率超标时,可能是由于反渗透膜组件的老化造成的脱盐率下降,或者是反渗透膜组件连接密封圈泄露造成的电导率急剧升高。
对于这些情况,可以采取更换新的反渗透膜或更换密封圈等方法进行处理。
四、纯化水电导率检测设备的应用和局限性
纯化水电导率检测设备是制药行业中常用的检测设备,它可以在线监测纯化水电导率的变化,及时发现问题并采取处理措施。
然而,纯化水电导率检测设备也存在一定的局限性,例如它不能检测到突然发生的电导率升高的情况,这时候需要人工进行检测和处理。
五、结论
综上所述,纯化水电导率是衡量制药行业纯化水质量的重要指标,超标的电导率可能会影响制药过程的质量和药品的最终质量。
因此,需要定期检测纯化水电导率,并根据检测结果及时采取处理措施。

纯化水质量标准(总5页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--目的:建立一个规范的纯化水质量标准范围:适用于纯化水质量控制与保证责任人:QA组、QC组内容:1 物料名称:纯化水物料代码:F0072 标准依据《中国药典》2010年版二部3 取样:按工艺用水取样标准操作规程进行取样。
本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
4 检验方法性状:本品为无色的澄明液体;无臭、无味。
检查:酸碱度: 取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐:取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液与%二苯胺硫酸溶液,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)],加无硝酸盐的水,用同一方法处理后的颜色比较,不得更深( 006%)。
亚硝酸盐:取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ugNO2)],加无亚硝酸盐的水,用同一方法处理后的颜色比较,不得更深。
002%)。
氨:取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵,加无氨水适量使溶解并稀释成1000ml),加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深( 03%)。
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次1/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次2/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次3/10
纯化水检验记录REC-(Q-30-007-F)-V06 页次4/10
纯化水检验记录REC-(Q-30-007-F)-V06 页次5/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次6/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次7/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次8/10
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次9/10
学无止境
学无止境
广东惠德勤药业有限公司
纯化水检验记录REC-(Q-30-007-F)-V06 页次10/10。
中国药典纯化水检验标准
中国药典规定了药品生产中所需的各种原辅材料的质量标准,其中包括了纯化
水的检验标准。
纯化水在药品生产中扮演着至关重要的角色,因此其质量标准也显得格外重要。
本文将对中国药典中关于纯化水检验标准的相关内容进行介绍和解读。
首先,中国药典对纯化水的外观要求包括无色、透明、无异物悬浮物等。
这些
要求是基本的质量标准,确保了纯化水的基本清洁度和透明度。
其次,对纯化水的溶解性固体要求不超过0.001%,这也是为了确保纯化水的纯净度。
此外,中国药
典还对纯化水的电导率、氧化还原电位、细菌和内毒素的限度等指标进行了详细的规定,以确保纯化水的化学性质和微生物质量符合药品生产的要求。
在纯化水的检验方法方面,中国药典规定了多种检验方法,包括物理检验、化
学检验和微生物检验等。
这些检验方法的规定和要求,为纯化水的检验提供了具体的操作指南和技术要求,确保了检验结果的准确性和可靠性。
此外,中国药典还对纯化水的包装、存储和运输等环节进行了规定,以确保纯
化水在整个生产和使用过程中的质量稳定性和安全性。
总之,中国药典对纯化水的检验标准进行了全面和严格的规定,这为药品生产
中纯化水的质量控制提供了有力的依据和支持。
遵循中国药典的规定,对纯化水进行严格的检验和控制,将有助于确保药品生产中纯化水的质量稳定和可靠,从而保障药品的质量和安全。
通过本文对中国药典纯化水检验标准的介绍和解读,相信读者对纯化水的质量
标准有了更清晰和全面的了解,这对于药品生产中纯化水的质量控制具有重要的指导意义。
希望本文能够为相关从业人员提供帮助,促进药品生产中纯化水质量的提升和保障。
2010版药典纯化水标准
2010版药典中对纯化水的标准有详细规定。
纯化水是一种用于制药工艺和实验室分析的特殊水质,要求在物理、化学和微生物方面达到一定的纯度标准。
以下是2010版药典对纯化水的一些重要标准:
1. 外观:纯化水应该是透明的,没有悬浮物或沉淀物。
2. pH 值:纯化水的 pH 值应在5.0-7.0之间,以确保其适合药物制剂的使用。
3. 电导率:纯化水的电导率应低于1.3微西门子/厘米,以确保水中的离子浓度较低。
4. 溶解氧:纯化水中的溶解氧应低于0.5毫克/升,以避免氧气对药物的氧化影响。
5. 有机杂质:纯化水中的有机杂质应控制在一定范围内,以避免对药物质量的影响。
6. 无机杂质:纯化水中的无机杂质应控制在一定范围内,以避免对药物质量的影响。
7. 微生物限度:纯化水中的微生物限度应符合一定的标准,以确保水的微生物质量达到要求。
这些标准是为了确保纯化水在制药过程中的质量和安全性,以保证药物的质量和有效性。
药品生产过程中使用符合药典标准的纯化水,可以减少对药品的污染和不良反应的风险。
纯化水質量要求參照《中国药典》2010版二部标准p411页【性状】本品为无色的澄清液体;无臭,无味。
【检查】酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
【硝酸盐】取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
【亚硝酸盐】取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml 与盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。
【氨】取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00003%)。
总有机碳不得过0.50mg/L (附录ⅧR) 。
【易氧化物】取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
以上总有机碳和易氧化物两项可选做一项。
水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。