4.5 氨和铵盐(讲)-2018届一轮讲练测(原卷版)最新修正版
- 格式:doc
- 大小:496.97 KB
- 文档页数:12

1、掌握氨及铵盐的性质及用途、2、掌握NH 4+的检验。
2、掌握氨的实验室制法。
3、初步了解常见化肥。
一、氨 1、物理性质氨气是无色有刺激性气味的气体,密度比空气小,易液化,可作制冷剂,常温、常压下,极易溶于水1体积的水可溶解700体积的氨气,可由喷泉实验证明。
液氨与氨水的区别液氨 氨水 形成 氨气液化 氨气溶于水 物质分类 纯净物混合物微粒种类 NH 3NH 3、NH 3·H 2O 、H +、H 2O 、NH 4+、OH -存在条件常温常压下不能存在常温常压下可存在2、分子结构 电子式: 空间结构: 三角锥形 ,属于极性分子。
3、氨的化学性质 (1)与水的反应 NH 3+H 2ONH 3·H 2ONH +4+OH - 氨气溶于水得氨水,氨水中含有的粒子有: NH 3·H 2O 、NH 3、H 2O 、NH +4、OH -、H +。
氨水为可溶性一元弱碱,易挥发,不稳定,易分解:NH 3·H 2O=====△NH 3↑+H 2O 。
。
(2)氨气与酸反应①蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为 有白烟生成,将浓盐酸改为 浓硝酸,也会出现相同的现象。
化学方程式为:NH 3+HCl===NH 4Cl 、NH 3+HNO 3===NH 4NO 3。
。
②与CO 2等酸性氧化物反应:NH 3+CO 2+H 2O=NH 4HCO 3或2NH 3+CO 2+H 2O=(NH 4)2CO 3 (3)NH 3的还原性 ①氨的催化氧化 化学方程式:4NH 3+5O 2 4NO+6H 2O②与其他氧化剂反应 4NH 3+3O 2(纯氧)=2N 2+6H 2O 4x NH 3+6NO x =(2x +3)N 2+6xH 2O 2NH 3+3CuO=3Cu+N 2+3H 2O 8NH 3+3Cl 2 = N 2+6NH 4Cl (白烟) (4)与盐溶液反应 将氨水加入下列溶液被滴试剂现象 离子方程式FeCl 3溶液 生成红褐色沉淀 Fe 3++3NH 3·H 2O =Fe(OH)3↓+3NH 4+AlCl 3溶液 生成白色沉淀 Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+ AgNO 3溶液先生成白色沉淀后消失Ag ++NH 3·H 2O=AgOH↓+ NH 4+AgOH+2NH 3·H 2O=[Ag(NH 3)2]++OH -+2H 2O4、氨气的实验室制法(1)加热固态铵盐和碱的混合物一般加热NH 4Cl 和Ca(OH)2的混合物:2NH 4Cl+Ca(OH)22NH 3↑+CaCl 2+2H 2O 。
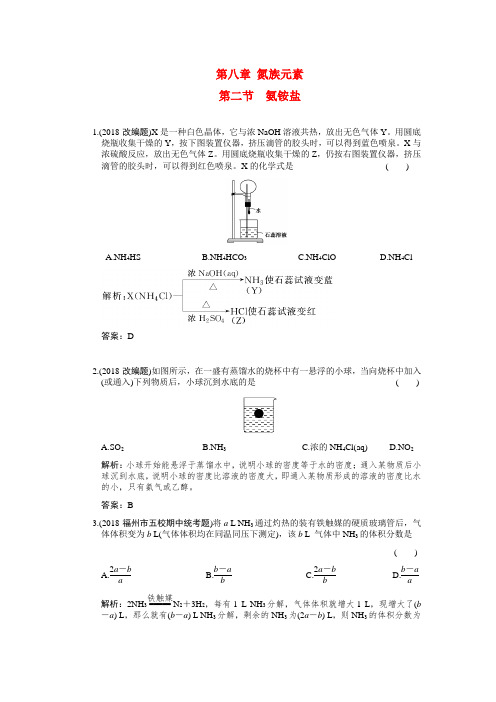
第八章 氮族元素第二节 氨铵盐1.(2018·改编题)X 是一种白色晶体,它与浓NaOH 溶液共热,放出无色气体Y 。
用圆底烧瓶收集干燥的Y ,按下图装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉。
X 与浓硫酸反应,放出无色气体Z 。
用圆底烧瓶收集干燥的Z ,仍按右图装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
X 的化学式是 ( )A.NH 4HSB.NH 4HCO 3C.NH 4ClOD.NH 4Cl答案:D2.(2018·改编题)如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯中加入(或通入)下列物质后,小球沉到水底的是 ( )A.SO 2B.NH 3C.浓的NH 4Cl(aq)D.NO 2 解析:小球开始能悬浮于蒸馏水中,说明小球的密度等于水的密度;通入某物质后小球沉到水底,说明小球的密度比溶液的密度大,即通入某物质形成的溶液的密度比水的小,只有氨气或乙醇。
答案:B3.(2018·福州市五校期中统考题)将a L NH 3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L 气体中NH 3的体积分数是( )A.2a -b aB.b -a bC.2a -b bD.b -a a解析:2NH 3=====铁触媒N 2+3H 2,每有1 L NH 3分解,气体体积就增大1 L ,现增大了(b -a ) L ,那么就有(b -a ) L NH 3分解,剩余的NH 3为(2a -b ) L ,则NH 3的体积分数为2a -b b。
答案:C4.(2018·改编题)下列事实可证明NH 3·H 2O 是弱碱的是 ( )A.氯化铵受热易分解B.氨水可以使酚酞试液变红C.常温下,0.1 mol/L 氯化铵溶液的pH 约为5D.氨水能与氯化亚铁溶液反应生成氢氧化亚铁解析:只要能证明NH 3·H 2O 溶液中存在电离平衡即可说明NH 3·H 2O 是弱电解质。

氨气铵盐一.选择题1.下列关于自然界中氮循环(如下图)的说法不正确的是()A.氮元素均被氧化B.工业合成氨属于人工固氮C.豆科作物的根瘤菌使空气中的氮转化为氨D.碳、氢、氧三种元素也参与了氮循环2.在下列反应中表示NH3既有还原性又有碱性的反应是( )A.NH3+HNO3=NH4NO3B.8NH3+3Cl 2N2↑+6NH4ClC.4NH3+5O 24NO↑+6H2OD.2NH3+3CuO3Cu+N2↑+3H2O3.下列关于氨气的用途叙述不正确的是()A.作制冷剂B.制造硝酸C.制造化肥(硫铵、碳铵、尿素等)D.制造氮气4.用浓氯化铵溶液处理过的舞台幕布不易着火。
其原因是()①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度④氯化铵分解产生的气体隔绝了空气A.①②B.③④C.①③D.②④5下列有关物质用途的叙述中,不正确的是()A.液氨用作制冷剂B.氮气用作保护气C.AgI用于人工降雨D.白磷用于制备磷酸、安全火柴等6.下列关于红磷和白磷的说法正确的是()①红磷没有毒性而白磷剧毒②白磷和红磷都易溶于水③白磷可用于制造安全火柴④少量白磷应保存在水中⑤取用少量白磷时,应用镊子夹取,将其放在玻璃片上,用小刀切取所需白磷⑥干燥的红磷放在空气中变湿,说明红磷易潮解A.只有①④B.②③C.①④⑤D.①②④⑥7.汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。
反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。
下列对该反应过程及产物叙述正确的是()A.NO2起催化剂作用B.NO起催化剂作用C.NO2只起氧化剂作用D.O3与O2为同分异构体8.取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如右图)。
过一会儿,发现纸蝴蝶变为A9我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。

4-5 氨和铵盐(测试时间:45分钟满分 100分)姓名:班级:得分:一、选择题(本题包括10小题,每小题5分,共50分)1.玻璃瓶,紧塞其口,勿使泄气,则药力不减。
气甚辛烈,触人脑,非有病不可嗅;在“刀创水”条目下写到:治金创,以此水涂伤口,即敛合如故。
这里所说的“鼻冲水”、“刀创水”分别指的是()A.氢氟酸、食盐水 B.氨水、碘酒 C.石灰水、硝酸 D.稀硫酸、食醋【答案】B【解析】A、氢氟酸不能放在玻璃瓶中,A错误;B、氨水易挥发,具有刺激性气味,碘酒能杀菌消毒,B正确;C、石灰水没有挥发性,硝酸具有腐蚀性,C错误;D、稀硫酸没有挥发性,D错误,答案选B。
2.从某些性质看:NH3和H2O,NH2-和OH-,N3-和O2-两两相似,据此判断下列反应正确的是()①2Na+2NH3=2NaNH2+H2↑ ②CaO+2NH4Cl △CaCl2+2NH3↑+H2O③3Mg(NH2)2△Mg3N2+4NH3↑ ④NH4Cl+NaNH2△NaCl+2NH3↑A.③ B.② C.②③ D.①②③④【答案】D【解析】①NH3和H2O相当,可以依据2Na+2H2O=2NaOH+H2↑,类推得到反应为:2Na+2NH3=2NaNH2+H2↑,正确;②NH2-和OH-相当,依据CaO+2HCl=CaCl2 +H2O;类推得到反应:CaO+2NH4Cl △CaCl2+2NH3↑+H2O,正确;③NH2-和OH-相当,N3-和O2-两两相当,依据Mg(OH)2 =MgO+H2O,类推得到:3Mg (NH2)2△Mg3N2+4 NH3↑,正确;④NH2-和OH-相当,NH3和H2O相当,依据NH4Cl+NaOH=NaCl+ NH3+H2O;类推得到:NH4Cl+NaNH2△NaCl+2NH3,正确。
3.为了检验某固体物质中是否含有NH4+,你认为下列试纸和试剂一定用不到的是()①蒸馏水②NaOH溶液③红色石蕊试纸④蓝色石蕊试纸⑤稀硫酸A.①⑤ B.④⑤ C.①③ D.①④⑤【答案】B【解析】为了检验某固体物质中是否含有NH4+,可以向固体中加入NaOH溶液,并加热,将产生的气体用湿润的红色石蕊试纸检验,若试纸变为蓝色,就证明该气体是NH3,原固体中含有NH4+,因此一定用不到的物质是④蓝色石蕊试纸、⑤稀硫酸,答案选B。

第四章第6节氨和铵盐(课时活页卷)一、单项选择题1.氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法不正确的是( ) A.用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质B.实验室可采用如图所示装置制取NH3C.实验室可用CCl4检验NO2和溴蒸气D.在常温下,稀硝酸的氧化性强于浓硫酸的【答案】 B【解析】含有苯环的蛋白质遇浓硝酸显黄色,此反应常用于检验蛋白质,A正确。
NH4Cl 分解生成的HCl和NH3遇冷又生成NH4Cl(在试管中凝结),B错。
NO2不溶于CCl4,Br2易溶于CCl4,根据CCl4层的颜色可区分红棕色气体是NO2或是Br2,C正确。
在常温下,稀硝酸能氧化铜,而浓硫酸不能氧化铜,由此可推出稀硝酸的氧化性强于浓硫酸,D正确。
2.(2013.广东惠州一中月考)科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。
下列有关说法不正确的是( )A.液氨作为清洁能源的反应原理是4NH3+5O2=====催化剂△4NO+6H2OB.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏C.氨气比空气轻,标准状况下密度约为0.76 g·L-1D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全【答案】 A【解析】A项,该反应中有污染性气体NO产生,故不符合清洁能源的要求,错误。
B、D项均正确。
C项,氨气在标准状况下的密度ρ标=MV m =17 g·mol-122.4 L·mol-1=0.76 g·L-1,正确。
3.NO、NO2均可与NH3反应转化为无害的N2和H2O,现有3.0 L NO、NO2的混合气体,当耗用3.0 L NH3时,可全部转化为N2和H2O,则NO与NO2的体积之比为(体积均为同温同压下测定)( )A.1∶1B.1∶2C .1∶3D .任意比【答案】 A【解析】 由得失电子守恒,求得混合气体中NO 、NO 2各1.5 L ,故二者体积比为1∶1。

课时规范练18一、选择题:每小题只有1个选项符合题意。
1.(2023江苏苏锡常镇四市调研)下列有关氮及其化合物的性质与用途具有对应关系的是( )A.N2难溶于水,可用作粮食保护气B.氨水具有碱性,可用于去除烟气中的SO2C.NO2具有还原性,与N2H4混合可用作火箭推进剂D.HNO3具有氧化性,可用于生产氮肥NH4NO3答案:B解析:氮气用作粮食保护气是因为氮气的化学性质稳定,与氮气的溶解性无关,A错误;氨水呈碱性,可与酸性氧化物反应,故可用于除去烟气中的SO2,B正确;NO2具有氧化性,与N2H4混合反应生成氮气并放热,体现的是NO2的氧化性,C错误;HNO3具有氧化性,但用硝酸与氨气反应生产氮肥NH4NO3体现的是硝酸的酸性,D错误。
2.(2023河北邯郸六校联考)一支盛有20 mL NO和NO2混合气体的试管倒置于盛有水的水槽中,充分反应后,仍有12 mL无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)( )A.2∶3B.3∶2C.1∶4D.4∶1答案:A解析:NO2与水反应生成HNO3和NO,NO与水不反应,则最终剩余的气体为NO。
设混合气体中二氧化氮的体积为V,则:3NO2+H2O2HNO3+NO 气体体积减少的量3 1 2V20mL-12mL=8mL则有V==12mL,即NO2的体积为12mL。
原混合气体中NO的体积为20mL-12mL=8mL,则原混合气体中NO和NO2体积比为8mL∶12mL=2∶3。
3.氨既是一种重要的化工产品,又是一种重要的化工原料。
下图为合成氨以及氨催化氧化制硝酸的流程示意图。
下列说法不正确的是( )A.可以利用NH3易液化的性质分离出NH3B.吸收塔中通入A是为了提高原料的利用率C.可以用NH3进行氮氧化物的尾气处理D.合成氨以及氨催化氧化制硝酸的流程中氮元素均被氧化答案:D解析:可利用NH3易液化的性质分离NH3,A正确;A为O2,NH3的催化氧化需要O2,NO转化为NO2需要O2,故吸收塔中通入O2是为了提高原料的利用率,B正确;NH3可与NO x发生价态归中的反应生成N2和H2O,从而消除污染,C正确;合成氨反应中N元素化合价降低,则氮元素被还原,D错误。
第五讲 氨和铵盐(测试时间60分钟,满分100分)姓名: 班级: 得分:一、选择题(本题包括10小题,每小题5分,共50分)1.【2015-2016学年辽宁葫芦岛一中等五校高二6月联考】为了检验某固体物质中是否含有NH 4+,你认为下列试纸和试剂一定用不到的是 ( )①蒸馏水 ②NaOH 溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸A .①⑤B .④⑤C .①③D .①④⑤2.把aL 含硫酸铵、硝酸铵的溶液分成两等份,一份用b mol 烧碱刚好把NH +4转化为NH 3,另一份与氯化钡溶液完全反应消耗 c mol BaCl 2。
则原溶液中NO-3的浓度为( ) A .L mol a c b /2- B .L mol ac b /42- C .L mol a c b /2- D .L mol a a b /4- 3.【2015-2016学年湖南省衡阳一中下第一次月考】下列叙述不正确...的是 ( )A .NH 3的喷泉实验说明氨气极易溶于水B .NH 3遇到挥发性强酸就能冒白烟C .盛液溴的瓶内加少量水可防止液溴的挥发D .NO 和NH 3均可用排空气法收集4.【江苏省南通市2016届高三第一次模拟考试】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不.正确的是 ( )A .将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B .将pH=11的氨水稀释1000倍,测得pH > 8,说明NH 3·H 2O 为弱碱C .加热NH 4HCO 3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH 4HCO 3受热不稳定丝D.将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO25.化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。
下列有关说法正确的是()A.该合成中所有的电能和热能全部转化为化学能B.该合成氨过程不属于氮的固定C.空气、水、太阳能均为可再生资源D.断裂N2中的N≡N键会释放出能量6.【2016届广东省东莞市实验高三上学期第四次月考】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为()A.NH3、NO2、N2B.NH3、NO、CO2C.NH3、NO2、CO2D.NO、CO2、N2 7.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为()A.①>②B.①<②C.①=②D.不能确定8.工业废气中的氮氧化物(如NO、NO2等,用通式NO x表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NO x+NH3―→N2+H2O来消除污染.有关此反应,下列说法中错误的是()A.N2既是氧化产物又是还原产物B.当x=1时,每生成2.5 mol N2,被氧化的气体有3 molC.当x=2时,有1 mol气体被还原,转移电子4 molD.反应通式配平表示为:6NO x+4x NH3===(3+2x)N2+6x H2O9.【2016届山东省菏泽市高三上学期期末】NO2、NH3和O2组成的混合气体,在一定条件下恰好完全反应,生成N2和H2O,则原混合气体中NO2、NH3和O2的体积比可能是(不考虑NO2与N2O4之间的转化)()A.2:4:1 B.2:1:2 C.1:1:1 D.1:4:310.如下图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是()A.甲:2;乙:稀盐酸B.甲:水;乙:氢氧化钠溶液C.甲:氢氧化钠溶液;乙:水D.甲:稀盐酸;乙:氯化钠溶液二、非选择题(4小题,共50分)11.(14分)【2016届山东省烟台市高三上学期期末】氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用。
第23讲 氨 铵盐[复习目标] 1.能从结构的角度分析 NH 3的性质。
2.掌握氨的实验室制法及喷泉实验。
3.知道铵盐的性质与NH +4的检验方法。
考点一 氨1.氨的结构特征2.氨的物理性质无色、有刺激性气味的气体,密度比空气的小,易液化,液氨可作制冷剂,极易溶于水(1∶700),可由喷泉实验证明。
思考 试从结构和性质上解释NH 3极易溶于水的原因。
提示 NH 3、H 2O 均为极性分子,NH 3与H 2O 之间可形成分子间氢键,并且NH 3和H 2O 反应。
3.氨的化学性质(1)较稳定:N 的非金属性强,N —H 的键能大,因而NH 3比较稳定。
(2)(3)较强的配位能力Cu(OH)2溶于氨水:Cu(OH)2+4NH 3===[Cu(NH 3)4]2++2OH -。
(4)还原性催化氧化:4NH 3+5O 2=====催化剂△4NO +6H 2O 。
1.向AlCl 3溶液中逐滴加入过量的氨水,先产生白色沉淀,最后白色沉淀溶解( )2.氨溶于水显弱碱性是因为氨气分子能电离出OH -( )3.氨极易溶于水,因此氨水比较稳定(不容易分解)( )4.氨水和液氨不同,氨水是混合物,液氨是纯净物( )5.氨水中物质的量浓度最大的粒子是NH 3·H 2O(水除外)( )6.氨水显弱碱性,是弱电解质( )7.现有1 mol·L -1的氨水,则该溶液中NH 3·H 2O 的浓度是1 mol·L -1( )答案 1.× 2.× 3.× 4.√ 5.√ 6.× 7.×一、氨的还原性1.依据信息完成下列反应的化学方程式。
(1)在加热条件下,氨气容易被氧化铜氧化生成氮气:__________________________________。
(2)工业上常用浓氨水检验输送氯气的管道是否泄露,Cl 2能将NH 3氧化为N 2,同时产生白烟。
高考化学第一轮复习课时练:第15讲氨和铵盐一、单项选择题1.(海淀区期末)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。
下列叙述与氮元素的循环无关的是()A.工业合成氨的过程是固氮的过程B.自然界中,氨是动物体特别是蛋白质腐败后的产物C.为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气D.电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收解析:本题考查氮气的性质及氮的固定。
氮的固定是指游离态的氮元素转化为化合态的氮元素的过程;蛋白质腐败后可产生氮气;由于N2很不活泼,故可作为保护气,不参与化学反应,也无循环可言。
答案:C2.(沈阳模拟)如图利用培养皿探究氨气的性质。
实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
下表中对实验现象所做的解释正确的是()选项实验现象解释A浓盐酸附近产生白烟NH3与浓盐酸反应生成了NH4Cl固体浓硫酸附近无明显现象NH3与浓硫酸不发生反应C氯化物溶液变浑浊该溶液一定是AlCl3溶液D 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝NH3是一种可溶性碱243错;C项也可能是MgCl2溶液;NH3本身不能电离出OH-,因此NH3不是碱,NH3·H2O才是碱。
答案:A3.通常情况下,下列各组物质能够共存且能用碱石灰或浓硫酸来干燥的气体是()A.NH3、N2、H2B.HCl、NH3、CO2C.H2、O2、N2D.SO2、H2S、O2解析:HCl与NH3、SO2与H2S不能共存,排除B、D;NH3不能用浓硫酸干燥,排除A,只有C项符合题意。
答案:C4.已知24%的氨水的密度为0.91 g/mL,12%的氨水的密度为0.95 g/mL。
现将100 g 24%的氨水与100 g水混合,下列对所得溶液的判断不正确的是()A.所得溶液的质量为200 gB.所得溶液的质量分数为12%C.所得溶液的体积大于原两种溶液的体积之和D.所得溶液的体积小于原两种溶液的体积之和解析:m(aq)=100 g+100 g=200 g,混合后所得溶液的质量分数w=24%×100 g-1=210.5 mL,V1+V2=100 mL+100 g+100 g=12%,V(aq)=200 g/0.95 g·mL100 g/0.91 g·mL-1=209.9 mL<210.5 mL。
1、掌握氨及铵盐的性质及用途、2、掌握NH4+的检验。
2、掌握氨的实验室制法。
3、初步了解常见化肥。
一、氨1、物理性质氨气是无色有刺激性气味的气体,密度比空气小,易液化,可作制冷剂,常温、常压下,极易溶于水1体积的水可溶解700体积的氨气,可由喷泉实验证明。
液氨与氨水的区别2、分子结构电子式:空间结构:三角锥形,属于极性分子。
3、氨的化学性质(1)与水的反应+OH-NH 3+H2O NH3·H2O NH+4氨气溶于水得氨水,氨水中含有的粒子有: NH 3·H 2O 、NH 3、H 2O 、NH +4 、OH -、H +。
氨水为可溶性一元弱碱,易挥发,不稳定,易分解:NH 3·H 2O=====△NH 3↑+H 2O 。
。
(2)氨气与酸反应①蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为 有白烟生成,将浓盐酸改为 浓硝酸,也会出现相同的现象。
化学方程式为:NH 3+HCl===NH 4Cl 、NH 3+HNO 3===NH 4NO 3。
。
②与CO 2等酸性氧化物反应:NH 3+CO 2+H 2O=NH 4HCO 3或2NH 3+CO 2+H 2O=(NH 4)2CO 3 (3)NH 3的还原性 ①氨的催化氧化 化学方程式:4NH 3+5O 24NO+6H 2O②与其他氧化剂反应4NH 3+3O 2(纯氧)=2N 2+6H 2O 4x NH 3+6NO x =(2x +3)N 2+6xH 2O 2NH 3+3CuO=3Cu+N 2+3H 2O 8NH 3+3Cl 2 = N 2+6NH 4Cl (白烟) (4)与盐溶液反应 将氨水加入下列溶液4、氨气的实验室制法(1)加热固态铵盐和碱的混合物一般加热NH 4Cl 和Ca(OH)2的混合物: 2NH 4Cl+Ca(OH)22NH 3↑+CaCl 2+2H 2O 。
①装置:“固体+固体→气体”(与用KClO 3或KMnO 4制O 2的装置相同)。
②收集:只能用向下排空气法。
③干燥:用碱石灰(NaOH 和CaO 固体的混合物)。
④验满方法:a 、用湿润的红色石蕊试纸置于试管口,试纸变蓝色; b 、将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
⑤环保措施:收集时,一般在管口塞一团用水或稀H 2SO 4浸湿的棉花球,可减小NH 3与空气的对流速度,收集到纯净的NH 3,同时也可避免污染空气。
(2)加热浓氨水①反应原理:NH 3·H 2O===NH 3↑+H 2O 。
②装置如图1(3)浓氨水中加固态碱性物质 ①反应原理:浓氨水中存在以下平衡:NH 3+H 2ONH 3·H 2ONH +4 +OH -,加入固态碱性物质,(如CaO 、NaOH 、碱石灰等),使平衡逆向移动,同时反应放热,促进NH 3·H 2O 的分解。
②装置如图2(4)氨气实验室制法的注意事项图1 图2①实验室用固体铵盐与碱共热制NH3时,不能使用NH4HCO3、NH4NO3及NaOH固体,因为NH4HCO3受热分解产生CO2,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。
②吸收氨气(或HCl)时要注意防止倒吸。
可用于吸收氨气(或HCl)并能防倒吸的常用装置为:③氨是碱性气体,不能用酸性干燥剂(浓硫酸、P2O5)干燥,也不能用CaCl2干燥,因为CaCl2可以吸收NH3。
5、工业制法N2+3H22NH3反应条件:温度400~500_℃,压强20~50 MPa,催化剂铁触媒。
【特别提醒】(1)氨是中学阶段所学的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,利用这一点,可以在推断题中作为解题的突破口。
(2)氨水中含有三种分子(H2O、NH3·H2O、NH3)和三种离子(OH-、NH+4、H+),其中含量最多的是NH3·H2O,但计算其物质的量浓度和溶质质量分数时,氨水的溶质以NH3代替。
(3)氨水中存在平衡:NH 3+H2O NH3·H2O NH+4+OH-。
生成的一水合氨(NH3·H2O)是一种弱碱,很不稳定,受热会分解:NH3·H2O NH3↑+H2O。
当氨水作反应物时,在离子方程式中用分子式表示。
【典型例题1】【福建省福州第一中学2017届高三下学期模考4】在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。
反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。
下列有关说法错误的是()A.反应后溶液中含有NO3-B.反应后溶液中c(H+)增大C.实验过程中有化合反应发生【点评】本题考查了元素化合物知识,涉及了氨气、一氧化氮、二氧化氮及硝酸的性质,明确各物质的性质、熟悉氨的催化氧化是解题关键,易错点是反应放热,导致溶液温度升高,电离常数变化。
【迁移训练1】【江苏省苏锡常镇四市2017年高三教学情况调研(一)】下列装置用于实验室制备氨气并配制银氨溶液,不能达到实验目的的是 ( )A .检查气密性B .制备氨气C .吸收氨尾气D .配制银氨溶液二、铵盐及NH +4 的检验 1、铵盐的概念铵离子与酸根离子构成的化合物。
2、铵盐的物理性质铵盐都是白色固体,均易溶于水。
3、铵盐的化学性质 (1)受热易分解NH 4Cl=====△NH 3↑+HCl (2)与碱反应①NH +4 +OH -=====△ NH 3↑+H 2O②在稀溶液中不加热:NH +4 +OH -=NH 3·H 2O ③在浓溶液中不加热:NH +4 +OH -= NH 3↑+H 2O(3)水解反应: NH +4 +H 2ONH 3·H 2O+H +4. NH +4 的检验未知液————→OH -呈碱性————→Δ湿润红色石蕊试纸变蓝色,则证明含NH +4 。
【特别提醒】(1)不能用直接加热铵盐法制取氨。
如加热过程中NH 4NO 3可能发生爆炸而有危险;NH 4HCO 3受热极易分解产生CO 2,使生成的NH 3中混有较多的CO 2杂质;NH 4Cl 受热分解生成的HCl 和NH 3遇冷后立即化合又生成NH 4Cl ,阻塞导气管。
(2)铵盐分解不一定产生NH 3,如NH 4NO 3受热分解可能生成N 2、HNO 3和H 2O 。
(3)铵盐遇碱性物质能发生反应产生氨,因此铵态氮肥不宜和碱性物质混合施用。
【典型例题2】【2017届西藏山南二中高三上11月月考】试管中盛有少量白色固体,可能是铵盐,检验的方法是 ( )A .加水,将湿润的红色石蕊试纸放在试管口B .加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口C .加氢氧化钠溶液,加热,滴入酚酞试液D .加氢氧化钠溶液,加热,滴入石蕊试液【点评】本题考查铵盐的检验方法,注意氨气是中学阶段唯一的一种碱性气体,可以据此来检验,方法为:将白色固体放入试管中,加氢氧化钠溶液,加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,证明该盐中含有铵根离子,白色固体是铵盐。
【迁移训练2】【2017届山东省栖霞市高三上学期期中】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是 ( )A .将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B .将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性C .加热NH 4HCO 3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH 4HCO 3受热不稳定D.将红热的pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氧气的直接氧化产物为NO2考点一:喷泉实验中学教材中喷泉实验装置如图所示。
实验操作是:打开橡皮管上的夹子,挤压滴管的胶头,则烧杯中的水由玻璃管进入烧瓶,形成喷泉。
1、喷泉形成的原理因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,容器内外存在较大的压强差,在这种压强差的作用下,将烧杯中的水压入烧瓶而形成喷泉。
2、使容器内外产生较大的压强差的方法(1)减小容器内压强①容器内气体极易溶于水;②容器内气体易与溶液中的溶质发生化学反应而被吸收。
当外部的水或溶液接触容器内气体时,由于气体大量溶解或与溶液中的溶质发生化学反应而被吸收,从而使容器内气压迅速降低,在外界大气压作用下,外部液体迅速进入容器,通过尖嘴导管喷出,形成喷泉。
(2)增大容器内压强容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或由于发生化学反应,容器内产生大量气体。
使容器内压强迅速增大,促使容器内液体迅速向外流动,也能形成喷泉。
例如喷雾器、人造喷泉等均是利用了此原理。
3、中学化学中常见的能形成喷泉实验的气体和吸收剂4、喷泉实验成败的关键(1)装置气密性要好;(2)烧瓶要干燥;(3)气体的纯度要高。
5、引发喷泉的方法①使烧瓶内的气体迅速溶于水或某种液体中。
②使烧瓶内气体温度降低,使气压减小。
③使烧瓶外待喷液面上的气压增大。
6、喷泉实验的装置喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来使喷泉产生。
装置Ⅱ:挤压气球,即可使少量的溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。
装置Ⅲ:去掉了胶头滴管。
打开止水夹,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。
(开放性问题,或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)装置Ⅳ:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置Ⅴ:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置Ⅵ:烧瓶中通入H2S(或SO2),然后通入SO2(或H2S),现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
【典型例题3】某同学准备利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z 液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是 ( )【点评】喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来使喷泉产生。
【迁移训练3】喷泉是一种常见的自然现象,其产生原因是存在压强差。
(1)图甲中,为化学教学中所用的喷泉实验装置。
在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。
下列组合中不可能形成喷泉的是( )A .HCl 和H 2OB .O 2和H 2OC .NH 3和H 2OD .CO 2和NaOH 溶液(2)某学生积极思考产生喷泉的其他办法,并设 计了如图乙所示的装置。