嘌呤霉素筛选程序
- 格式:doc
- 大小:16.54 KB
- 文档页数:2

说明:蛋白质合成抑制剂。
抑制细菌、藻类原生物和哺乳动物细胞生长。
嘌呤霉素(Puromycin)是由白黑链霉菌(Streptomyces alboniger)发酵代谢产生的一种氨基糖苷类抗生素,通过抑制蛋白质合成而杀死革兰氏阳性菌,各种动物和昆虫细胞。
某种特殊情况下有效作用大肠杆菌。
作用机制在于嘌呤霉素是氨酰-tRNA分子3’末端的类似物,能够与核糖体的A位点结合并掺入到延伸的肽链中。
嘌呤霉素同A位点结合后,不会参与随后的任何反应,从而导致蛋白质合成的提前终止并释放出C-末端含有嘌呤霉素的不成熟多肽。
嘌呤霉素产生菌Streptomyces alboniger内发现的pac基因编码嘌呤霉素N-乙酰转移酶(PAC),赋予机体对嘌呤霉素产生抗性。
这一特性如今普遍应用于筛选特定携带pac基因质粒的哺乳动物稳定转染细胞株。
嘌呤霉素在细胞稳转株筛选中的普遍应用与慢病毒载体的特性有关,现在商业化的慢病毒载体多数都携带pac基因。
在某些特定情况下,嘌呤霉素亦可以用来筛选转化携带pac基因质粒的大肠杆菌菌株。
溶解性:溶于水,参考浓度50mg/ml。
使用方法1.建议使用浓度哺乳动物细胞:1-10 μg/mL,最佳浓度需要杀灭曲线来确定;大肠杆菌:LB琼脂培养基筛选稳定转化pac基因的大肠杆菌,使用浓度为125μg/mL。
注:使用嘌呤霉素筛选大肠杆菌稳转株需要精确的pH值调节,而且受宿主细胞本身的影响。
2.溶解方法用蒸馏水溶解嘌呤霉素配制成50 mg/ml的母液,经0.22 μm滤膜过滤除菌后分装于-20℃冻存;也可溶于甲醇,配制成10 mg/ml的储存液。
3. 嘌呤霉素杀灭曲线的确定(以shRNA转染或者慢病毒转导为例)嘌呤霉素有效筛选浓度跟细胞类型、生长状态、细胞密度、细胞代谢情况及细胞所处细胞周期位置等有关。
为了筛选到稳定表达的shRNA细胞株,确定杀死未转染/转导细胞的最低浓度嘌呤霉素至关重要。
建议初次做实验的客户一定要建立适合自身实验体系的杀死曲线(kill curve)。

细胞筛选一嘌呤霉素(一) 确定最优筛选浓度当用于筛选特定细胞的嘌呤霉素合适浓度未知时,需进行滴定,或制定针对那种细胞的嘌呤霉素杀菌曲线。
一般而言,嘌呤霉素浓度范围在2-10微克/毫升时是足以杀灭大多数未转染的哺乳动物细胞系。
1. 培养待转染(而不是转染后)的细胞。
(筛选的目的是杀灭未转染的细胞)2. 取对数生长期的细胞(一般在铺满培养器皿底部的70%~80%时),用新鲜无抗无血清的培养基制成1.5×105 个/ml 的细胞悬液。
3. 向96孔培养板中加细胞悬液,每孔100微升(使每孔细胞数在1.5×104个),然后向每孔加新鲜无抗无血清的培养基适量,培养箱中静置培养过夜。
(这样做是为了保证在固定细胞密度下确定最佳G418药物筛选浓度。
) 4. 第二天用嘌呤霉素浓度分别为0, 2, 4, 6, 8, 10微克/毫升的新鲜无抗无血清培养基溶液替换各孔中的旧的培养基。
(每个浓度可用两个复孔,相当于每个浓度测定三次)。
(注意:对于多数细胞种类而言,过量的嘌呤霉素能引起许多非必需的表型的反应。
) 5. 每日检查细胞活力,根据细胞活力,每三天( 即每隔两天)更换含嘌呤霉素的新鲜无抗无血清培养基溶液一次。
如细胞生长过快,可以缩短换液时间(每隔一天)。
6. 在正常的实验操作规程时,一种细胞最优筛选浓度的确立时间随细胞的生长率和一般生存时间而定,大概需3到14天。
在所需时间之后,嘌呤霉素的导致所有细胞死亡的最小浓度就是应该用于该细胞和该实验的浓度。
最优浓度为在3-5天内杀死所有细胞的浓度。
(二) 转染细胞 1. 第一天:在60mm培养皿内种植细胞,细胞密度为能使第二天细胞融合能达到70%-80%的密度,CO2孵箱过夜培养。
2. 第二天:准备3ml无抗生素无血清培养基,加入Polybrene使其终浓度为8μg/ml。
将已经制备的病毒颗粒0.5 ml加至上述培养基,轻吹混匀。
去除60mm培养皿内的旧的培养基,加入含病毒培养基。

嘌呤霉素筛选细胞原理
嘌呤霉素是一种广泛用于细胞生物学研究的抗生素,它通过特异性地抑制蛋白
质合成而对细胞产生影响。
嘌呤霉素筛选细胞原理主要是利用其对细胞的影响来筛选出对嘌呤霉素敏感或耐药的细胞株,从而为进一步研究细胞的生物学特性提供重要的工具和方法。
嘌呤霉素的作用机制是通过与细胞内的核糖体结合,阻止蛋白质的合成。
在细
胞中,核糖体是蛋白质合成的重要场所,而嘌呤霉素的结合会引起核糖体的功能受损,从而影响细胞的正常生物学活动。
因此,对嘌呤霉素敏感的细胞在其作用下会出现生长受抑制甚至死亡的现象,而对嘌呤霉素耐药的细胞则能够继续生长并繁殖。
在进行嘌呤霉素筛选细胞的实验中,首先需要将待筛选的细胞种植在含有嘌呤
霉素的培养基中,然后观察细胞的生长情况。
对于对嘌呤霉素敏感的细胞,其生长将受到明显的抑制,甚至会出现细胞死亡的现象;而对于对嘌呤霉素耐药的细胞,则会继续生长并形成细胞克隆。
通过这种方式,可以筛选出对嘌呤霉素敏感或耐药的细胞株,为后续的细胞生物学研究提供了重要的实验材料。
嘌呤霉素筛选细胞的原理不仅在细胞生物学研究中具有重要意义,同时也在药
物筛选和耐药机制研究中发挥着重要作用。
通过对细胞对嘌呤霉素的敏感性进行评估,可以为药物研发提供重要参考,同时也有助于深入了解细胞对抗生素的耐药机制,为临床治疗提供理论基础。
总的来说,嘌呤霉素筛选细胞的原理是基于其对细胞的特异性影响,通过观察
细胞在其作用下的生长情况来筛选出对嘌呤霉素敏感或耐药的细胞株。
这一原理不仅在细胞生物学研究中具有重要意义,同时也在药物研发和耐药机制研究中发挥着重要作用,为进一步的科学研究和临床治疗提供了重要的实验基础和理论支持。

嘌呤霉素筛选稳定表达细胞系经验总结嘌呤霉素杀灭曲线的确定(shRNA稳定转染细胞株,仅作参考)(1)24孔板内以5~8 x 104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如0-15μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定转染细胞(1)day 0:24孔板内以5~8 x 104 cells/孔的密度铺板,孵育过夜;(2)制备筛选培养基:含有最佳筛选浓度嘌呤霉素(由杀灭曲线确定)的新鲜培养基;(3)day 1:筛选第一天,去除旧的培养基,加入一定量MOI的病毒颗粒;(加入无血清培养基的总量必须充分覆盖住细胞。
)(4)病毒转导后约6-8h,再添加1ml完全培养基(血清和双抗,如果已经使用双抗。
)到细胞内,然后孵育过夜;(5)病毒转导后48h,使用嘌呤霉素筛选培养基替换旧的完全培养基。
孵育。
(6)约每2-3天替换新鲜配制的筛选培养基;(7)每天检测细胞并观察活细胞生长比例,以及turboGFP表达的水平及所占比例。
在某一个时间点几乎所用存活细胞都可以表达TurboGFP。
嘌呤霉素最佳的作用时间在3-10天之间。
注:病毒的MOI越高,每个细胞含有的shRNA拷贝和嘌呤霉素耐性基因越多。
在做嘌呤霉素筛选时,需记住越高MOI,含越多pac拷贝的细胞能耐受更高的嘌呤霉素浓度。
调整嘌呤霉素的浓度去筛选预定量的转导细胞,但是嘌呤霉素的量不能低于杀死曲线建立的最低浓度。
储存方法和稳定性:嘌呤霉素稳定性高,可以常温运输,收到产品后4℃存放;嘌呤霉素在室温条件下可存放3个月,4℃条件下保质期一年。

嘌呤霉素筛选稳定表达细胞系经验总结一、引言简述稳定表达细胞系的重要性和应用领域阐明嘌呤霉素筛选法的原理和优势二、研究背景介绍稳定表达细胞系在生物制药、基因功能研究等领域的作用阐述嘌呤霉素筛选法在细胞系构建中的应用背景三、实验材料与方法详细列出实验所需的细胞株、质粒、嘌呤霉素等材料描述实验的基本流程,包括细胞转染、筛选、扩增等步骤四、嘌呤霉素筛选原理解释嘌呤霉素的作用机制和如何用于筛选稳定表达细胞阐述筛选过程中细胞的选择压力和适应性变化五、实验操作步骤详细描述实验的具体操作步骤,包括细胞培养、转染、筛选等提供实验操作中的注意事项和常见问题解决方案六、筛选效率与稳定性分析通过实验数据展示筛选效率,包括细胞存活率、表达水平等分析细胞系的稳定性,包括长期培养后的表达水平变化七、优化策略与改进措施根据实验结果提出优化筛选条件的建议描述改进措施,如提高转染效率、调整筛选压力等八、实验结果展示实验中获得的稳定表达细胞系的数据和图像分析实验结果,包括成功构建的细胞系数量、表达效率等九、案例研究选取几个典型的案例,详细描述筛选过程和结果分析案例成功或失败的原因,提供经验教训十、问题与挑战列出在筛选过程中遇到的主要问题和挑战分析问题产生的原因,提出解决方案十一、经验总结总结在嘌呤霉素筛选稳定表达细胞系过程中积累的经验强调实验操作的准确性、条件控制的重要性十二、未来展望根据当前研究趋势,预测稳定表达细胞系构建的未来发展方向提出未来研究中可能采用的新方法和技术十三、结语强调稳定表达细胞系在生物医学研究中的应用价值表达对参与实验的团队成员的感谢十四、参考文献列出实验过程中参考的文献资料十五、附录附上实验操作的详细步骤、实验数据、图表等。

生物嘌呤的知识关于生物嘌呤的知识嘌呤霉素杀灭曲线的确定(shRNA稳定转染细胞株,仅作参考)(1)24孔板内以5~8x104cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如0-15μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定转染细胞(1)day0:24孔板内以5~8x104cells/孔的密度铺板,孵育过夜;(2)制备筛选培养基:含有最佳筛选浓度嘌呤霉素(由杀灭曲线确定)的新鲜培养基;(3)day1:筛选第一天,去除旧的培养基,加入一定量MOI的病毒颗粒;(加入无血清培养基的总量必须充分覆盖住细胞。
)(4)病毒转导后约6-8h,再添加1ml完全培养基(血清和双抗,如果已经使用双抗。
)到细胞内,然后孵育过夜;(5)病毒转导后48h,使用嘌呤霉素筛选培养基替换旧的完全培养基。
孵育。
(6)约每2-3天替换新鲜配制的筛选培养基;(7)每天检测细胞并观察活细胞生长比例,以及turboGFP表达的水平及所占比例。
在某一个时间点几乎所用存活细胞都可以表达TurboGFP。
嘌呤霉素最佳的作用时间在3-10天之间。
注:病毒的MOI越高,每个细胞含有的shRNA拷贝和嘌呤霉素耐性基因越多。
在做嘌呤霉素筛选时,需记住越高MOI,含越多pac拷贝的`细胞能耐受更高的嘌呤霉素浓度。
调整嘌呤霉素的浓度去筛选预定量的转导细胞,但是嘌呤霉素的量不能低于杀死曲线建立的最低浓度。
储存方法和稳定性:嘌呤霉素稳定性高,可以常温运输,收到产品后4℃存放;嘌呤霉素在室温条件下可存放3个月,4℃条件下保质期一年。
为了达到最理想的稳定状态和最长的保质期,最好存放于-20°C,保质期为2年。

嘌呤霉素(Puromycin)筛选稳定细胞株的步骤及方法Puromycin 是来源于Streptomyces alboniger 的一种氨基核苷类抗生素,中文名为嘌呤霉素,常用于筛选能够表达pac 基因(puror)的细胞。
pac 基因表达嘌呤霉素N-乙酰转移酶(Puromycin N-acetyl-tranferase),如果该基因表达,就会对嘌呤霉素产生抗性,这一特性目前普遍应用于筛选表达pac 基因的哺乳动物稳定细胞株。
目前,很多商业化的慢病毒载体都携带pac 基因(一般在质粒图谱上标记为puror),可以利用嘌呤霉素的筛选,得到特定基因稳定表达的细胞株。
嘌呤霉素也可以用来筛选表达pac 基因的大肠杆菌菌株、酵母菌株等。
Puromycin 不仅能用于稳定细胞株的筛选,也用于稳定细胞株的维持。
Puromycin 的作用特点是快速作用于细胞,一般2 天内可以杀死99%的不表达pac 基因的细胞。
本产品浓度为10mg/ml,已过滤除菌,可以直接用于细胞培养。
使用说明:一、推荐工作浓度:推荐的作用于哺乳动物细胞的嘌呤霉素浓度一般为1-10μg/ml,但最佳工作浓度需要通过剂量反应曲线来确定。
二、嘌呤霉素剂量反应曲线的确定( 以shRNA )转染或者慢病毒感染为例)::嘌呤霉素的有效筛选浓度与细胞类型、生长状态、细胞密度、细胞代谢及细胞所处细胞周期等因素相关。
为了筛选到稳定表达的shRNA或感染病毒的细胞株,确定杀死未转染/感染细胞的最低浓度嘌呤霉素非常重要。
对于初次使用的细胞,一般需要通过实验来确定适合自身实验体系的剂量反应曲线(dose-response curve or kill curve)。
1、第一天:24 孔板中以5~8×10 4 cells/孔的密度接种细胞,接种够量的孔以便进行后续的剂量梯度实验。
细胞培养箱内培养过夜。
2、第二天:在培养过夜后的细胞中更换新鲜配制的筛选培养基,该筛选培养基为含不同浓度嘌呤霉素的新鲜培养基(如0、1、2.5、5、7.5、10μg/ml 等),更换培养基后在细胞培养箱中继续培养。

稳定细胞株筛选药物浓度确定方法
稳定细胞株筛选药物浓度确定方法
在使用G418、潮霉素B或嘌呤霉素筛选稳定细胞系细胞之前,需要先通过梯度实验确定适合该类细胞的最佳药物浓度。
对于一些常见的细胞系,通常可以在资料中找到推荐的药物浓度。
例如Hela细胞用400 μg/ml的G41或1 μg/ml的嘌呤霉素进行稳定细胞株筛选。
用G418或潮霉素B,选用在5天左右出现细胞大批死亡,2周全部死亡的浓度作为筛选浓度。
对于嘌呤霉素,通常采用在3-4天杀死全部细胞的浓度。
不同批次的药物活性有一定差异。
因此在使用新批次药物时,需要重新测定最佳浓度。
筛选抗生素的推荐使用浓度(μg/ml)
抗生素工作范围筛选浓度维持用量
G418 50-800 400-500 100
Hygromycin 50-800 200 100
Puromycin 0.25-2 0.5-10 0.25
1、在加入筛选药物前一天将细胞以50%密度接种到6孔板。
第二天在培养基中按G418(0,50,1000,200,400,800μg/ml)或者嘌呤霉素(0,1,2.5,5,7.5,10μg/ml)加入。
2、用G418筛选处理5-10天。
每2天观察细胞一次。
每4天跟换新的有抗生素的培养基(如果有必要可以更换得更勤)。
直到得到最佳浓度。
3、用嘌呤霉素处理4-7天。
每2天跟换新的有抗生素的培养基。

嘌呤霉素筛选原理嘌呤霉素(puromycin)是一种广泛应用于生物学实验室的抗生素,主要用于筛选高效表达外源基因的细胞。
嘌呤霉素通过其独特的机制选择性杀死转染外源基因的细胞,从而筛选出成功表达目标基因的细胞。
下面将详细介绍嘌呤霉素筛选原理。
嘌呤霉素是一种氨基糖苷类抗生素,由Streptomyces alboniger产生。
其结构与核苷酸有一定的相似性,因此可以与核酸结合。
嘌呤霉素的分子结构中包含有嘌呤环和氨基糖苷环两个部分。
嘌呤环可以与核酸中的同源嘌呤碱基形成氢键,而氨基糖苷环则可以与RNA中的A位点形成酯键。
嘌呤霉素的筛选原理主要利用了细胞中的转运机制以及它对细胞翻译的作用。
当目标基因通过适当载体引入到细胞中后,该载体通常带有一个与嘌呤霉素敏感基因连在一起的表达序列。
这个敏感基因通常是某种转录因子,其缺失将导致细胞死亡。
当细胞中成功表达目标基因时,其编码的蛋白质与嘌呤霉素的作用机制相互配合,从而导致细胞的死亡。
具体来说,目标基因的编码蛋白质与细胞内的核糖体结合时,嘌呤霉素的氨基糖苷环与目标基因的A位点形成酯键,导致核糖体解聚,细胞翻译过程终止,从而导致细胞死亡。
然而,嘌呤霉素对细菌、真核生物和原核生物都具有一定的毒性。
为了更好地筛选出真正成功表达目标基因的细胞,通常在培养基中添加一定浓度的嘌呤霉素。
这样一来,只有那些真正成功表达目标基因的细胞才能够在相对高浓度的嘌呤霉素下存活,而其他未表达目标基因的细胞则会因为对嘌呤霉素的敏感性而死亡。
通过嘌呤霉素的筛选原理,可以有效地检测和筛选出成功表达目标基因的细胞,为进一步的实验和研究提供了基础。
另外,嘌呤霉素还可以作为选择性筛选工具,用于分离和培养特定表达基因的细胞系,为生物医学研究和基因工程领域提供了有力的支持。
总结起来,嘌呤霉素筛选原理是通过其结构与核酸的结合,干扰细胞翻译过程,从而选择性杀死未成功表达目标基因的细胞。
该筛选方法提供了一种快速、简便、有效的方法,可以帮助科研人员筛选出成功表达目标基因的细胞,为生命科学研究提供了重要的手段。

嘌呤霉素筛选稳定表达细胞系经验总结(总3页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除嘌呤霉素筛选稳定表达细胞系经验总结嘌呤霉素杀灭曲线的确定(shRNA稳定转染细胞株,仅作参考)(1)24孔板内以5~8 x 104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如0-15μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定转染细胞(1)day 0:24孔板内以5~8 x 104 cells/孔的密度铺板,孵育过夜;(2)制备筛选培养基:含有最佳筛选浓度嘌呤霉素(由杀灭曲线确定)的新鲜培养基;(3)day 1:筛选第一天,去除旧的培养基,加入一定量MOI的病毒颗粒;(加入无血清培养基的总量必须充分覆盖住细胞。
)(4)病毒转导后约6-8h,再添加1ml完全培养基(血清和双抗,如果已经使用双抗。
)到细胞内,然后孵育过夜;(5)病毒转导后48h,使用嘌呤霉素筛选培养基替换旧的完全培养基。
孵育。
(6)约每2-3天替换新鲜配制的筛选培养基;(7)每天检测细胞并观察活细胞生长比例,以及turboGFP表达的水平及所占比例。
在某一个时间点几乎所用存活细胞都可以表达TurboGFP。
嘌呤霉素最佳的作用时间在3-10天之间。
注:病毒的MOI越高,每个细胞含有的shRNA拷贝和嘌呤霉素耐性基因越多。
在做嘌呤霉素筛选时,需记住越高MOI,含越多pac拷贝的细胞能耐受更高的嘌呤霉素浓度。
调整嘌呤霉素的浓度去筛选预定量的转导细胞,但是嘌呤霉素的量不能低于杀死曲线建立的最低浓度。
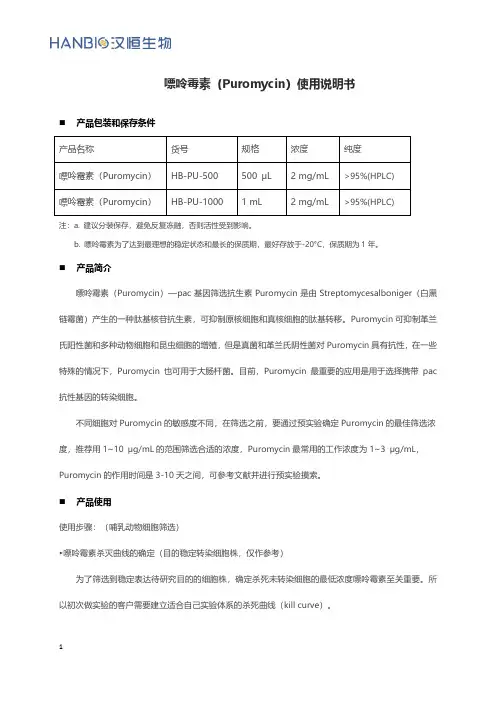
嘌呤霉素(Puromycin)使用说明书◼产品包装和保存条件注:a. 建议分装保存,避免反复冻融,否则活性受到影响。
b. 嘌呤霉素为了达到最理想的稳定状态和最长的保质期,最好存放于-20°C,保质期为1年。
◼产品简介嘌呤霉素(Puromycin)—pac基因筛选抗生素Puromycin是由Streptomycesalboniger(白黑链霉菌)产生的一种肽基核苷抗生素,可抑制原核细胞和真核细胞的肽基转移。
Puromycin可抑制革兰氏阳性菌和多种动物细胞和昆虫细胞的增殖,但是真菌和革兰氏阴性菌对Puromycin具有抗性,在一些特殊的情况下,Puromycin也可用于大肠杆菌。
目前,Puromycin最重要的应用是用于选择携带pac 抗性基因的转染细胞。
不同细胞对Puromycin的敏感度不同,在筛选之前,要通过预实验确定Puromycin的最佳筛选浓度,推荐用1~10 μg/mL的范围筛选合适的浓度,Puromycin最常用的工作浓度为1~3 μg/mL,Puromycin的作用时间是3-10天之间,可参考文献并进行预实验摸索。
◼产品使用使用步骤:(哺乳动物细胞筛选)►嘌呤霉素杀灭曲线的确定(目的稳定转染细胞株,仅作参考)为了筛选到稳定表达待研究目的的细胞株,确定杀死未转染细胞的最低浓度嘌呤霉素至关重要。
所以初次做实验的客户需要建立适合自己实验体系的杀死曲线(kill curve)。
(1)24孔板内以5~8x104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如:0~15 μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定表达细胞系经验总结嘌呤霉素杀灭曲线的确定(shRNA稳定转染细胞株,仅作参考)(1)24孔板内以5~8 x 104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如0-15μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定转染细胞(1)day 0:24孔板内以5~8 x 104 cells/孔的密度铺板,孵育过夜;(2)制备筛选培养基:含有最佳筛选浓度嘌呤霉素(由杀灭曲线确定)的新鲜培养基;(3)day 1:筛选第一天,去除旧的培养基,加入一定量MOI的病毒颗粒;(加入无血清培养基的总量必须充分覆盖住细胞。
)(4)病毒转导后约6-8h,再添加1ml完全培养基(血清和双抗,如果已经使用双抗。
)到细胞内,然后孵育过夜;(5)病毒转导后48h,使用嘌呤霉素筛选培养基替换旧的完全培养基。
孵育。
(6)约每2-3天替换新鲜配制的筛选培养基;(7)每天检测细胞并观察活细胞生长比例,以及turboGFP表达的水平及所占比例。
在某一个时间点几乎所用存活细胞都可以表达TurboGFP。
嘌呤霉素最佳的作用时间在3-10天之间。
注:病毒的MOI越高,每个细胞含有的shRNA拷贝和嘌呤霉素耐性基因越多。
在做嘌呤霉素筛选时,需记住越高MOI,含越多pac拷贝的细胞能耐受更高的嘌呤霉素浓度。
调整嘌呤霉素的浓度去筛选预定量的转导细胞,但是嘌呤霉素的量不能低于杀死曲线建立的最低浓度。
储存方法和稳定性:嘌呤霉素稳定性高,可以常温运输,收到产品后4℃存放;嘌呤霉素在室温条件下可存放3个月,4℃条件下保质期一年。
嘌呤霉素筛选程序嘌呤霉素筛选程序一、杀伤曲线1. 在24 孔板内接种细胞,约3x104/孔,共11孔,培养过夜。
2. 第二天,观察细胞密度为20%-30%。
稀释嘌呤霉素(0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 μg/ml)至培养基, 每孔加入0.75m l培养基。
3. 每隔2天观察细胞的存活情况(贴壁细胞飘起即为死亡,悬浮细胞,可以通过观察细胞的膜情况来判断,死亡细胞的细胞膜较为粗糙,有皱褶,没光泽,准确应以取少量细胞进行台盼蓝染色为准),每隔2天更换0.75m l含相应浓度嘌呤霉素的培养基。
4. 筛选4-7天内使细胞全部死亡的最低嘌呤霉素浓度,即为杀伤浓度(筛选浓度);二、细胞筛选1.转染(24孔板进行)或电转后培养24小时,按10%密度传代(传至35mm平皿),继续培养24小时,待细胞密度增至20%~25%汇合时;2.去掉培养液,PBS洗一次,加入按最佳筛选浓度(杀伤曲线实验确定)配制好的嘌呤霉素筛选培养基2-3ml。
3.根据培养基的颜色和细胞的存活情况,每隔2天更换一次筛选培养基(培养基用量为2-4ml,细胞多,多加培养基,细胞少,少加培养基), 一般在3-4天内出现细胞大量或少量死亡情况(如果转染效率或电转效率高,则死亡少;如果转染效率或电转效率低,则死亡多;如果筛选浓度偏低,筛选培养基用量少,细胞密度大于80%,会导致大量假阳性克隆)。
如果筛选第一周,出现细胞大量死亡,则在原培养皿中继续加入筛选培养基进行筛选一周;如果筛选第一周,出现细胞少量死亡,则把细胞按10%密度传代(传至35mm平皿,传一个皿即可,多余细胞丢弃),利用筛选培养基进行筛选一周;4.筛选第二周结束后,则把细胞消化下来,进行终点稀释(10ul 培养基中含1个细胞,用筛选培养基),把上述10ul细胞悬液加入96孔板中(提前加入40ul 筛选培养基),一共加24孔,4小时后观察每个孔的情况,记录只含一个细胞的孔,含有一个细胞的孔用于继续筛选,其余孔舍弃;5.根据培养基的颜色和细胞生长情况换入新的筛选培养基,待细胞密度为80%时,将其传代至24孔板中增殖,待细胞密度为80%时,将其传代至6孔板中增殖,待细胞密度为80%时,将其传代至T25瓶(一传3)中增殖, 每隔3天换液。
嘌呤霉素筛选原理
嘌呤霉素筛选原理指的是以嘌呤霉素为主要筛选标准来对所要筛选的物质进行筛选和
提纯的技术原理,是一种相对简洁而高效的方法。
1.首先,嘌呤霉素具有以下特征:嘌呤霉素含有碱性的氨基酸残基;嘌呤霉素由L-ARABINOSE 和 N-ACETYL-ARABINOSE组成;嘌呤霉素中的ARABINOSE氨基酸具有两个碱性
的氨基,后者具有较好的离子性;嘌呤霉素具有极好的化学稳定性,在一定pH值范围内,其结构特性不受影响。
2.嘌呤霉素筛选原理主要是利用嘌呤霉素的特性来筛选物质:首先,使用亲和层析等
技术,将物质和嘌呤霉素结合,形成复合物;随后,采用酸性或碱性液体将复合物分解,
得到物质的提纯或纯化;最后,运用一定的固定模板,可以使纯净的物质被筛选出来,从
而实现物理筛选的结果。
3.嘌呤霉素筛选方法具有如下优势:首先,由于嘌呤霉素本身具有较好的离子性,在
一定pH值范围内,它的结构可稳定。
因此,可以在灵活的pH范围内调节筛选的抗性,从
而实现较高的提纯效果;其次,由于嘌呤霉素依靠离子表面的局部性机构,因此,即使在
混合环境中,仍然可以实现较高的提纯效果;最后,嘌呤霉素可以有效降低温度、pH以及溶剂等条件,从而降低筛选和提纯所消耗的能量,使过程更为经济和可行。
总而言之,嘌呤霉素筛选法是一种高效、快速、可行的技术原理,它可以有效筛选和
提取出纯度较高的物质,是一种常用的物质筛选技术。
嘌呤霉素筛选稳定表达细胞系经验总结(总3页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除嘌呤霉素筛选稳定表达细胞系经验总结嘌呤霉素杀灭曲线的确定(shRNA稳定转染细胞株,仅作参考)(1)24孔板内以5~8 x 104 cells/孔的密度铺板,铺足够量的孔以进行后续的梯度实验。
细胞孵育过夜;(2)准备筛选培养基-含不同浓度嘌呤霉素的新鲜培养基(如0-15μg/mL,至少5个梯度);(3)细胞孵育过夜后加入筛选培养基,孵育细胞;(4)约2-3天更换新鲜的筛选培养基;(5)每日监测细胞观察存活细胞比例。
嘌呤霉素的最佳作用时间一般在1-4天之间。
(6)最小的抗生素使用浓度就是指从抗生素筛选开始1-4天内杀死所用细胞的最低筛选浓度。
嘌呤霉素筛选稳定转染细胞(1)day 0:24孔板内以5~8 x 104 cells/孔的密度铺板,孵育过夜;(2)制备筛选培养基:含有最佳筛选浓度嘌呤霉素(由杀灭曲线确定)的新鲜培养基;(3)day 1:筛选第一天,去除旧的培养基,加入一定量MOI的病毒颗粒;(加入无血清培养基的总量必须充分覆盖住细胞。
)(4)病毒转导后约6-8h,再添加1ml完全培养基(血清和双抗,如果已经使用双抗。
)到细胞内,然后孵育过夜;(5)病毒转导后48h,使用嘌呤霉素筛选培养基替换旧的完全培养基。
孵育。
(6)约每2-3天替换新鲜配制的筛选培养基;(7)每天检测细胞并观察活细胞生长比例,以及turboGFP表达的水平及所占比例。
在某一个时间点几乎所用存活细胞都可以表达TurboGFP。
嘌呤霉素最佳的作用时间在3-10天之间。
注:病毒的MOI越高,每个细胞含有的shRNA拷贝和嘌呤霉素耐性基因越多。
在做嘌呤霉素筛选时,需记住越高MOI,含越多pac拷贝的细胞能耐受更高的嘌呤霉素浓度。
调整嘌呤霉素的浓度去筛选预定量的转导细胞,但是嘌呤霉素的量不能低于杀死曲线建立的最低浓度。
iPS重编程中如何优化嘌呤霉素筛选步骤?ReproRNA™-OKSGM为单链RNA复制⼦、⾮整合型的重编程载体。
该载体包含⼀个嘌呤霉素抗性基因⽚段,⽤于筛选出含此载体的细胞。
因此,没有含此载体的细胞会被嘌呤霉素去除。
在转染后的第1到6天进⾏筛选,可去除培养中未被转染的成纤维细胞。
STEMCELL Technologies推荐的筛选过程中嘌呤霉素的使⽤浓度为0.8 µg/mL。
该浓度既保证嘌呤霉素的毒性⾜够去除未被转染的成纤维细胞以降低背景,⼜不会过量⽽对转染过的细胞具有毒性,导致重编程效率降低。
对于⼀些特定的细胞系,如果在筛选步骤后发现剩余细胞或者被去除的细胞过少,说明0.8 µg/mL嘌呤霉素并不是⼀个合适的浓度。
在此情况下,可按照以下步骤做⼀个细胞毒性检测来决定适当的浓度。
操作流程1. 成纤维细胞以5 x 10^4 cells/mL的浓度接种于96孔板,并使⽤成纤维细胞培养基在37°C,5%CO2条件下孵育过夜,使细胞贴壁。
成纤维细胞培养基:⾼糖DMEM;10% (v/v) FBS(胎⽜⾎清); 1% (v/v)⾮必需氨基酸; 2 mM L-⾕氨酰胺。
2. 第⼆天,制备含不同浓度嘌呤霉素的成纤维细胞培养基。
请参见下⾯表格中的⽰例,您可根据需要来选取不同嘌呤霉素浓度或样本重复数。
例如,选取嘌呤霉素浓度为1.2,1.0,0.8,0.6,0.4,0.2,0.1和0 µg/mL。
3. 在显微镜下观察96孔板,确认成纤维细胞已贴壁。
通常情况下,细胞密度⼤约为80%。
4. 将原培养基换成含不同浓度嘌呤霉素的培养基,在37°C,5%CO2下培养过夜。
5. 在之后的5天内每天重复步骤2-4。
请注意:需当天制备新鲜的含嘌呤霉素的培养基,我们不建议⼀次制备所需的全部培养基。
6. 在第5天,使⽤细胞活性检测(如MTT或LDH)得到能够去除80-100%的细胞的最⼩嘌呤霉素浓度。
嘌呤霉素筛选程序
一、杀伤曲线
1. 在24 孔板内接种细胞,约3x104/孔,共11孔,培养过夜。
2. 第二天,观察细胞密度为20%-30%。
稀释嘌呤霉素(0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 µg/ml)至培养基, 每孔加入0.75m l培养基。
3. 每隔2天观察细胞的存活情况(贴壁细胞飘起即为死亡,悬浮细胞,可以通过观察细胞的膜情况来判断,死亡细胞的细胞膜较为粗糙,有皱褶,没光泽,准确应以取少量细胞进行台盼蓝染色为准),每隔2天更换0.75m l含相应浓度嘌呤霉素的培养基。
4. 筛选4-7天内使细胞全部死亡的最低嘌呤霉素浓度,即为杀伤浓度(筛选浓度);
二、细胞筛选
1.转染(24孔板进行)或电转后培养24小时,按10%密度传代(传至35mm
平皿),继续培养24小时,待细胞密度增至20%~25%汇合时;
2.去掉培养液,PBS洗一次,加入按最佳筛选浓度(杀伤曲线实验确定)配制
好的嘌呤霉素筛选培养基2-3ml。
3.根据培养基的颜色和细胞的存活情况,每隔2天更换一次筛选培养基(培养
基用量为2-4ml,细胞多,多加培养基,细胞少,少加培养基), 一般在3-4天内出现细胞大量或少量死亡情况(如果转染效率或电转效率高,则死亡少;
如果转染效率或电转效率低,则死亡多;如果筛选浓度偏低,筛选培养基用量少,细胞密度大于80%,会导致大量假阳性克隆)。
如果筛选第一周,出现细胞大量死亡,则在原培养皿中继续加入筛选培养基进行筛选一周;如果
筛选第一周,出现细胞少量死亡,则把细胞按10%密度传代(传至35mm平皿,传一个皿即可,多余细胞丢弃),利用筛选培养基进行筛选一周;
4.筛选第二周结束后,则把细胞消化下来,进行终点稀释(10ul培养基中含1
个细胞,用筛选培养基),把上述10ul细胞悬液加入96孔板中(提前加入40ul 筛选培养基),一共加24孔,4小时后观察每个孔的情况,记录只含一个细胞的孔,含有一个细胞的孔用于继续筛选,其余孔舍弃;
5.根据培养基的颜色和细胞生长情况换入新的筛选培养基,待细胞密度为80%
时,将其传代至24孔板中增殖,待细胞密度为80%时,将其传代至6孔板中增殖,待细胞密度为80%时,将其传代至T25瓶(一传3)中增殖, 每隔3天换液。
6.细胞大量扩增后,一瓶用于提取总RNA进行QPCR检测,一瓶用于总蛋白
进行WB检测,另一瓶用于保种,根据QPCR和WB结果取舍阳性克隆;。