新药研发概论
- 格式:ppt
- 大小:7.45 MB
- 文档页数:57


第十六章新药研究概论新药研究是一个涉及多种学科和领域的系统工程,构建化学结构是创制新药的起始点。
这里新药是指新的化学实体(new chemical entities, NCE)。
药物分子设计(molecular drug design)是新药研究的主要途径和手段。
药物分子设计可分为两个阶段,即先导化合物的产生(lead discovery)和先导化合物的优化(lead optimization)。
这两部分是有机地交互联系在一起的,属于药物化学研究范畴。
先导化合物(lead compound)又称原型物,简称先导物,是通过各种途径或方法得到的具有某种特定生物活性并且结构新颖的化合物。
先导物虽具有确定的药理作用,但因其存在的某些缺陷,如药效不够高,选择性作用不够强,药代动力学性质不合理,生物利用度不好,化学稳定性差,或毒性较大等,并非都能直接药用,但可作为结构修饰和结构改造的模型,从而最终获得预期药理作用的药物。
一、先导化合物的产生途径和方法(一)从天然生物活性物质中发现先导物从天然的植物、微生物、动物和内源性活性物质中发现先导物占有重要位置,常能发现新的结构类型。
临床上使用的多种药物,例如抗生素类、维生素类、生物碱类、甾体激素类等药物等都是从天然资源中提取、分离、鉴定出的活性成分。
目前,从天然资源中更多是从植物中分离有效成分,仍是寻找新药的重要途径。
例如我国发现的抗疟新药青蒿素(Artemisinin)。
20世纪50年代,疟疾的化学治疗由于找到了氯喹(chloroquine)等有效药物,使疟疾的传染得到了有效控制,但是20世纪60年代初,恶性疟原虫对氯喹产生了耐药性,寻找新型的抗疟药成为世界性的问题。
我国学者在20世纪70年代从中草药黄花蒿(青蒿)中分离出青蒿素,与临床上正在使用的抗疟药结构类型不同,为倍半萜类化合物。
青蒿素对耐氯喹的恶性疟原虫感染的鼠疟有效。
青蒿素是从天然生物活性物质中发现先导物,虽然可以作为新型抗疟药用于临床,但是存在生物利用度低和复发率高的缺点,对其进行结构优化,将青蒿素用硼氢化钠还原,得到双氢青蒿素(Dihydroarteamisinin)比青蒿素疗效高一倍,双氢青蒿素的甲基化产物蒿甲醚(Artemether),鼠疟筛选表明抗疟活性强于青蒿素10~20倍。





新药研发概论新药研发概论新药研发是通过系统性的科学研究和临床试验,从而创制出可用于治疗疾病的全新药物。
该领域需要跨学科的知识和专业技能,包括化学、生物学、药理学、临床医学等。
新药的研发通常需要数年甚至数十年的时间和巨额的投资。
新药的研发过程通常由以下几个步骤组成。
首先,新药的发现是整个研发过程的起点。
科学家通过不同的方法,如药物筛选和分子设计,寻找可能对特定疾病起作用的分子。
这是一个非常复杂和耗时的过程,需要大量的实验和数据分析。
然后,新药的设计和合成是必不可少的。
一旦找到了可用于治疗的分子,化学家会进行修改并合成出新的化合物。
这个过程需要深入的化学知识和技术,以确保新药的安全性和有效性。
随后,药物的评估和筛选成为重要环节。
这个阶段通常涉及对新药的活性、毒性和代谢动力学等进行测试和评估。
这些测试用于评估新药的有效性和安全性,并选择出最有潜力的候选药物进入下一阶段。
进入临床试验阶段后,新药研发面临着更多的挑战。
临床试验通常分为三个阶段。
第一阶段是安全性试验,目的是评估新药对人体的耐受性和毒副作用。
第二阶段是有效性试验,通过对具体疾病患者的治疗来评估新药的疗效。
最后一个阶段是大规模的三期试验,包括数百乃至上千名患者,用于评估新药的疗效和安全性。
最后,新药的上市审批是最终的目标。
当新药通过所有必要的临床试验,并获得相关监管机构的批准后,才能正式上市。
这个过程通常需要向监管机构提交完整的申请文件,包括临床试验数据、药物说明书和生产工艺等。
值得注意的是,新药研发的成功率非常低。
据统计,只有很少一部分新药能够通过所有的临床试验并最终上市。
这是因为新药研发的过程异常复杂和昂贵,其时间和资金的投入都极大。
然而,新药研发对于医药行业和患者来说都是非常重要的。
新药的问世可以为患者提供新的治疗选择,改善疾病的治疗效果。
同时,新药的研发也为企业带来巨大的商业机会,促进了医药科技的进步和发展。
总之,新药研发是一项复杂而艰巨的任务,需要科学家们的不懈努力和持久的耐心。


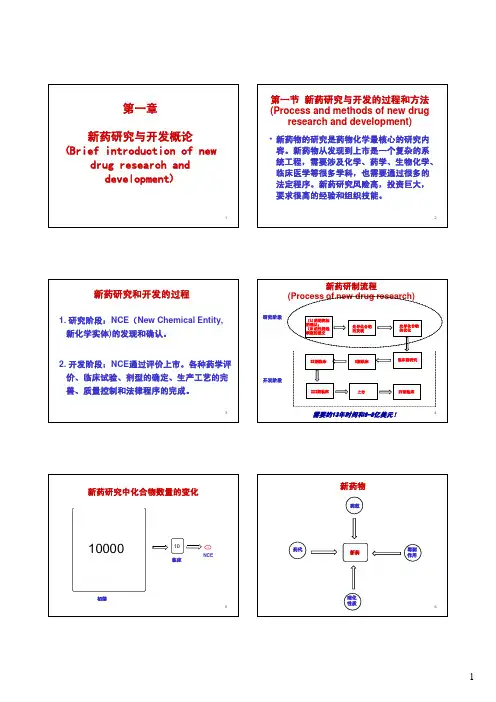
第一章新药研究与开发概论第一节引言新药的创制是一个系统工程,在研究与开发的过程中,涉及了多个学科和领域,包括分子生物学、生物信息学、分子药理学、药物化学、计算机科学以及药物分析化学、药理学、毒理学、药剂学、制药工艺学。
这些环节的有机配合,可以促进新药研制的质量与速度,使创制的新药更具有安全性、有效性和可控性。
安全性、有效性和可控性是药物的基本属性。
在一定意义上,这些属性是由药物的化学结构所决定的。
一.制药工业的特点:1.质量要求高质量标准:企标高于国标。
药典:五年修订一次,法律 2900多种。
GMP:药品生产质量管理规范Good Manufacturing practiceGLP:药品非临床研究质量管理规范Good Laboratory PracticeGCP:药品临床试验管理规范Good Clinical PracticalGSP: 药品经营质量管理规范2.生产过程要求高。
高温、高压、无菌、防火、防爆。
3.供应时间性较强。
既需一定量的储备,又需要常换以防过期,即超前性和必要储备。
4.品种多,更新快。
5.高技术,高投入,高风险,高产出,高效率(附加值高)(插入图片)高投入?近年来,新药的研究与开发虽然有显著的进步,但是成功率很低,就世界范围统计,创造一个全新药物需要从进行三期临床研究的2.5个候选药中得到,而新药上市则需要6.5个化合物进行临床一期的实验,为此,需要这21个进行了慢性毒性的化合物中选取,这又需要合成6200个化合物,这个过程需要13年,耗资大约3亿美元(1996年Nature)成功率低的原因是:(1)要求新研制的药物比临床应用的药物性质更为优良,特别对难以治疗的和慢性疾患有更迫切的需求。
例:恶性肿瘤、心血管疾病、与衰老相关的疾病、内分泌失调、免疫性疾病、中枢神经系统和病毒性疾病等。
(2)判断疗效的时间长,同时对安全性也要求长时间的试验观察。
例如,对慢性毒性和致癌、致畸、致突变、生殖和围产期毒理等试验。

新药研发概述范文新药研发是指通过科学的方法和技术,以解决特定疾病的药物为目标,经过一系列的化学合成、药理学和临床试验,最终达到药物上市的过程。
新药研发是医药工业的核心内容之一,也是推动医药科学和临床医学发展的重要环节。
新药研发的过程一般可以分为药物发现、药物开发和临床试验三个阶段。
首先,药物发现阶段主要是通过各类新药研究手段,寻找潜在的药物分子。
这一阶段通常包括以下几个步骤:借助于基于计算机模拟的方法,在大量的化学物质中筛选出符合特定药物标的的化合物,即所谓的“虚拟筛选”;然后通过化学合成手段合成一系列的新化合物,并进行生化活性测定和结构活性关系研究,筛选出一些有潜力的药物候选化合物;最后,对候选化合物进行药效学和毒理学评价,确定最有希望进入下一阶段研发的药物分子。
接下来,药物开发阶段是对候选化合物进行进一步的优化和完善。
这一阶段一般分为药物设计、药物合成和药物评价三个步骤。
药物设计侧重于对候选化合物进行结构和理化性质的优化,以提高药物的选择性和药理活性,并减少不良反应。
药物合成则用于大规模合成已确定药物结构的化合物,并保证质量和纯度。
药物评价则是通过临床药理学、药代动力学和毒理学等研究手段,全面评价药物的安全性和疗效。
最后,临床试验阶段是将已优化和评价的药物在人体上进行验证和评价。
根据国际和国内的相关规定,临床试验一般分为四个阶段:临床前研究阶段,包括药物代谢、生理效应和安全性的研究;临床试验I期,主要评价药物的安全性、相应的代谢动力学和毒理学特点;临床试验II期,是进一步评价药物的安全性和有效性;临床试验III期是全面评价药物疗效和安全性,并与已上市的药物进行比较。
在临床试验期间,还需要符合实验室、临床制造规范和伦理要求,确保研究结果的准确和可靠。
总的来说,新药研发是一个复杂、系统和耗时长的过程。
从发现药物分子,到优化和评价,再到临床试验验证,每个阶段都需要充分的科学和技术支持,以确保药物的疗效、安全性和质量。
先导化合物:简称先导物,是通过各种途径和手段得到的具有某种生物活性和化学结构的化合物,用于进一步的结构改造和修饰,是现代新药研究的出发点。
在新药研究过程中,通过化合物活性筛选而获得具有生物活性的先导化合物是创新药物研究的基础。
药品:药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等。
亲和力:亲和力是指药物与靶标(组织、细胞、受体)的结合能力,亲和力的不同可以导致药物在体内选择性地分布,大都是特异性的,如碘对甲状腺组织有高度的亲和力。
HTS高通量筛选:指以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,以灵敏快速的检测仪器采集实验结果数据,以计算机分析处理实验数据,在同一时间检测数以千万的样品,并以得到的相应数据库支持运转的技术体系,它具有微量、快速、灵敏和准确等特点。
QSAR定量结构代谢关系:是研究药物活性与化学结构之间的定量关系。
定量结构代谢关系研究是对药物分子的化学结构与其生物活性之间的关系进行定量分析,找出药物的化学结构与生物活性之间的量变规律,或得到构效关系的数学方程,为进一步结构优化提供理论依据。
ADME:即药物的体内过程,指机体对外药物的处置,包括药物在体内的吸收(absorption)、分布(distribution)、代谢(metabolism)及排泄(excretion)过程。
受体:指任何能够同激素、神经递质、药物或细胞内信号分子结合并能引起细胞功能变化的生物大分子。
药理学上的定义为能够与药物结合产生相互作用,发动细胞反应的大分子或大分子复合物。
首过效应:又称首过消除,其定义是指某些药物口服后首次通过肠壁或肝脏时被其中的酶代谢,使进入体循环的有效药量减少的现象。
虚拟筛选(VS):也称计算机筛选,即在进行生物活性筛选之前,利用计算机上的分子对接软件模拟目标靶点与候选药物之间的相互作用,计算两者之间的亲和力大小,以降低实际筛选化合物数目,同时提高先导化合物发现效率。
新药研究与开发概论
新药研究与开发的基本概念包括确定研究目标、搜集药物素材、进行
活性筛选、进行药物化学和药理学研究、进行临床试验和评价新药的安全
性和疗效。
新药的研发过程一般可以分为药物发现、药物开发和相关临床
试验三个阶段。
第一阶段是药物发现,其目的是寻找具有治疗潜力的新化合物。
在这
一阶段,研究人员需要通过对疾病机制的了解和分子生物学技术的应用,
确定新药的靶标和搜集药物素材。
搜集药物素材可以通过天然产物、化学
合成、高通量筛选等方法进行。
活性筛选是药物发现的关键步骤,通过对
药物素材进行测试,筛选出具有良好治疗潜力的化合物。
第二阶段是药物开发,其目标是通过药物化学和药理学研究,改进和
优化新药的性质和活性。
药物化学是指对新药的分子结构进行修饰和合成,以增加其化学稳定性和药物代谢特性。
药理学研究是指对新药的药物效应、毒性和代谢途径等进行评价和研究,以确保其安全性和疗效。
第三阶段是相关临床试验,其目标是评价新药的安全性和疗效。
临床
试验是新药研究与开发的最后关键环节,也是新药上市的前提条件。
临床
试验分为三个阶段:第一阶段是安全性评价,主要针对健康志愿者,了解
药物的安全性和耐受性;第二阶段是疗效评价,主要针对患者,评价新药
的疗效和副作用;第三阶段是大样本临床试验,主要针对大规模患者群体,验证新药的疗效和安全性。
总之,新药研究与开发是一项综合性的工作,包括药物发现、药物开
发和相关临床试验三个阶段。
通过科学的方法和技术,可以不断探索和开
发出具有治疗潜力的新药,为人类的健康和疾病治疗作出重要贡献。
新药研发概述范文新药研发是指通过一系列的科学实验、临床试验和审批程序,将新的药物从发现到上市的整个过程。
新药的研发是一项复杂而耗时的工作,需要多学科的合作,从药物发现到药物上市,可能需要多年甚至十几年的时间。
新药研发的第一步是药物的发现和开发。
药物的发现可以通过不同的渠道进行,包括基础研究、药物筛选、仿制药等。
基础研究主要是通过对疾病机制的深入研究,找到可能的治疗靶点,然后通过药物筛选,寻找与靶点相互作用的化合物。
在发现了可能的治疗靶点和化合物后,就需要进行药物的开发,包括化学合成、药物设计以及药物制剂等。
这一阶段的主要目标是寻找到既有效又安全的药物候选物。
在获得了药物候选物后,就需要进行药物的评价和筛选。
在这个阶段,研究人员需要对候选物进行一系列的生物学、化学和药理学实验,以评估其活性、毒性、稳定性等性质。
同时,还需要通过动物模型来确定药物的有效剂量和剂型。
如果药物候选物在这个阶段表现良好,那么就可以进入临床试验阶段。
临床试验是新药研发的关键环节。
临床试验的主要目的是评估药物的安全性和有效性,并确定适用于患者的剂量和途径。
临床试验一般分为三个阶段:一期临床试验、二期临床试验和三期临床试验。
一期临床试验主要是对少数健康志愿者进行,主要是评估药物的安全性和耐受性。
二期临床试验扩大了受试者的范围,通常包括数百名患者,并进一步评估药物的安全性和有效性。
三期临床试验是最后一个阶段,通常涉及数千名患者,目的是评估药物的安全性、有效性和真实的临床效果。
如果药物在三期临床试验中表现良好,那么就可以提交新药申请,并进入审批程序。
审批程序是新药研发的最后一个环节。
在提交新药申请后,监管机构会对药物的研发资料进行严格的审查和评估,包括药物的质量、安全性、有效性和生产工艺等。
如果药物能够通过审批程序,就可以获得上市许可证,并在市场上销售和使用。
除了上述的流程,新药研发还面临着许多的挑战和风险。
首先,新药研发的成本非常高昂,旗舰药物的研发成本通常超过10亿美元。