水是常用的溶剂
- 格式:ppt
- 大小:7.85 MB
- 文档页数:45
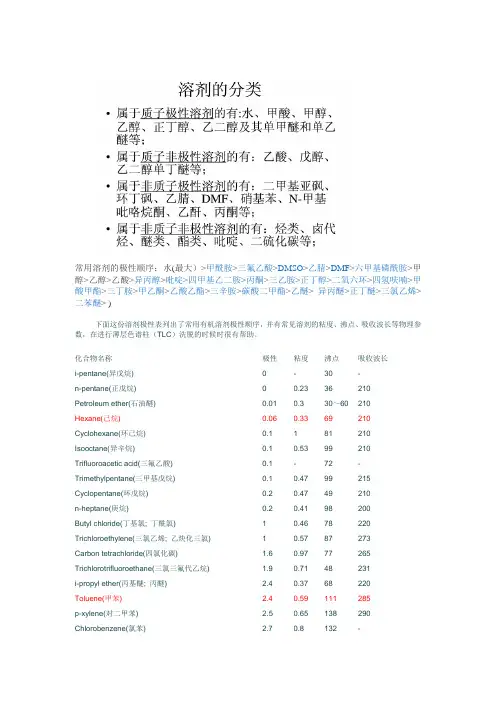
常用溶剂的极性顺序:水(最大)>甲酰胺>三氟乙酸>DMSO>乙腈>DMF>六甲基磷酰胺>甲醇>乙醇>乙酸>异丙醇>吡啶>四甲基乙二胺>丙酮>三乙胺>正丁醇>二氧六环>四氢呋喃>甲酸甲酯>三丁胺>甲乙酮>乙酸乙酯>三辛胺>碳酸二甲酯>乙醚> 异丙醚>正丁醚>三氯乙烯>二苯醚>)下面这份溶剂极性表列出了常用有机溶剂极性顺序,并有常见溶剂的粘度、沸点、吸收波长等物理参数,在进行薄层色谱柱(TLC)洗脱的时候时很有帮助。
化合物名称极性粘度沸点吸收波长i-pentane(异戊烷) 0 - 30 -n-pentane(正戊烷) 0 0.23 36 210Petroleum ether(石油醚) 0.01 0.3 30~60 210Hexane(己烷) 0.06 0.33 69 210 Cyclohexane(环己烷) 0.1 1 81 210Isooctane(异辛烷) 0.1 0.53 99 210 Trifluoroacetic acid(三氟乙酸) 0.1 - 72 - Trimethylpentane(三甲基戊烷) 0.1 0.47 99 215 Cyclopentane(环戊烷) 0.2 0.47 49 210n-heptane(庚烷) 0.2 0.41 98 200Butyl chloride(丁基氯; 丁酰氯) 1 0.46 78 220 Trichloroethylene(三氯乙烯; 乙炔化三氯) 1 0.57 87 273Carbon tetrachloride(四氯化碳) 1.6 0.97 77 265 Trichlorotrifluoroethane(三氯三氟代乙烷) 1.9 0.71 48 231i-propyl ether(丙基醚; 丙醚) 2.4 0.37 68 220Toluene(甲苯) 2.4 0.59 111 285p-xylene(对二甲苯) 2.5 0.65 138 290 Chlorobenzene(氯苯) 2.7 0.8 132 -o-dichlorobenzene(邻二氯苯) 2.7 1.33 180 295Ethyl ether(二乙醚; 醚) 2.9 0.23 35 220Benzene(苯) 3 0.65 80 280Isobutyl alcohol(异丁醇) 3 4.7 108 220Methylene chloride(二氯甲烷) 3.4 0.44 240 245Ethylene dichloride(二氯化乙烯) 3.5 0.78 84 228n-butanol(正丁醇) 3.7 2.95 117 210n-butyl acetate(醋酸丁酯;乙酸丁酯) 4 - 126 254n-propanol(丙醇) 4 2.27 98 210Methyl isobutyl ketone(甲基异丁酮) 4.2 - 119 330 Tetrahydrofuran(四氢呋喃) 4.2 0.55 66 220Ethyl acetate(乙酸乙酯) 4.30 0.45 77 260i-propanol(异丙醇) 4.3 2.37 82 210Chloroform(氯仿) 4.4 0.57 61 245Methyl ethyl ketone(甲基乙基酮) 4.5 0.43 80 330Dioxane(二恶烷; 二氧六环; 二氧杂环己烷) 4.8 1.54 102 220Pyridine(吡啶) 5.3 0.97 115 305Acetone(丙酮) 5.4 0.32 57 330 Nitromethane(硝基甲烷) 6 0.67 101 330Acetic acid(乙酸) 6.2 1.28 118 230Acetonitrile(乙腈) 6.2 0.37 82 210Aniline(苯胺) 6.3 4.4 184 -Dimethyl formamide(二甲基甲酰胺) 6.4 0.92 153 270Methanol(甲醇) 6.6 0.6 65 210Ethylene glycol(乙二醇) 6.9 19.9 197 210Dimethyl sulfoxide(二甲亚砜DMSO) 7.2 2.24 189 268Water(水)10.2 1 100 268 下图是混合有机溶剂极性顺序(由小到大,括号内表示的是混合比例)一:溶剂极性参数表,方便以下比较展开剂。

溶质和溶剂的定义溶质和溶剂是溶液中两个重要的组成部分。
溶质是指能够在溶剂中溶解的物质,而溶剂则是指能够溶解其他物质的介质。
溶质和溶剂的相互作用是溶解过程的基础,也是溶液性质的决定因素之一。
首先我们来了解一下溶质。
溶质可以是固体、液体或气体,它们分散在溶剂中形成溶液。
固体溶质通常是由离子、分子或原子组成的晶体,例如食盐、糖和金属。
液体溶质通常是有机物,如酒精和醋酸。
气体溶质则是通过溶解在液体溶剂中形成的溶液,例如二氧化碳溶解在水中形成的碳酸水。
溶质的溶解度是指单位溶剂中溶质的最大溶解量,它受溶质和溶剂之间相互作用力的影响。
接下来我们来了解一下溶剂。
溶剂是指能够溶解其他物质的介质,通常是液体,例如水、醇类和醚类。
溶剂的选择对溶解过程有着重要的影响,不同的溶剂对不同的溶质有着不同的溶解度。
水是一种常用的溶剂,由于其极性较强,能够溶解许多极性分子和离子。
而非极性溶剂如石油醚和正己烷主要适用于溶解非极性分子。
溶剂的选择还可以根据溶解度、反应性、毒性等因素来进行。
溶质和溶剂之间的相互作用是溶解过程的基础。
在溶解过程中,溶质分子与溶剂分子之间发生相互作用,溶质分子从固体、液体或气体状态转变为分散在溶剂中的溶质分子。
溶质和溶剂之间的相互作用可以通过吸附、解离和溶剂化等方式实现。
溶质分子与溶剂分子之间的相互作用力决定了溶解度和溶液的物理化学性质。
溶质和溶剂的相互作用力可以通过溶质分子与溶剂分子之间的相互作用力来解释。
在溶质溶解过程中,如果溶质与溶剂之间的相互作用力较强,溶质分子更容易与溶剂分子相互吸引和相互作用,溶解过程更容易进行。
相反,如果溶质与溶剂之间的相互作用力较弱,溶质分子更难与溶剂分子相互作用和吸引,溶解过程更困难。
溶质和溶剂的相互作用力还可以通过溶解过程中的热效应来解释。
在溶解过程中,溶质和溶剂之间的相互作用会引起能量的变化。
当溶质溶解于溶剂中时,如果溶液中的总能量较原来的状态更低,则说明溶质和溶剂之间的相互作用力是有利于溶解的。

常用溶剂的沸点
常用溶剂是科研和工业生产中常常用到的,其中沸点是一个很重要的物理性质指标。
下面将对常用溶剂的沸点进行中文介绍。
1. 水(H2O)
水是最常见的溶剂之一,其沸点为100°C,即在常压下水的温度达到100°C时会沸腾。
3. 乙醚(C2H5OC2H5)
4. 氯仿(CHCl3)
7. 氮(N2)
氮是一种气体,其沸点为-195.8°C,即在常压下温度达到-195.8°C时会凝结成液态。
8. 甲苯(C7H8)
10. 氯化钠(NaCl)
总之,了解常用溶剂的沸点可帮助我们更好地选择合适的溶剂进行实验或生产,避免因沸点过低或过高而导致实验或生产失败,也可更好地控制反应条件,提高实验或生产效率和成功率。

1.3水是常见的溶剂一、单选题1.下列有关溶液的说法正确的是( )A. 均一、稳定的液体都是溶液B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液C. 20℃时,10g 水中最多可以溶解3.6g 食盐,所以食盐属于易溶物质D. 25℃时,向100g 质量分数为10%的氯化钠溶液中加入10g 蔗糖粉末,完全溶解后,溶液中氯化钠的质量分数将不变2.下列是关于调节功能的叙述,其中不正确的是( )A. 海洋水可以调节昼夜温差B. 生长素可以调节人的生长C. 温度可以调节许多物质的溶解性大小D. 滑动变阻器可以调节电路的电流大小3. 下列暴露在空气中质量明显增加,溶于水温度明显降低的物质分别是()①氧化钙②硝酸铵③浓盐酸④氯化钠.A. ②③B. ①②C. ①④D. ④②4.20℃时氯化钠的溶解度是36g,则氯化钠属于()A. 易溶物质B. 可溶物质C. 微溶物质D. 难溶物质5.如图是恒温下模拟海水晒盐过程的示意图,从甲到丙可以肯定是饱和溶液的是( )A. 甲B. 乙C. 丙D. 无法判断6.我们日常生活中接触到的溶液中,溶质是单质的是()A. 碘酒B. 汽水C. 食用醋D. 生理盐水7.把少量下列物质分别加入水中,充分搅拌后,不能形成溶液的是()A. 食盐B. 蔗糖C. 酒精D. 花生油8.下表是同学们做溶液形成的实验记录。
以下说法不正确的是( )A. 衣服上不慎沾上碘酒,可用汽油擦洗B. 同一物质在不同溶剂中的溶解性不同C. 水、汽油、酒精都可以作溶剂D. 溶液都是均一、稳定、无色的混合物9.厨房常用的下列物质与水混合,不能形成溶液的是()A. 食盐B. 植物油C. 白糖D. 白酒10.悬浊液、乳浊液和溶液都应是()A. 均一、稳定的B. 澄清、透明的C. 久置不会分层D. 混合物11.将下列物质分别放入足量水中,能形成无色溶液的是()A. 硝酸钾B. 硫酸铜C. 粉笔灰D. 食用油12.现代生活中的饮品各式各样,下列几种常见的饮料中,属于溶液的是( )A. 果汁B. 牛奶C. 矿泉水D. 豆浆二、填空题13.某5克物质(不含结晶水)溶于10克水中,得12克溶液,则溶液中溶质为________克.14.如图是一个概念图,概念图在整理知识时是十分有用的,请在图中空白处填上恰当内容。

色谱专用溶剂
色谱专用溶剂主要用于色谱分析中,作为流动相,帮助分离样品中的各个组分。
以下是一些常见的色谱专用溶剂及其应用:
1. 水:在高效液相色谱(HPLC)中,水是最常用的溶剂,尤其在生物化学和环境分析中。
它可以与许多有机化合物混溶,有助于样品的分离。
2. 甲醇:在气相色谱(GC)和液相色谱(HPLC)中,甲醇是一种常用的强溶剂,尤其适合分离极性化合物。
3. 乙腈:在液相色谱中,乙腈是一种常用的中等强度溶剂,适合分离多种有机化合物。
4. 丙酮:在气相色谱中,丙酮是一种常用的溶剂,特别适合分离含氮和含硫的化合物。
5. 二甲基甲酰胺:在液相色谱中,二甲基甲酰胺是一种常用的强溶剂,尤其适合分离多肽和蛋白质。
6. 醋酸:在液相色谱中,醋酸常被用作添加剂,调节流动相的pH值,影响样品的离子状态,从而实现更好的分离效果。
以上就是一些常见的色谱专用溶剂及其应用。
需要注意的是,选择合适的溶剂需要考虑到样品的性质、分析的目标以及色谱仪的性能等因素。


常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳> 二硫化碳>环己烷>己烷>庚烷>煤油(最小)混合有机溶剂极性顺序(从小到大,括号内为有机溶剂的混合比例)常用溶剂极性在结晶和重结晶纯化化学试剂的操作中,溶剂的选择是关系到纯化质量和回收率的关键问题。
选择适宜的溶剂时应注意以下几个问题:1. 选择的溶剂应不与欲纯化的化学试剂发生化学反应。
例如脂肪族卤代烃类化合物不宜用作碱性化合物结晶和重结晶的溶剂;醇类化合物不宜用作酯类化合物结晶和重结晶的溶剂,也不宜用作氨基酸盐酸盐结晶和重结晶的溶剂。
2. 选择的溶剂对欲纯化的化学试剂在热时应具有较大的溶解能力,而在较低温度时对欲纯化的化学试剂的溶解能力大大减小。
3. 选择的溶剂对欲纯化的化学试剂中可能存在的杂质或是溶解度甚大,在欲纯化的化学试剂结晶和重结晶时留在母液中,在结晶和重结晶时不随晶体一同析出;或是溶解度甚小,在欲纯化的化学试剂加热溶解时,很少在热溶剂溶解,在热过滤时被除去。
4. 选择的溶剂沸点不宜太高,以免该溶剂在结晶和重结晶时附着在晶体表面不容易除尽。
用于结晶和重结晶的常用溶剂有:水、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、氯仿、冰醋酸、二氧六环、四氯化碳、苯、石油醚等。
此外,甲苯、硝基甲烷、乙醚、二甲基甲酰胺、二甲亚砜等也常使用。
二甲基甲酰胺和二甲亚砜的溶解能力大,当找不到其它适用的溶剂时,可以试用。
但往往不易从溶剂中析出结晶,且沸点较高,晶体上吸附的溶剂不易除去,是其缺点。
乙醚虽是常用的溶剂,但是若有其它适用的溶剂时,最好不用乙醚,因为一方面由于乙醚易燃、易爆,使用时危险性特别大,应特别小心;另一方面由于乙醚易沿壁爬行挥发而使欲纯化的化学试剂在瓶壁上析出,以致影响结晶的纯度。




水是常用的溶剂课后作业一、单选题1.厨房常用的下列物质与水混合,不能形成溶液的是()A. 食盐B. 植物油C. 白糖D. 白酒2.小明周六去郊游,出发前到超市买了下列4种饮品,其中属于溶液的是()A. “永和”豆浆B. “娃哈哈”矿泉水C. “美汁源”果粒橙D. “伊利”纯牛奶3.下列有关溶解度的说法正确的有()A. 20℃时,在100克水里溶解了20克甲物质,则在20℃时甲物质的溶解度为20克B. 100克水中溶解40克乙物质刚好达到饱和,则乙物质的溶解度就是40克C. 80℃时在100克丙物质的饱和溶液中含有30克丙物质,则80℃时丙物质的溶解度是30克。
D. 20℃时,在100克水中,最多能溶解30克丁物质,则20℃时丁物质的溶解度为30克4.某同学在探究溶解度的影响因素时。
取两只- -样的透明烧杯,分别倒入相同质量的冷水和热水,然后在冷水和热水中逐渐加入蔗糖,并使之充分溶解直到饱和。
其目的是想研究溶解度与( )A. 溶剂种类的关系B. 温度的关系C. 溶质种类的关系D. 搅拌的关系5.在20℃时,36克食盐溶解在100克水中恰好达到饱和,以下关于食盐的溶解度说法正确的是()A. 食盐的溶解度是100克B. 食盐的溶解度是136克C. 20℃时食盐的溶解度是36克D. 20℃时食盐的溶解度是366.已知20℃时硝酸钾的溶解度为31.6g。
下列关于对它的理解正确的是()A. 100g水中溶解了31.6g硝酸钾固体达到饱和B. 20℃时,31.6g硝酸钾固体溶于水形成饱和溶液C. 20℃时,100g水中最多能溶解31.6g硝酸钾固体D. 20℃时,100g 硝酸钾饱和溶液中含31.6g 硝酸钾7.一定温度下,向如图所示烧杯中加入一定质量的水,仅有部分晶体溶解。
所得溶液与原溶液相比,说法正确的是()A. 溶剂的质量增加,溶液颜色变浅B. 溶质溶解度不变,溶液颜色变深C. 溶质的质量增加,溶液颜色变深D. 溶质溶解度不变,溶液颜色不变8.在室温时,将50g某物质的饱和溶液蒸干,得到0.15g不含结晶水的晶体,则该物质的溶解度等级是A. 易溶物质B. 可溶物质C. 难溶物质D. 微溶物质9.20℃时,氯化钠的溶解度是36g,对此理解错误的是()A. 20℃时,100g水中最多能溶解氯化钠36gB. 20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36(即25∶9)C. 20℃时,100g氯化钠饱和溶液中含水64gD. 20℃时,将36g氯化钠溶于100g水中,所得溶液为氯化钠的饱和溶液10.下列有关溶液的说法中,正确的是()A. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液B. 饱和溶液析出晶体后,就变成了不饱和溶液C. 无色的液体一定是溶液D. 饱和溶液和不饱和溶液在一定条件下可以互相转化11.在20℃时,四种物质分别溶于水里恰好制成饱和溶液,其中溶解度最大的是()A. 3克物质溶解在30克水里B. 100克溶液中含有溶质20克C. 溶质和溶剂的质量比为1:2的溶液D. 1.2克物质溶解在1.5克水里12.生活中的下列现象,不能说明气体的溶解度随温度的升高而减小的是()A. 烧开水时,水沸腾之前有气泡冒出B. 喝下汽水时,感到有气体冲出鼻腔C. 夏季黄昏,池塘里的鱼常跃出水面D. 打开啤酒瓶盖,有大量气泡冒出13.推理是学习化学常用的思维方法,根据溶液均-性的特点推理,蔗糖溶液应该是( )A. 无色透明B. 混合物C. 上层溶液与下层溶液一样甜D. 水分、温度不变时,蔗糖和水不分离14.下列关于溶液、悬浊液、乳浊液的说法:①溶液一定是无色透明的液体;②溶液是纯净物,而浊液是混合物;③浊液对生产有害无利;④浊液中分散的都是固体小颗粒;⑤浊液都是不均一、不稳定的;⑥在条件不变的情况下,溶液静置多久都不分层;⑦由水和酒精构成的溶液中,酒精既可作溶质,也可作溶剂。
常用溶剂的挥发速度和溶解力参数常用溶剂的挥发速度和溶解力参数概念澄清:常用溶剂是指在实验室和工业生产中经常使用的一类化学品,它们具有良好的溶解能力和挥发性。
在化学实验和工业生产过程中,常用溶剂的挥发速度和溶解力参数对于溶解物质的选择和效果具有重要的影响,并且在化学反应中也扮演着重要的角色。
本文将就常用溶剂的挥发速度和溶解力参数展开深入探讨,并结合个人理解进行解析。
一、常用溶剂的挥发速度1. 乙醇乙醇作为一种常用的溶剂,在化学实验和医药生产中被广泛应用。
其挥发速度较快,容易在常温下蒸发,因此在实验室中需要特别注意其使用。
2. 丙酮丙酮是一种挥发性较快的有机溶剂,其蒸发速度较快,广泛应用于化学实验和工业生产中。
在某些情况下,丙酮的挥发性可以加速化学反应的进行。
3. 氯仿氯仿是一种极具挥发性的有机溶剂,其挥发速度非常快,常常被用于分离提取和化学分析中。
4. 苯苯作为一种常用的溶剂,其挥发速度较快,可以迅速蒸发,但也需要注意在使用时避免其挥发对人体造成的危害。
5. 水水作为一种常用的溶剂,在化学实验和工业生产中使用广泛。
其挥发速度相对较慢,对于一些不需要快速挥发的实验有很好的应用性。
二、常用溶剂的溶解力参数1. 楠酮楠酮具有很强的溶解力,对多种有机物有较好的溶解性,适用于溶解脂肪族和芳香族化合物。
2. 乙醇乙醇作为一种常用溶剂,其溶解力参数适中,可以溶解多种有机物,适用性较广。
3. 丙酮丙酮具有较强的溶解力,可以溶解许多有机物,在化学实验中使用广泛。
4. 苯苯作为一种常用溶剂,其溶解力参数较大,对许多有机物有良好的溶解效果。
5. 水水虽然是一种广泛使用的溶剂,但其溶解力参数较小,对于一些无法溶解在水中的物质需要选择其他溶剂。
三、个人观点和理解就常用溶剂的挥发速度和溶解力参数而言,选择合适的溶剂对于化学实验和工业生产具有至关重要的意义。
在实际应用中,需要根据溶解物质的特性和化学反应的要求选择合适的溶剂,综合考虑挥发速度和溶解力参数。
简述提取成分常用的溶剂常用的溶剂可分为无机溶剂和有机溶剂两大类。
无机溶剂主要由水和一些无机化合物组成,而有机溶剂则是由碳和氢元素构成的有机化合物。
以下将分别介绍几种常用的无机溶剂和有机溶剂。
一、无机溶剂1. 水:水是最常见和广泛应用的溶剂之一。
它的溶解能力强,对许多物质具有良好的溶解性,而且是一种非常安全无毒的溶剂。
由于水的极性较大,因此它对极性物质的溶解能力较强,如盐、酸、碱等。
2. 醇类:醇类溶剂常用的有乙醇、异丙醇等。
它们具有较好的溶解能力和挥发性,广泛应用于化学实验、药物制备、油墨、涂料等领域。
3. 酸:酸类溶剂如硫酸、盐酸等,常用于一些特定的化学反应中,如酸碱中和反应、酸催化反应等。
酸具有较强的腐蚀性和刺激性,使用时需注意安全。
二、有机溶剂1. 烃类:烃类溶剂是最简单的有机溶剂,如石油醚、正己烷等。
它们具有挥发性和溶解力较强的特点,常用于溶解脂类、树脂、橡胶等物质。
2. 酮类:酮类溶剂如丙酮、甲酮等,具有极性较强的特点,可溶解许多极性物质,常用于化学实验、溶剂萃取等领域。
3. 醚类:醚类溶剂如乙醚、二甲醚等,具有较好的溶解能力和挥发性,常用于溶解脂类、树脂等物质。
4. 酯类:酯类溶剂如乙酸乙酯、甲酸甲酯等,具有良好的溶解力和挥发性,广泛应用于涂料、油墨、塑料等领域。
除了以上介绍的常用溶剂外,还有一些特殊的溶剂常用于特定的领域,如酮醇溶剂常用于有机合成反应中,氨溶剂常用于金属表面处理等。
在选择溶剂时,需要根据溶质的性质、反应条件、安全性等因素综合考虑,以确保溶剂的选择合适,并且能够达到预期的效果。
总结起来,常用的溶剂主要包括无机溶剂和有机溶剂两大类,其中无机溶剂常用的有水、醇类和酸类溶剂,有机溶剂常用的有烃类、酮类、醚类和酯类溶剂。
在实际应用中,根据不同的需求和条件选择合适的溶剂是非常重要的。