实验一 蛋白质的两性性质和酪蛋白等电点的测定
- 格式:docx
- 大小:21.54 KB
- 文档页数:5


酪蛋白等电点的测定实验报告一、实验目的1、掌握测定酪蛋白等电点的原理和方法。
2、熟悉使用酸度计测量溶液 pH 值的操作。
3、加深对蛋白质两性解离性质的理解。
二、实验原理蛋白质是两性电解质,在一定的 pH 条件下,其解离成正离子和负离子的程度相等,此时溶液的 pH 值称为该蛋白质的等电点(pI)。
当溶液的 pH 低于蛋白质的等电点时,蛋白质带正电荷;当溶液的 pH 高于蛋白质的等电点时,蛋白质带负电荷。
酪蛋白是牛奶中的主要蛋白质之一,其等电点约为 47。
在等电点时,酪蛋白溶解度最小,容易沉淀析出。
本实验通过调节溶液的 pH 值,观察酪蛋白的沉淀情况,从而确定其等电点。
三、实验材料与仪器1、材料新鲜牛奶、01mol/L 盐酸、01mol/L 氢氧化钠、1%乙酸、95%乙醇。
2、仪器酸度计、离心机、玻璃棒、烧杯(50ml、100ml)、量筒(10ml、50ml)、移液管(1ml、5ml)、滴管、pH 试纸。
四、实验步骤1、制备酪蛋白粗提液(1)取新鲜牛奶 20ml 于 100ml 烧杯中,加热至 40℃,边搅拌边慢慢加入 10ml 1%乙酸,使牛奶中的酪蛋白沉淀。
(2)用四层纱布过滤上述混合液,收集沉淀,用少量蒸馏水洗涤沉淀 2-3 次,以除去其中的水溶性杂质。
(3)将沉淀转移至50ml 烧杯中,加入20ml 95%乙醇,搅拌均匀,静置 5 分钟,使酪蛋白充分沉淀。
(4)用离心机以 3000r/min 离心 5 分钟,弃去上清液,得到酪蛋白沉淀。
2、测定酪蛋白等电点(1)将上述沉淀用少量蒸馏水溶解,转移至 50ml 容量瓶中,定容至刻度,摇匀,得到酪蛋白溶液。
(2)用移液管吸取 1ml 酪蛋白溶液于 50ml 小烧杯中,加入 40ml蒸馏水,用酸度计测量溶液的初始 pH 值。
(3)用滴管逐滴加入01mol/L 盐酸溶液,同时搅拌,每次加05ml,加完后用酸度计测量溶液的 pH 值,直至溶液出现混浊,记录此时的pH 值。

实验一蛋白质的两性性质和酪蛋白等电点的测定实验一蛋白质的两性性质和酪蛋白等电点的测定一、实验目的与要求1.掌握蛋白质的两性解离性质;2.熟练掌握测定蛋白质等电点的基本方法。
二、实验原理蛋白质是由氨基酸组成的高分子化合物。
虽然大多数的α-氨基和α-羧基成肽键结合,但仍有N末端的氨基和C末端的羧基存在,同时侧链上还有一些可解离基团。
因此,蛋白质和氨基酸一样是两性电解质。
调节蛋白质溶液的pH,可使蛋白质带上正电荷或负电荷;在某一pH时,其分子中所带的正电荷和负电荷相等,此时溶液中蛋白质以兼性离子形式存在。
在外加电场中蛋白质分子既不向正极移动也不向负极移动,此时溶液的pH 称为该蛋白质的等电点,蛋白质的溶解度最小。
不同的蛋白质,因氨基酸的组成不同有不同的等电点。
三、实验材料、试剂与仪器1.材料与试剂NaOH、HCl、乙酸、溴甲酚绿、酪蛋白、精密pH试纸等。
0.5 %酪蛋白溶液:0.5 g酪蛋白,先加入几滴1 mol/L的NaOH使其湿润,用玻璃棒搅拌研磨使成浆糊状,逐滴加入0.01 mol/L的NaOH使其完全溶解后定容到100 mL.酪蛋白—乙酸钠溶液:将0.25 g酪蛋白加5 mL 1 mol/L的NaOH溶解,加20 mL水温热使其完全溶解后,再加入5 mL 1 mol/L的乙酸,混合后转入50 mL的容量瓶内,加水到刻度,混匀备用(pH应为8~8.5);0.01%的溴甲酚绿溶液:将0.01g溴甲酚绿溶解于100mL含有0.57mL0.1mol/LNaOH的水中。
该指示剂的变色范围是:酸性(pH3.8)为黄色,pH5.4为蓝色;0.02 mol/L的HCl溶液:将0.8 mL浓盐酸用蒸馏水稀释到480 mL即可;0.02 mol/L的NaOH溶液:将0.8 g NaOH溶解于100 mL水中,最终加入到1000 mL;0.1 mol/L的乙酸溶液:将1 mL冰醋酸用水稀释到170 mL;0.01 mol/L的乙酸溶液:将0.1 mL冰醋酸用水稀释到170 mL;1 mol/L的乙酸溶液:1 mL冰醋酸(17 mol/L)加水到17 mL即可。
实验一 蛋白质的两性电离和等电点的测定【目的】验证蛋白质的两性电离与等电点性质。
【原理】蛋白质由氨基酸组成。
蛋白质分子除两端游离的氨基和羧基可解离外,其侧链上的某些酸性基团或碱性基团,在一定的溶液pH 条件下,都可解离成带负电荷或带正电荷的基团。
因此,蛋白质具有两性解离性质。
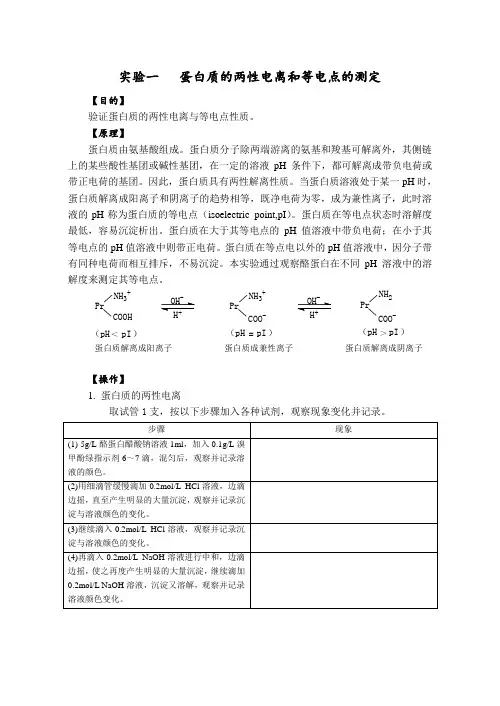
当蛋白质溶液处于某一pH 时,蛋白质解离成阳离子和阴离子的趋势相等,既净电荷为零,成为兼性离子,此时溶液的pH 称为蛋白质的等电点(isoelectric point,pI )。
蛋白质在等电点状态时溶解度最低,容易沉淀析出。
蛋白质在大于其等电点的pH 值溶液中带负电荷;在小于其等电点的pH 值溶液中则带正电荷。
蛋白质在等点电以外的pH 值溶液中,因分子带有同种电荷而相互排斥,不易沉淀。
本实验通过观察酪蛋白在不同pH 溶液中的溶解度来测定其等电点。
>pI (pH )pI (pH )=pI <(pH )PrNH 3+COO -PrNH 3+COOHPrNH 2COO -蛋白质解离成阳离子 蛋白质成兼性离子 蛋白质解离成阴离子【操作】1. 蛋白质的两性电离取试管1支,按以下步骤加入各种试剂,观察现象变化并记录。
.;. 2. 酪蛋白等电点的测定取试管5支,编号后按下表的顺序准确地加入各种试剂并混匀。
静置室温20分钟后观察各管沉淀出现情况,并以-,+,++,+++,++++符号记录沉淀的多少。
【思考题】1.为什么说蛋白质是两性电离电解质,何谓蛋白质的等电点?2. 在等电点状态下,为什么蛋白质容易发生沉淀?3. 本实验中酪蛋白处于等电点时则从溶液中沉淀析出,由此得出蛋白质在等电点时必然沉淀,此结论对吗,为什么?。


实验一 蛋白质的两性性质及等电点的测定一 实验目的通过实验了解蛋白质的两性性质和等电点的意义及与蛋白质分子聚沉的关系。
二 实验原理蛋白质是由许多氨基酸组成的,故也是两性电解质。
蛋白质分子中可以解离的基团除末端a -氨基与羧基外,还有肽链上氨基酸残基的侧链基团,如非a -羧基及氨基、胍基、咪唑基等基团,它们都能解离成带电基团。
因此,蛋白质分子与氨基酸一样,在酸性溶液中作碱性解离,成为带正电荷的阳离子,在碱性溶液中作酸性解离,成为带负电荷的阴离子。
RNH 3+RCOONH 3+RCOO H 2NOHOH在一定氢离子浓度时,蛋白质分子的酸性解离与碱性解离相等,成为中性颗粒,所带正负电荷相等,净电荷为零,此时溶液的pH 值称为蛋白质的等电点(pI )。
在等电点时蛋白质分子在电场中既不向阴极移动,也不向阳极移动。
而且分子间因碰撞而引起聚沉的倾向增加。
所以此时蛋白质溶解度最小,若再加入乙醇、丙酮等试剂与蛋白质分子争夺水分子,减低了蛋白质分子外水化膜的厚度,而使浑浊度增加,蛋白质等电点与所含氨基酸种类和数量有关。
若蛋白质含酸性氨基酸多,则等电点多略酸性,如胃蛋白酶的等电点为pH1左右,也有一些蛋白质含碱性氨基酸多,则等电点偏碱性。
如鱼精蛋白等电点为pH12.0-12.4,含酸性和碱性氨基酸残基数目相近的蛋白质,其等电点为中性偏酸约5左右。
本实验采用酪蛋白在不同pH 溶液中形成的混浊度来确定其等电点,即混浊度最大的溶液pH 值为该种蛋白质的等电点。
三 实验设备(1) 试管架 1个(2) 吸管 1mL 2支 ;2mL 1支 ;5mL 1支;10mL 1支 (3) 试管 1.5×15mL 10支 (4) 滴管 2支四 实验试剂(1)1mol/L 醋酸溶液:量取99.5%醋酸(比重1.05)2.875 mL ,加水至50 mL 。
(2)0.1mol/L 醋酸溶液:量取1mol/L 醋酸5 mL ,加水至50 mL 。


蛋白质两性性质及等电点的测定蛋白质是生物体中极其重要的有机化合物,是构成生物体的基本组成部分之一。
蛋白质具有很多种类和功能,不同的蛋白质在生物体内发挥着不同的作用。
蛋白质的性质也因其结构而异,其中包括两性性质和等电点。
本文将介绍蛋白质的两性性质及等电点的测定。
一、蛋白质的两性性质蛋白质是由多肽链组成的,其分子中含有氨基酸残基。
这些氨基酸残基中的羧基(-COOH)和氨基(-NH2)可以参与酸碱反应,所以蛋白质具有两性性质,能够在不同的pH值下呈现不同的电离状态。
1. 在低pH值下,蛋白质中的羧基处于质子化状态,成为正电荷,而氨基则不受质子化,保持中性。
因此,在低pH值时,蛋白质呈正电荷状态,称为阳离子。
2. 在高pH值下,蛋白质中的氨基受到氢离子的质子化,成为正电荷,而羧基则不受质子化,保持中性。
因此,在高pH值时,蛋白质呈负电荷状态,称为阴离子。
3. 在等电点附近,蛋白质的质子化和去质子化同时发生,羧基和氨基的质子化程度相等,呈中性状态。
此时,蛋白质没有净电荷,称为等电点。
由于蛋白质的两性性质,可以影响其溶解性、折叠构象和相互作用等特性,对其功能和生物学作用具有重要影响。
二、蛋白质等电点的测定等电点是蛋白质具有中性状态的pH值。
测定蛋白质的等电点可以帮助我们了解其溶解性、电动力学性质和酸碱加工过程中的变化。
常用的测定等电点的方法有以下几种:1. pH梯度电泳法:这是一种常用且广泛应用的测定等电点的方法。
在一个pH梯度上进行电泳,当蛋白质离子迁移速率和电场力相等时,达到等电点。
可以通过在梯度上观察蛋白质带的形成和移动情况来确定等电点。
2. 等电聚焦电泳法:这是一种利用电场作用下蛋白质在凝胶上垂直移动的方法,根据蛋白质在凝胶中的移动速率和电场力相等时的pH值来测定等电点。
3. 等电点电位计法:该方法利用等电点时蛋白质没有净电荷的特性,使用电位计测量蛋白质在不同pH值下的电位变化,找出没有净电荷时的pH值,即为等电点。


蛋白质等电点测定实验报告一、实验目的1、掌握蛋白质等电点的测定方法。
2、加深对蛋白质两性解离性质的理解。
二、实验原理蛋白质是两性电解质,在溶液中会发生解离。
当蛋白质溶液处于某一 pH 值时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的 pH 值称为该蛋白质的等电点(pI)。
在等电点时,蛋白质的溶解度最小,容易沉淀析出。
利用不同 pH 值下蛋白质溶解度的变化,可以测定蛋白质的等电点。
本实验采用蛋白质在不同 pH 值溶液中的溶解度变化来测定其等电点。
通过向蛋白质溶液中逐滴加入酸或碱,调节溶液的 pH 值,并观察蛋白质沉淀出现和消失的情况,从而确定蛋白质的等电点范围。
三、实验材料与仪器1、实验材料酪蛋白2、实验试剂04mol/L 醋酸溶液01mol/L 醋酸溶液1mol/L 醋酸溶液01mol/L 氢氧化钠溶液3、实验仪器试管移液管刻度吸管离心机722 型分光光度计四、实验步骤1、制备蛋白质溶液称取 05g 酪蛋白,加入 50ml 蒸馏水,在 50℃左右的水浴中加热溶解,搅拌均匀,得到酪蛋白溶液。
2、调节 pH 值取 9 支干燥洁净的试管,编号 1-9。
按照表 1 向各试管中加入不同体积的试剂,以调节溶液的 pH 值。
|试管编号|1|2|3|4|5|6|7|8|9||||||||||||04mol/L 醋酸溶液(ml)|40|35|30|25|20|15|10|05|0||01mol/L 醋酸溶液(ml)|0|05|10|15|20|25|30|35|40||1mol/L 醋酸溶液(ml)|0|0|0|0|0|0|0|0|06||01mol/L 氢氧化钠溶液(ml)|0|0|0|0|0|0|0|0|04|3、加入蛋白质溶液向各试管中分别加入 1ml 酪蛋白溶液,摇匀,静置 10 分钟。
4、观察沉淀情况观察各试管中溶液的混浊度,判断是否有沉淀生成。
将观察结果记录在表 2 中。
【精品】实验1:蛋白质的两性电离和等电点实验原理:蛋白质由多个氨基酸连接而成,每个氨基酸都有两个离子化的官能团:氨基(NH2)和羧基(COOH)。
当氨基酸中的氨基失去一个质子(H+)后,形成正离子;当羧基失去一个质子后,形成负离子。
因此,氨基酸可以被视为一个带有离子性的分子,它的离子化程度受pH 值的影响。
对于一个蛋白质分子而言,它的离子化程度与pH值有关,当pH值升高时,蛋白质分子中的氨基越来越少地被质子化,羧基越来越多地被离子化,所以整个蛋白质分子的电荷量逐渐变小,反之亦然。
当一个蛋白质分子的电荷量为0时,称之为该蛋白质的等电点(pI)。
实验步骤:1. 将pH计校准至标定点,即pH 4.0和pH 10.0。
2. 在烧杯中加入1 mL的Pepsin酶溶液,加入100 mL的pH 2.0的盐酸缓冲液。
4. 在两组烧杯中,加入0.02%的溴酚蓝指示剂。
5. 在烧杯中加入一小块鱼肉,加满盐酸缓冲液至50 mL。
7. 在两组烧杯中,用烧杯中的pH计调节 pH值,使溴酚蓝指示剂变色。
8. 记录此时的pH值,作为该物质的等电点(pI)。
实验结果和分析:鱼肉的等电点(pI)为4.3,毛发的等电点(pI)为5.9。
说明鱼肉中的氨基酸比毛发中的氨基酸更容易被质子化,因此,在低pH值下,鱼肉带有更多的正电荷。
反之,在高pH值下,毛发带有更多的负电荷。
实验中,采用溴酚蓝指示剂来检测溶液的pH值,其变色区间为pH 3.0~pH 5.0(黄色)和pH 6.0~pH 7.6(蓝色)。
因此,在调节pH值时,需注意溴酚蓝指示剂的变色范围,以免影响结果的准确性。
结论:蛋白质具有两性电离特性,其离子化程度受pH值的影响。
当一个蛋白质的电荷量为0时,称之为该蛋白质的等电点(pI)。
通过实验测定,可以了解不同蛋白质样品的两性电离特性和等电点。
实验一蛋白质的两性电离和等电点的测定仅供学习与交流,如有侵权请联系网站删除 谢谢2第三章 实验内容实验一 蛋白质的两性电离和等电点的测定【目的】验证蛋白质的两性电离与等电点性质。
【原理】蛋白质由氨基酸组成。
蛋白质分子除两端游离的氨基和羧基可解离外,其侧链上的某些酸性基团或碱性基团,在一定的溶液pH 条件下,都可解离成带负电荷或带正电荷的基团。
因此,蛋白质具有两性解离性质。
当蛋白质溶液处于某一pH 时,蛋白质解离成阳离子和阴离子的趋势相等,既净电荷为零,成为兼性离子,此时溶液的pH 称为蛋白质的等电点(isoelectricpoint,pI )。
蛋白质在等电点状态时溶解度最低,容易沉淀析出。
蛋白质在大于其等电点的pH 值溶液中带负电荷;在小于其等电点的pH 值溶液中则带正电荷。
蛋白质在等点电以外的PH 值溶液中,因分子带有同种电荷而相互排斥,不易沉淀。
本实验通过观察酪蛋白在不同pH 溶液中的溶解度来测定其等电点。
>pI (pH )pI (pH )=pI <(pH )PrNH 3+COO -PrNH 3+COOHPrNH 2COO -蛋白质解离成阳离子 蛋白质成兼性离子 蛋白质解离成阴离子【器材】试管、试管架、滴管、刻度吸管。
【试剂】1. 5g/L 酪蛋白醋酸钠溶液称取纯酪蛋白0.5g,加蒸馏水40ml及1.00mol/LNaOH溶液10.0ml,振荡使酪蛋白溶解,然后加入1.00mol/L醋酸溶液10ml,混匀后倒入100ml容量瓶中,用蒸馏水稀释至刻度,混匀。
2. 0.1g/L溴甲酚绿指示剂该指示剂变色范围为pH 3.8~5.4。
指示剂的酸色型为黄色,碱色型为蓝色。
3. 0.02mol/L HCl溶液4. 0.02mol/L HaOH溶液5. 1.00mol/L 醋酸溶液6. 0.10mol/L 醋酸溶液7. 0.01mol/L 醋酸溶液【操作】1.蛋白质的两性电离(1)取试管1支,加入5g/L酪蛋白醋酸钠溶液1ml,0.1g/L溴甲酚绿指示剂6~7滴,混匀后,观察并记录溶液的颜色。
蛋白质的两性反应实验报告一、实验目的1、了解蛋白质的两性解离性质。
2、掌握蛋白质两性反应的实验操作和现象观察。
二、实验原理蛋白质是由氨基酸组成的大分子化合物,其分子中同时含有可解离的酸性基团(如羧基 COOH)和碱性基团(如氨基 NH₂)。
在一定的pH 条件下,蛋白质会发生解离,使其分子带上正电荷或负电荷。
当溶液的 pH 达到某一特定值时,蛋白质所带的正电荷和负电荷数量相等,此时蛋白质的净电荷为零,这个 pH 值称为蛋白质的等电点(pI)。
在等电点以上的 pH 环境中,蛋白质解离成阴离子,带负电荷;在等电点以下的 pH 环境中,蛋白质解离成阳离子,带正电荷。
因此,通过调节溶液的 pH,可以观察到蛋白质的两性反应。
三、实验材料与设备1、实验材料鸡蛋清溶液04%酪蛋白乙酸钠溶液1%醋酸溶液01mol/L 盐酸溶液01mol/L 氢氧化钠溶液001%溴甲酚绿指示剂广泛 pH 试纸2、实验设备试管滴管移液管离心机四、实验步骤1、蛋白质的两性反应取 4 支试管,编号为 1、2、3、4。
向 1 号试管中加入 2mL 鸡蛋清溶液,滴加 2 滴 01mol/L 盐酸溶液,边加边振荡,观察溶液的变化。
向 2 号试管中加入 2mL 鸡蛋清溶液,滴加 2 滴 01mol/L 氢氧化钠溶液,边加边振荡,观察溶液的变化。
向 3 号试管中加入 2mL 04%酪蛋白乙酸钠溶液,滴加 2 滴 1%醋酸溶液,边加边振荡,观察溶液的变化。
向 4 号试管中加入 2mL 04%酪蛋白乙酸钠溶液,滴加 2 滴 01mol/L 氢氧化钠溶液,边加边振荡,观察溶液的变化。
2、蛋白质等电点的测定取 5 支试管,编号为 5、6、7、8、9。
向 5 号试管中加入 4mL 04%酪蛋白乙酸钠溶液。
向 6 号试管中加入 2mL 04%酪蛋白乙酸钠溶液和 2mL 01mol/L 盐酸溶液,摇匀。
向 7 号试管中加入 2mL 04%酪蛋白乙酸钠溶液和 2mL 01mol/L 氢氧化钠溶液,摇匀。
实验一蛋白质的两性性质和酪蛋白等电点的测定
一、实验目的与要求
1.掌握蛋白质的两性解离性质;
2.熟练掌握测定蛋白质等电点的基本方法。
二、实验原理
蛋白质是由氨基酸组成的高分子化合物。
虽然大多数的α-氨基和α-羧基成肽键结合,但仍有N末端的氨基和C末端的羧基存在,同时侧链上还有一些可解离基团。
因此,蛋白质和氨基酸一样是两性电解质。
调节蛋白质溶液的pH,可使蛋白质带上正电荷或负电荷;在某一pH时,其分子中所带的正电荷和负电荷相等,此时溶液中蛋白质以兼性离子形式存在。
在外加电场中蛋白质分子既不向正极移动也不向负极移动,此时溶液的pH 称为该蛋白质的等电点,蛋白质的溶解度最小。
不同的蛋白质,因氨基酸的组成不同有不同的等电点。
三、实验材料、试剂与仪器
1.材料与试剂
NaOH、HCl、乙酸、溴甲酚绿、酪蛋白、精密pH试纸等。
0.5 %酪蛋白溶液:
0.5 g酪蛋白,先加入几滴1 mol/L的NaOH使其湿润,用玻璃棒搅拌研磨使成浆糊状,逐滴加入
0.01 mol/L的NaOH使其完全溶解后定容到100 mL.酪蛋白—乙酸钠溶液:将0.25 g酪蛋白加5 mL 1 mol/L的NaOH溶解,加20 mL水温热使其完全溶解后,再加入5 mL 1 mol/L的乙酸,混合后转入50 mL的容量瓶内,加水到刻度,混匀备用(pH应为8~
8.5);
0.01%的溴甲酚绿溶液:将0.01g溴甲酚绿溶解于100mL含有
0.57mL
0.1mol/LNaOH的水中。
该指示剂的变色范围是:
酸性(pH
3.8)为黄色,pH
5.4为蓝色;
0.02 mol/L的HCl溶液:将0.8 mL浓盐酸用蒸馏水稀释到480 mL即可;
0.02 mol/L的NaOH溶液:将0.8 g NaOH溶解于100 mL水中,最终加入到1000 mL;
0.1 mol/L的乙酸溶液:
将1 mL冰醋酸用水稀释到170 mL;
0.01 mol/L的乙酸溶液:将0.1 mL冰醋酸用水稀释到170 mL;
1 mol/L的乙酸溶液:1 mL冰醋酸(17 mol/L)加水到17 mL即可。
2.仪器
试管、滴管、移液管、pH试纸等。
四、实验方法与步骤
1.蛋白质的两性反应
1)取一支干净的试管,加入20滴
0.5 %的酪蛋白溶液,逐滴加入
0.01 %的溴甲酚绿溶液(约5~7滴),充分混合,观察溶液的颜色并解释(蓝色)。
2)逐滴加入
0.02 mol/L的HCl,随加随摇动试管,直到出现明显的沉淀为止,用精密pH 试纸测溶液的pH,观察溶液的颜色变化。
3)继续加入
0.02 mol/L的HCl,观察沉淀的变化和溶液颜色的变化。
4)逐滴加入
0.02 mol/L的NaOH到上面的溶液中,使溶液的pH接近中性,观察沉淀是否形成。
5)继续滴加
0.02 mol/L的NaOH,观察沉淀的变化。
2.酪蛋白等电点的测定
1)取9只试管分别编号1~
9.
2)按下表向每管中加入试剂。
注意,每种试剂加完后,要振荡试管。
3)试剂全部加完后,静置20 min。
4)观察每管内溶液的混浊度,用“+”、“-”表示沉淀的多少。
5)判断酪蛋白的pI是多少?
试管号9水/mL
2.4
3.2—
2.0
3.0
3.5
1.5
2.75
3.381 mol/L
HAc/mL
1.6
0.8———————0.1mol/L HAc/mL——
4.0
2.0
1.0
0.5———0.01 mol/L酪蛋白醋酸HAc/mL——————
2.5
1.25
0.62钠溶液/mL
1溶液最终的
pH
3.5
3.8
4.1
4.4
4.7
5.0
5.3
5.6
5.9沉淀多少
五、思考题
1.何谓蛋白质的等电点?在等电点时蛋白质的溶解度最低,为什么?
2.本实验中,根据蛋白质的何种性质测定其等电点?
3.测定蛋白质等电点为什么应在缓冲液中进行?。