(新课标)2015届高考化学大一轮复习讲义 第六章 第2讲 原电池 化学电源课件
- 格式:ppt
- 大小:9.40 MB
- 文档页数:142




![高考化学一轮复习课件第6章 第2讲原电池 化学电源(人教版)[ 高考]](https://uimg.taocdn.com/ba97f45d16fc700aba68fc08.webp)



Big new dream第 2 讲原电池化学电源[ 考纲要求 ] 1. 了解原电池的工作原理,能写出电极反应和电池反应方程式。
2. 了解常见化学电源的种类及其工作原理。
考点一原电池及其工作原理1.概念把化学能转化为电能的装置。
2.工作原理以锌铜原电池为例电极名称负极正极电极材料锌片铜片电极反应Zn- 2e- ===Zn2+Cu2++ 2e-===Cu反应类型氧化反应还原反应电子流向由 Zn 沿导线流向Cu+-3.原电池的构成条件(1) 一看反应:看是否有能自发进行的氧化还原反应发生( 一般是活泼性强的金属与电解质溶液反应) 。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。
题组一原电池工作原理的考查1.下列装置中能构成原电池产生电流的是()Big new dream答案B解析 A 项,电极相同不能构成原电池; C 项,酒精不是电解质溶液,不能构成原电池; D 项,锌与电解质溶液不反应,无电流产生。
2.有关电化学知识的描述正确的是() A.CaO+ H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能B.某原电池反应为Cu+2AgNO3===Cu(NO3) 2+ 2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液C.原电池的两极一定是由活动性不同的两种金属组成D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池答案D解析 CaO+ H2O===Ca(OH)2不是氧化还原反应, KCl 和 AgNO3反应生成 AgCl 沉淀易阻止原电池反应的发生;作电极的不一定是金属,如石墨棒也可作电极。
规避原电池工作原理的 4 个易失分点(1)只有放热的氧化还原反应才能通过设计成原电池将化学能转化为电能。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。

第2讲原电池化学电源[考纲要求] 1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
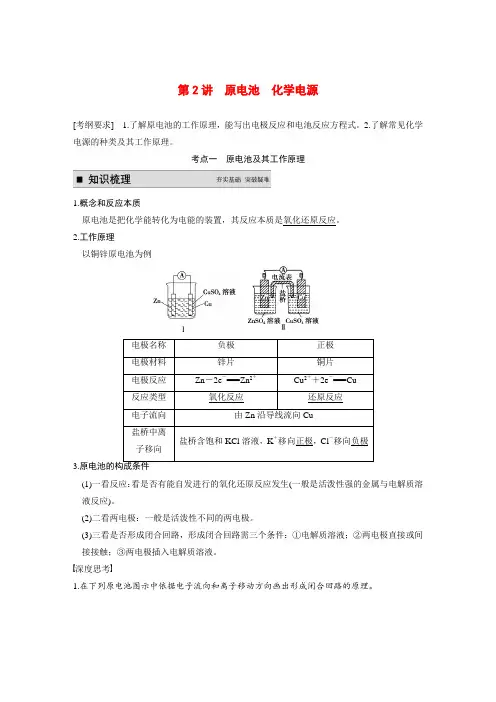
考点一原电池及其工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.工作原理以铜锌原电池为例3.(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。
深度思考1.在下列原电池图示中依据电子流向和离子移动方向画出形成闭合回路的原理。
2.判断正误,正确的划“√”,错误的划“×”(1)在原电池中,发生氧化反应的一极一定是负极()(2)在原电池中,负极材料的活泼性一定比正极材料强()(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应()(4)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长()答案(1)√(2)×(3)×(4)√题组一原电池正、负极的判断1.下列有关原电池的说法中正确的是()A.在内电路中,电子由正极流向负极B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极C.原电池工作时,正极表面一定有气泡产生D.原电池工作时,可能会伴随着热能变化答案 D解析A项,内电路中不存在电子的移动;B项,若是由铝、镁、氢氧化钠溶液构成的原电池,则负极是铝;C项,若是由锌、铜、硫酸铜溶液构成的原电池,则正极表面析出铜,没有气泡产生。
2.分析下图所示的四个原电池装置,其中结论正确的是()A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑答案 B解析②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓HNO3反应失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为2Al+8OH--6e-===2AlO-2+4H2O,二者相减得到正极反应式为6H2O+6e-===6OH-+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e-===4OH-,D错。