大学无机化学化学平衡 ppt课件
- 格式:ppt
- 大小:297.50 KB
- 文档页数:32








大学化学平衡课件一、引言化学平衡是化学反应在一定条件下达到动态平衡状态的现象。
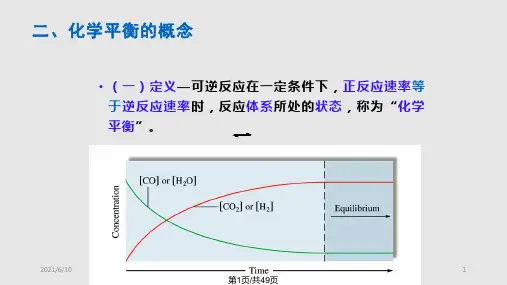
在化学反应中,正反应和逆反应不断进行,当正反应速率等于逆反应速率时,反应体系中各种物质的浓度或含量不再发生变化,达到了化学平衡。
化学平衡是化学反应动力学和热力学共同作用的结果,是化学学科中的重要概念。
二、化学平衡的基本原理1.动力学原理:化学反应速率与反应物浓度有关,正反应速率和逆反应速率随反应物浓度的变化而变化。
当正反应速率等于逆反应速率时,化学反应达到动态平衡。
2.热力学原理:化学反应在一定条件下达到平衡时,体系的自由能最小。
根据吉布斯自由能公式,自由能变化等于焓变减去温度和熵变的乘积。
当自由能变化为零时,化学反应达到平衡。
3.化学平衡常数:化学平衡常数是衡量化学反应平衡状态的重要参数。
对于反应物和物的浓度比为a:b:c的化学反应,化学平衡常数K的表达式为K=[C]^c[D]^d/[A]^a[B]^b,其中[A]、[B]、[C]、[D]分别表示反应物A、B和物C、D的浓度。
三、化学平衡的影响因素1.温度:根据勒夏特列原理,温度升高时,吸热反应的平衡常数增大,放热反应的平衡常数减小。
因此,温度变化会影响化学反应的平衡状态。
2.压力:对于气体参与的反应,压力变化会影响化学反应的平衡状态。
根据勒夏特列原理,压力增大会使平衡向气体体积减小的方向移动,压力减小则会使平衡向气体体积增大的方向移动。
3.浓度:反应物和物的浓度变化会影响化学反应的平衡状态。
增加反应物的浓度会使平衡向物的方向移动,增加物的浓度则会使平衡向反应物的方向移动。
四、化学平衡的移动原理1.勒夏特列原理:当化学反应达到平衡时,若改变反应条件(如温度、压力、浓度等),平衡会向减弱这种改变的方向移动,以达到新的平衡状态。
2.埃尔兰德定理:对于多组分体系,各组分的浓度变化会影响化学反应的平衡状态。
根据埃尔兰德定理,当某一组分的浓度发生变化时,平衡会向减弱这种变化的方向移动。

