人教版九年级化学课题2原子的结构分解
- 格式:ppt
- 大小:3.49 MB
- 文档页数:56
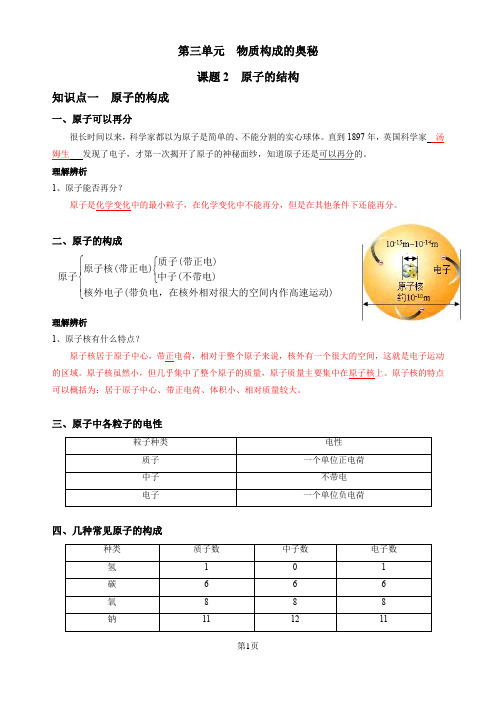
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。

课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。

课题2原子的结构一、教材分析人们通过对微观粒子及其运动特点的不断探究和发现来认识和解释宏观物质的组成、结构、性质和变化规律,已成为化学学科的重要内容和特点,也是现代科学关于物质世界认知的重要成果。
在促进学生科学物质观、正确世界观的形成和发展过程中,具有独特的教育价值和文化传承功能。
在本课中,原子的构成、原子核外电子的排布、离子以及相对原子质量等知识是支撑和构建初中化学知识结构的重要节点。
所以,本课在整个的化学知识体系中作用十分重要。
本课题难点比较集中,有电子的分层排布、离子的形成、原子结构示意图的意义、离子符号和元素最外层电子数与元素性质的关系等。
二、学情分析学生在前面学到的微观知识及课外知识都有限,而本课内容又比较抽象,远离学生的生活经验,初中生又缺乏微观想象力,所以,学生学习起来感到比较困难,会产生一些疑惑,如原子到底是实心还是空心的?原子的质量到底有多大?核外电子的运动规律是怎样的?等等。
在教学中可以自制或借鉴一些微观粒子运动变化的三维动画,这样既能诱发学生想象,加强对知识的理解,又能把抽象内容形象化,增加学生学习知识的兴趣。
三、课时安排本课程共分为二课时:课时1 原子的构成和核外电子的排布课时2 离子相对原子质量课时1 原子的构成和核外电子的排布一、教学目标1.了解原子的构成及构成粒子之间的关系。
2.了解原子结构模型的发展历程,体会模型方法在微观世界研究中的作用。
3.了解原子核外的电子的排布特点,知道原子结构示意图的表示方法,并了解结构与性质的关系。
二、教学重难点重点:构成原子的粒子及相互之间的关系。
难点:核外电子的分层排布和原子结构示意图的意义。
三、教学过程【回顾】通过氧化汞受热分解的微观示意图回顾物质的微观构成——分子和原子。
【过渡】分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。
哪些这些微粒有多小呢?【类比】1.如果将一个原子跟一个乒乓球相比,就相当于将一个乒乓球跟地球相比。



课题2 原子的结构离子例1:钠原子和钠离子的结构示意图如下:请回答:(1)由于它们的原子核内()相同. 所以它们都属于钠元素。
(2)钠原子和钠离子的化学性质()。
(填“相同”或“不相同”)【解析】钠原子和钠离子原子核内都是11个质子,所以它们都属于钠元素,钠原子最外层有一个电子,易失去。
而钠离子最外层有8个电子,达到稳定结构,所以它们的化学性质不相同。
【答案】(l)质子数(2)不相同例2:根据结构示意图回答(1)如果该图表示的是原子,则X值为_____ 。
(2)如果该图表示的是带两个单位正电荷的阳离子,则X值为_____ 。
(3)如果该图表示的是带两个单位负电荷的阴离子,则X值为______ 。
【解析】(1)原子中质子数=核外电子数,x=2+8=10(2)阳离子是原子失去电子后形成的,带2个单位正电荷说明失去了2个电子,则原子中的质子数=阳离子中的电子数+失去的电子数=2+8+2=12;(3)阴离子是原子得到电子后形成的,带2个单位负电荷说明得到了2个电子,则原子中的质子数=阴离子中的电子数-得到的电子数=2+8-2=8;【答案】(l)10 (2)12 (3)8例3:2019年科学家在宇宙深处发现了H3+离子和H3分子。
请回答:(1)1个H3+离子中含有个质子、个电子;(2)构成H3分子的原子的结构示意图是;(填序号)(3)H3属于。
(填“混合物”、“单质”或“化合物”)【解析】本题是对科技新发现“H3+”“H3”的有关化学知识的考查。
该题中,由于1个“H3+”离子中含有3个氢原子核,但又失去了1个电子,故有3个质子和2个电子。
在“H3”分子中,氢原子的核内有一个质子,核外有1个电子,故C正确。
由于“H3”是由同种元素组成的纯净物,故属于单质。
【答案】(l)3、2,(2)C (3)单质例4:科学家已研究出高能微粒N5+,关于它的说法正确的是A. N5+是由5个氮原子构成的单质B. N5+中只有质子没有中子和电子C. 每个N5+中含有35个质子和34个电子D. 每个N5+中含有35个质子和35个电子【解析】N5+是带电的微粒,不是物质,所以A是错的。
知识点讲义——物质构成的奥妙课题2 原子的结构知识点1 原子的构成(重、难点)1.原子的再分很长时间以来,科学家都认为原子是不可分割的、简单的实心体。
知道1897年英国科学家汤姆生发现了电子,才第一次揭开了原子的神秘面纱,原子中还含有更小的粒子——电子,说明原子还可以再分。
2.原子的结构(1)原子尽管很小,用化学方法不能再分,但用其他方法仍可以再分,因为原子也有一定的结构。
原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成的。
原子核是由质子和中子两种粒子构成的。
每个质子带一个单位正电荷质子每个质子的相对质量约等于1原子核(带正电)中子不带电原子(不带电)中子每个中子的相对质量约等于1每个电子带一个单位负电荷电子(带负电)电子质量很小,约为质子或中子质量的1/1836【注】①由原子构成的物质包括稀有气体、金属单质、金刚石、硅等,其化学性质由原子保持。
如氦气的化学性质由氦原子保持,铁的化学性质由铁原子保持。
②原子核位于原子中心,体积很小,如果把原子比作一个庞大的体育场,而原子核只相当于位于体育场中心的一只蚂蚁。
原子里有很大的空间,电子就在这个空间里做高速运动。
(2)原子中,一个质子带一个单位正电荷,一个电子带一个单位负电荷,中子不带电,原子核所带电荷由质子提供,所以原子核所带正电荷数目(简称核电荷数)等于核内质子数。
(3)在原子中,原子核所带正电荷的总数(即核内质子数)和核外电子数的总数相等,电量相等,电性相反,因而整个原子对外不显电性,可概括为:在原子中,核电荷数=质子数=核外电子数。
【注】①每个原子只有一个原子核,核电荷数(核内质子数)的多少决定了原子的种类,所以同一类原子,其核内质子数相同,不同类的原子,其核内质子数不同。
②原子核内中子数不一定对于质子数,如铁原子中质子数为26,中子数为30。
③并不是所有的原子中都有中子,如氢原子中就没有中子。
④电子的质量很小,约为质子或中子质量的1/1836,故原子的质量主要集中在原子核上。
课题二、 原子的结构一、原子的构成1. 原子的构成 电子层原子核原子一般是由质子、中子和电子构成,并非所有的原子都有中子,质子数也不一定等于中子数。
2. 在原子中,核电荷数=核内质子数=核外电子数=原子序数由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
3. 原子核直径是原子直径的几万分之一,原子不是实心球体,核外有一个很大的空间,核外电子就在这个空间内高速运动。
4. 原子的种类由核电荷数(核内质子数)决定。
二、原子核外电子的排布A 、在含有多个电子的原子里,电子的能量并不相同,能量低的电子通常在离核较近的原子(不带电)原子核(带正电)核外电子(每个电子带一个单位负电荷)质子(每个质子带一个单位正电荷)中子(不带电)原子核—原子==蚂蚁(中心) — 体育场原子—乒乓球==乒乓球—地球区域运动,能量高的通常在离核较远的区域运动。
核外电子根据其能量的高低在不同的电子层内运动,这就是核外电子的分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。
电子层序数越大,层内电子的能量越大,离原子核距离越远。
B、排布规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才排第二层,第二层排满才排第三层;②每个电子层最多能容纳2n2个电子。
(n为电子层序数,第一层n=1,第二层n=2)③最外层电子数不超过8个(第一层为最外层时,不超过2个)。
原子结构示意图:氯原子的原子结构示意图画出周期表中前三个周期元素的原子结构示意图相对稳定结构:稀有气体化学性质比较稳定,不易与其他物质发生化学反应,他们的原子最外层电子数都是8个(氦2个),这样的结构叫相对稳定结构。
三、离子的形成●常见元素名称、元素符号H He Li Be B , C N O F Ne ,氢氦锂铍硼碳氮氧氟氖Na Mg Al Si P ,S Cl A r K Ca钠镁铝硅磷硫氯氩钾钙。
Mn Fe Zn Ag Ba I Hg Cu Sn Pb P t Au锰铁锌银钡碘汞铜锡铅铂金●离子的形成:带电的原子或原子团叫做离子。