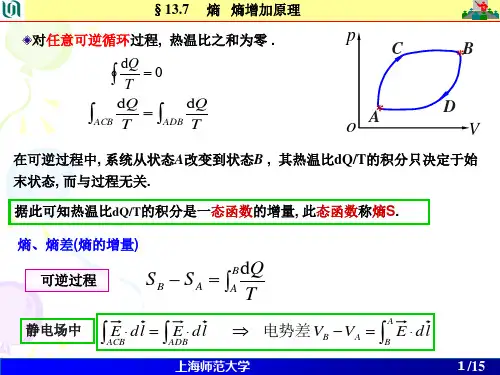
2
1、热力学第三定律的经典表述
①能斯特说法:随着绝对温度趋于零, W H Nernst (1864-1941) 德国化学家和物理学家
凝聚系统等温反应的熵变趋于零。
②普朗克说法:凝聚态纯物质在0 K 时的熵值为零。
③路易斯和吉布森修正为:纯物质的 完美晶体在0K时的熵值为零。
(晶体中原子或分子只有一种排列形式)
Sm (B,T )
T δQr,m 0K T
Sm(B,T):物质B在温度T时的规定摩尔熵,也叫 绝对熵。
Sm(B,相态,T):温度T、标准态 (p=100kPa) 下物质B的规定摩尔熵,称标准摩尔熵。
Sm(B,相态, 298 K):指物质B在温度298.15 K 的标准摩尔熵,可查表(附录IV)。
6
273K
T
vapH m 373 K
473K
dT
C p,m (H 2O, g)
373K
T
15 K以下,用德拜理论公式计算Cp,m≈CV,m=T3
4、化学反应的标准摩尔熵变
对于化学反应 aA+bB == yY+zZ
r
Sm
(T
)
B
m
(B,
T
)
rSm(T )
ySm(Y,T )
zS
m
(
Z,T
)
aSm(A,T ) bSm(B,T )
如何计算物质B的 Sm(B,T)?
Sm (B, T )
T δQr,m 0K T
以水为例, 100 kPa下,自0 K的固态冰升温至473 K的水蒸气:
H2O(s,0 K)Δ→S1 H2O(s,15 K)Δ→S2 H2O(s,273 K)Δ→S3 H2O (l,273 K) Δ→S4 H2O(l,373 K)Δ→S5 H2O(g,373 K) Δ→S6 H2O(g,473 K)