平衡移动原理
- 格式:ppt
- 大小:754.50 KB
- 文档页数:23




勒夏特列原理:定义:如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。
勒夏特列原理又叫平衡移动原理。
注意事项:(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)增大并不意味着平衡一定向正反应方向移动,只有V正>V逆时才可以肯定平衡向正反应方向移动。
(3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
习题:1.下列事实,不能用勒夏特列原理解释的是A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率B.对2HIH2+I2平衡体系增加压强使颜色变深C.开启啤酒瓶后,瓶中立刻泛起大量泡沫D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深2.下列不能用勒夏特列原理解释的是()A.Fe(SCN)3溶液中加入固体KSCN后颜色变深B.棕红色NO2加压后颜色先变深后变浅C.SO2催化氧化成SO3的反应,往往需要使用催化剂E.合成氨工业中通入过量氮气可提高H2转化率3.下列事实不能用勒沙特列原理解释的是()①氯化铁溶液加热蒸干最终得不到氯化铁固体②铁在潮湿的空气中容易生锈③实验室可用排饱和食盐水的方法收集氯气④常温下,将1mL pH=3的醋酸溶液加水稀释至l00mL,测得其pH<5⑤钠与氯化钾共融制备钾Na(l)+KCl(l)=熔融K(g)+NaCl(l)4.下列事实中能应用勒沙特列原理来解释的是A.往硫化氢水溶液中加碱有利于S2-的增加B.加入催化剂有利于氨氧化的反应C.高压不利于合成氨的反应D.500℃左右比室温更有利于合成氨的反应1.解析:A、硫酸工业中,增大O2的浓度平衡向生成三氧化硫的反应进行,因此有利于提高SO2的转化率,适用于勒夏特列原理;B、对2HIH2+I2平衡体系增加压强,反应速率加快,但反应前后体积不变,因此平衡不移动。



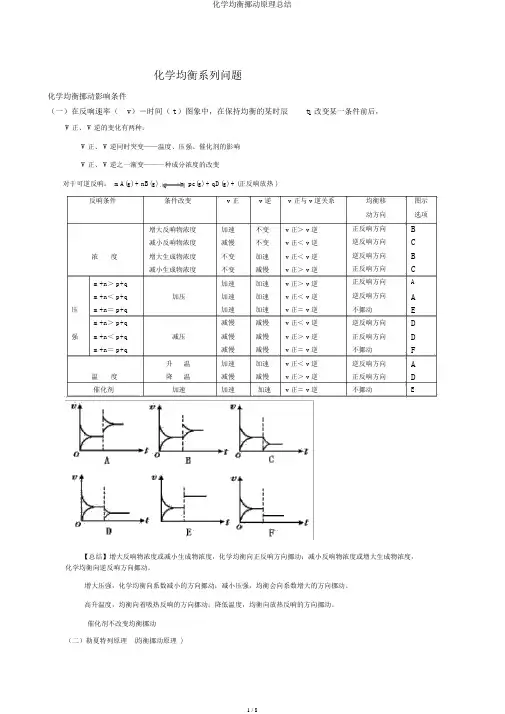
化学均衡系列问题化学均衡挪动影响条件(一)在反响速率(v)-时间( t )图象中,在保持均衡的某时辰t1改变某一条件前后,V 正、 V 逆的变化有两种:V 正、 V 逆同时突变——温度、压强、催化剂的影响V 正、 V 逆之一渐变——一种成分浓度的改变对于可逆反响: mA(g) + nB(g)pc(g) + qD(g) + (正反响放热 )反响条件条件改变v 正v 逆v 正与 v 逆关系增大反响物浓度加速不变v 正> v 逆减小反响物浓度减慢不变v 正< v 逆浓度增大生成物浓度不变加速v 正< v 逆减小生成物浓度不变减慢v 正> v 逆m+n> p+q加速加速v 正> v 逆m+n< p+q加压加速加速v 正< v 逆压m+n= p+q加速加速v 正= v 逆m+n> p+q减慢减慢v 正< v 逆强m+n< p+q减压减慢减慢v 正> v 逆m+n= p+q减慢减慢v 正= v 逆升温加速加速v 正< v 逆温度降温减慢减慢v 正> v 逆催化剂加速加速加速v 正= v 逆均衡移图示动方向选项正反响方向B 逆反响方向C 逆反响方向B 正反响方向C正反响方向A逆反响方向A 不挪动E 逆反响方向D 正反响方向D 不挪动F逆反响方向A 正反响方向D不挪动E【总结】增大反响物浓度或减小生成物浓度,化学均衡向正反响方向挪动;减小反响物浓度或增大生成物浓度,化学均衡向逆反响方向挪动。
增大压强,化学均衡向系数减小的方向挪动;减小压强,均衡会向系数增大的方向挪动。
高升温度,均衡向着吸热反响的方向挪动;降低温度,均衡向放热反响的方向挪动。
催化剂不改变均衡挪动(二)勒夏特列原理(均衡挪动原理 )假如改变影响均衡的一个条件,均衡就会向着减弱这类改变的方向挪动。
详细地说就是:增大浓度,均衡就会向着浓度减小的方向挪动;减小浓度,均衡就会向着浓度增大的方向挪动。
增大压强,均衡就会向着压强减小的方向挪动;减小压强,均衡就会向着压强增大的方向挪动。


课题:化学平衡的移动基础自测化学平衡的移动1.化学平衡的移动就是改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
2.图示3.平衡移动的方向(1)若v(正)>v(逆),则平衡向正反应方向移动。
(2)若v(正)=v(逆),则平衡不移动。
(3)若v(正)<v(逆),则平衡向逆反应方向移动。
[特别提醒](1)外界条件改变,平衡不一定发生移动。
①若条件改变,未引起化学反应速率的变化,则平衡一定不移动,如增加固体的用量。
①若条件改变,引起了化学反应速率的变化,但v(正)、v(逆)同等程度的改变,则平衡不发生移动。
①若条件改变,引起v(正)≠v(逆),则平衡一定发生移动。
(2)平衡发生移动,说明外界条件一定发生改变。
浓度变化对化学平衡的影响1.浓度对化学平衡的影响在其他条件不变的情况下,改变参与反应物质的浓度对化学平衡的影响:(1)增大反应物的浓度或减小生成物的浓度,使得v(正)大于v(逆),平衡向正反应方向移动。
(2)减小反应物的浓度或增大生成物的浓度,使得v(正)小于v(逆),平衡向逆反应方向移动。
2.平衡移动图像(vt图)(1)平衡正向移动(2)平衡逆向移动压强变化对化学平衡的影响1.压强改变与化学反应速率、化学平衡移动间的关系2.在其他条件不变的情况下压强对化学平衡的影响(1)增大压强,化学平衡向气体体积减小的方向移动。
(2)减小压强,化学平衡向气体体积增大的方向移动。
3.平衡移动图像(vt图)以m A(g)+n B(g)p C(g)+q D(g)为例(1)若m+n>p+q(2)若m+n<p+q(3)若m+n=p+q温度变化对化学平衡的影响1.温度对化学平衡的影响(1)在其他条件不变的情况下,升高温度,平衡向吸热的方向移动。
(2)在其他条件不变的情况下,降低温度,平衡向放热的方向移动。
2.平衡移动图像(vt图)(1)若a A+b B c C+d DΔH<0(2)若a A+b B c C+d DΔH>0催化剂与化学平衡平衡移动原理1.催化剂与化学平衡(1)催化剂对化学平衡的影响催化剂能同等程度的增大正、逆反应的速率,对化学平衡移动无影响,但能缩短达到平衡所需要的时间。
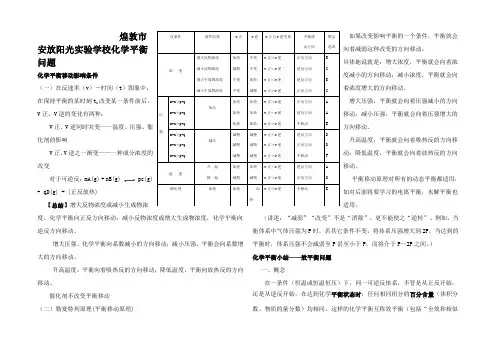
煌敦市安放阳光实验学校化学平衡问题化学平衡移动影响条件(一)在反速率(v)-时间(t)图象中,在保持平衡的某时刻t1改变某一条件前后,V正、V逆的变化有两种:V正、V逆同时突变——温度、压强、催化剂的影响V正、V逆之一渐变——一种成分浓度的改变对于可逆反:mA(g) + nB(g)+ qD(g) + (正反放热)【总结】增大反物浓度或减小生成物浓度,化学平衡向正反方向移动;减小反物浓度或增大生成物浓度,化学平衡向逆反方向移动。
增大压强,化学平衡向系数减小的方向移动;减小压强,平衡会向系数增大的方向移动。
升高温度,平衡向着吸热反的方向移动;降低温度,平衡向放热反的方向移动。
催化剂不改变平衡移动(二)勒夏特列原理(平衡移动原理)如果改变影响平衡的一个条件,平衡就会向着减弱这种改变的方向移动。
具体地说就是:增大浓度,平衡就会向着浓度减小的方向移动;减小浓度,平衡就会向着浓度增大的方向移动。
增大压强,平衡就会向着压强减小的方向移动;减小压强,平衡就会向着压强增大的方向移动。
升高温度,平衡就会向着吸热反的方向移动;降低温度,平衡就会向着放热反的方向移动。
平衡移动原理对所有的动态平衡都适用,如对后面将要学习的电离平衡,水解平衡也适用。
(讲述:“减弱”“改变”不是“消除”,更不能使之“逆转”。
例如,当衡体系中气体压强为P时,若其它条件不变,将体系压强增大到2P,当达到的平衡时,体系压强不会减弱至P甚至小于P,而将介于P~2P之间。
)化学平衡小结——效平衡问题一、概念在一条件(恒温或恒温恒压)下,同一可逆反体系,不管是从正反开始,还是从逆反开始,在达到化学平衡状态时,任何相同组分的百分含量....(体积分数、物质的量分数)均相同,这样的化学平衡互称效平衡(包括“全效和相似反条件条件改变v正v逆v正与v逆关系平衡移动方向图示选项浓度增大反物浓度减小反物浓度增大生成物浓度减小生成物浓度加快减慢不变不变不变不变加快减慢v正>v逆v正<v逆v正<v逆v正>v逆正反方向逆反方向逆反方向正反方向BCBC压强m+n>p+qm+n<p+qm+n=p+q加压加快加快加快加快加快加快v正>v逆v正<v逆v正=v逆正反方向逆反方向不移动AAE m+n>p+qm+n<p+qm+n=p+q减压减慢减慢减慢减慢减慢减慢v正<v逆v正>v逆v正=v逆逆反方向正反方向不移动DDF 温度升温降温加快减慢加快减慢v正<v逆v正>v逆逆反方向正反方向AD 催化剂加快加快加快v正=v逆不移动 E效”)。
化学平衡移动原理及应用目标要求 1.通过实验探究,了解浓度、温度、压强等对化学平衡的影响,能用相关理论解释其一般规律。
2.通过对图形、图表的阅读,进行初步加工、吸收、有序存储,并做出合理的解释。
1.化学平衡移动的过程2.化学平衡移动与化学反应速率的关系(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,平衡不移动。
(3)v正<v逆:平衡向逆反应方向移动。
3.影响化学平衡的因素(1)若其他条件不变,改变下列条件对化学平衡的影响如下:改变的条件(其他条件不变)化学平衡移动的方向浓度增大反应物浓度或减小生成物浓度向正反应方向移动减小反应物浓度或增大生成物浓度向逆反应方向移动压强(对有气体参加的反应) 反应前后气体体积改变增大压强向气体分子总数减小的方向移动减小压强向气体分子总数增大的方向移动反应前后气体体积不变改变压强平衡不移动温度升高温度向吸热反应方向移动降低温度向放热反应方向移动催化剂同等程度地改变v正、v逆,平衡不移动(2)勒·夏特列原理如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的物质的浓度),平衡将向着能够减弱这种改变的方向移动。
(3)“惰性气体”对化学平衡的影响 ①恒温恒容条件原平衡体系―――――→充入惰性气体体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温恒压条件原平衡体系―――――→充入惰性气体容器容积增大,各反应气体的分压减小 ―→体系中各组分的浓度同倍数减小(等效于减压)应用体验根据化学平衡原理解答下列问题:在体积不变的密闭容器中发生N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.4 kJ·mol -1,只改变一种外界条件,完成下表:改变条件 平衡移动方向氢气的转化率(增大、减小或不变)氨气的体积分数(增大、减小或不变)增大氮气的浓度 增大氨气的浓度升温 充入适量氩气答案 (从左到右,从上到下)正向 增大 逆向 减小 增大 逆向 减小 减小 不移动 不变 不变(1)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动(×)(2)升高温度,平衡向吸热反应方向移动,此时v放减小,v吸增大(×)(3)C(s)+CO2(g)2CO(g)ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大(√)(4)化学平衡正向移动,反应物的转化率不一定增大(√)(5)向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅(×)(6)对于2NO2(g)N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅(×)题组一选取措施使化学平衡定向移动1.COCl2(g)CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是()A.①②④B.①④⑥C.②③⑤D.③⑤⑥答案 B解析该反应为气体体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。
化学平衡的移动原理化学平衡是指在化学反应中,反应物和生成物在一定条件下达到动态平衡的状态。
在化学反应中,当反应物的浓度或压强发生变化时,系统会自动做出调整以恢复平衡状态。
这种自动调整的过程被称为化学平衡的移动原理。
化学平衡的移动原理可以通过勒夏特列矩阵(Le Chatelier's Principle)来解释。
勒夏特列矩阵表明,当外界条件改变时,系统会做出反应以减轻这种改变,以保持平衡。
一、浓度的影响当在一个已经达到平衡的系统中改变反应物的浓度时,系统会做出调整以恢复平衡。
根据勒夏特列矩阵,增加反应物浓度会使得反应朝着生成物的方向移动,以减少反应物的浓度。
相反,则是减少反应物浓度会使得反应朝着反应物的方向移动,以增加反应物的浓度。
这个过程可以通过以下化学反应来说明:A +B ⇌C + D如果A和B是反应物,C和D是生成物,当A和B的浓度增加时,平衡会向右移动,生成更多的C和D。
当A和B的浓度减少时,平衡会向左移动,生成更多的A和B。
二、压强的影响对于气体反应来说,改变压强也会影响化学平衡的位置。
当压强增加时,化学平衡会移动到分子数较少的一方,以减少压强。
当压强减少时,化学平衡会移动到分子数较多的一方,以增加压强。
以下是一个气体反应的示例:2A + 3B ⇌ C + D如果A和B是气体,C和D是液体或固体,当压强增加时,平衡会向右移动,生成更多的C和D。
当压强减少时,平衡会向左移动,生成更多的A和B。
三、温度的影响改变温度也可以影响化学平衡的位置。
根据勒夏特列矩阵,当温度增加时,平衡会向吸热的方向移动,以减少温度。
当温度减少时,平衡会向放热的方向移动,以增加温度。
以下是一个示例:A + heat ⇌B + C如果A是吸热的反应物,B和C是生成物,当温度增加时,平衡会向右移动,生成更多的B和C。
当温度减少时,平衡会向左移动,生成更多的A。
综上所述,化学平衡的移动原理可以根据勒夏特列矩阵来解释。
第2节 化学平衡移动原理及应用反应条件对化学平衡的影响1.化学平衡移动的过程 原化学平衡状态v (正)=v (逆)――→条件改变 平衡被破坏v (正)≠v (逆)――→一段时间后新化学平衡状态v ′(正)=v ′(逆)化学平衡移动2.化学平衡移动与化学反应速率的关系(1)v (正)>v (逆):平衡向正反应方向移动。
(2)v (正)=v (逆):反应达到平衡状态。
(3)v (正)<v (逆):平衡向逆反应方向移动。
3.影响化学平衡移动的外界因素若其他条件不变,改变下列条件对化学平衡的影响如下: 条件的改变(其他条件不变)化学平衡的移动 浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动 减小反应物浓度或增大生成物浓度向逆反应方向移动 压强(对有气体参加的反应)反应前后气体分子数改变 增大压强 向气体分子总数减小的方向移动 减小 压强 向气体分子总数增大的方向移动 反应前后气体分子数不变改变 压强 平衡不移动 温度 升高温度 向吸热反应方向移动降低温度向放热反应方向移动催化剂使用催化剂平衡不移动4.勒·夏特列原理如果改变影响化学平衡的条件之一(如温度、压强以及浓度),平衡将向着能够减弱这种改变的方向移动。
(1)化学平衡发生移动的实质是正、逆反应速率不相等。
正、逆反应速率发生变化,平衡不一定移动。
例如:使用催化剂,正、逆反应速率均增加,但是同等程度地增加,正、逆反应速率仍然相等,所以平衡不发生移动。
(2)v(正)增大,平衡不一定向正反应方向移动。
只有v(正)>v(逆)时,才使平衡向正反应方向移动。
(3)外界条件改变时,化学平衡发生移动,最终结果只能“减弱”条件的改变,但不能“消除”条件的改变。
1.判断正误,正确的打“√”,错误的打“×”(1)平衡时,其他条件不变,分离出固体生成物,v正加快。
()(2)工业上生产硫酸的过程中,使用过量的空气可提高SO2的转化率。