热力学第一定律-广西师范大学化学与药学学院
- 格式:pdf
- 大小:154.41 KB
- 文档页数:3




什么是热力学第一定律及第二定律下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!热力学第一定律和第二定律是热力学领域中两个非常重要的基本定律,它们为我们解释了自然界中能量转化和热力学系统的行为提供了基本原理。

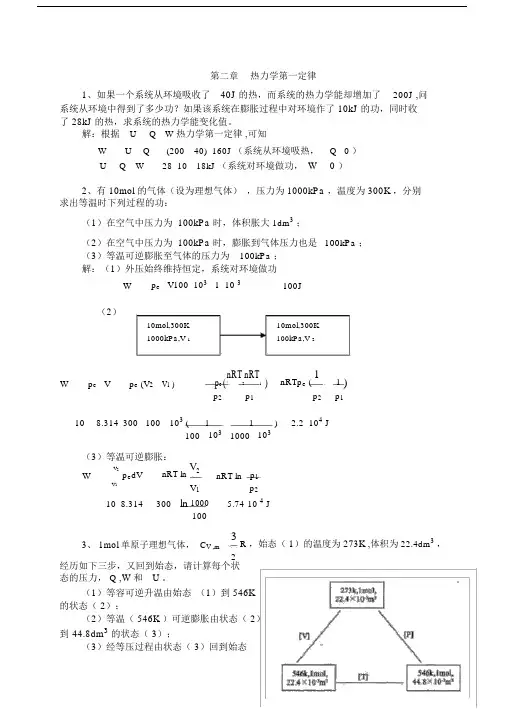
第二章热力学第一定律1、如果一个系统从环境吸收了40J 的热,而系统的热力学能却增加了200J ,问系统从环境中得到了多少功?如果该系统在膨胀过程中对环境作了 10kJ 的功,同时收了 28kJ 的热,求系统的热力学能变化值。
解:根据U Q W 热力学第一定律,可知W U Q (200 40) 160J (系统从环境吸热,Q 0 )U Q W 28 10 18kJ (系统对环境做功,W 0 )2、有 10mol 的气体(设为理想气体),压力为 1000kPa ,温度为 300K ,分别求出等温时下列过程的功:(1)在空气中压力为 100kPa 时,体积胀大1dm3;(2)在空气中压力为 100kPa 时,膨胀到气体压力也是100kPa ;(3)等温可逆膨胀至气体的压力为100kPa ;解:(1)外压始终维持恒定,系统对环境做功W p e V100 103 1 10 3 100J(2)10mol,300K10mol,300K1000kPa,V 1100kPa,V 2W p e V p e (V2 V1 ) p e(nRT2nRT1) nRTp e (11 )p2 p1 p2 p110 8.314 300 100 103 ( 1 1103 ) 2.2 104 J100 103 1000(3)等温可逆膨胀:V2p e dV nRT ln V2 nRT ln p1WV1 V1 p210 8.314 300 ln 1000 5.74 10 4 J1003、 1mol 单原子理想气体,C V ,m 3R ,始态(1)的温度为273K ,体积为 22.4dm3,2经历如下三步,又回到始态,请计算每个状态的压力, Q ,W和U 。
(1)等容可逆升温由始态(1)到 546K 的状态( 2);(2)等温( 546K )可逆膨胀由状态( 2)到44.8dm3的状态( 3);(3)经等压过程由状态( 3)回到始态( 1);解:(1)等容可逆升温过程:W P e V 0UQ WQ VT 2 nC V ,m dT 138.314 546 273 3404.58 JT 12(2)等温可逆膨胀过程:U 0WnRT lnV 21 8.314 546ln 44.83146.50JV 122.4Q W 3146.50J(3)等压过程 :WP e VnRT V 1 V 2 1 8.314 273 22.4 44.8 10 3 2269.72 JV 1 22.4 10 3Q pH T 2nC P ,m dT n 3 R 273 546 5 8.314 273 5674.31J T 1 R 12 2UQ W 5674.31 2269.72 3404.59 J4、在 291K 和 100kPa 下, 1molZn (s) 溶于足量稀盐酸中, 置换出 1molH 2 ( g) ,并放热 152kJ 。


可编辑修改精选全文完整版热力学第一定律科技名词定义中文名称:热力学第一定律英文名称:first law of thermodynamics其他名称:能量守恒和转换定律定义:热力系内物质的能量可以传递,其形式可以转换,在转换和传递过程中各种形式能源的总量保持不变。
概述热力学第一定律热力学第一定律:△U=Q+W。
系统在过程中能量的变化关系英文翻译:the first law of thermodynamics简单解释在热力学中,系统发生变化时,设与环境之间交换的热为Q(吸热为正,放热为负),与环境交换的功为W(对外做功为负,外界对物体做功为正),可得热力学能(亦称内能)的变化为ΔU = Q+ W或ΔU=Q-W物理中普遍使用第一种,而化学中通常是说系统对外做功,故会用后一种。
定义自然界一切物体都具有能量,能量有各种不同形式,它能从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转化和传递过程中能量的总和不变。
英文翻译:The first explicit statement of the first law of thermodynamics, byRudolf Clausiusin 1850, referred to cyclic thermodynamic processes "In all cases in which work is produced by the agency of heat, a quantity of heat is consumed which is proportional to the work done; and conversely,by the expenditure of an equal quantity of work an equal quantity of heat is produced."基本内容能量是永恒的,不会被制造出来,也不会被消灭。



什么是热力学第一定律及第二定律热力学定律,听起来是不是有点高深莫测?别担心,咱们来点简单直白的。
想象一下,你口袋里有一堆金币,突然有一天,你发现这堆金币不见了。
没错,就是不见了!这就是“热力学第一定律”,也叫能量守恒定律。
它告诉我们,不管发生了什么,能量都是守恒的,不会凭空消失或增加。
所以啊,如果你口袋里的钱不见了,那肯定是因为有人拿走了,而不是因为宇宙的能量突然多出来或者少少了。
再来说说“热力学第二定律”,也叫做熵增原理。
这个原理有点拗口,但说白了,就是一切物体都在向无序状态发展。
就像是你手里有个球,如果它开始滚动,最后总是会停下来,而且越滚越乱。
这就是熵增的过程,也就是能量从有序状态向无序状态转化的过程。
就像你刚买的手机,用了一段时间后,可能就会卡顿、发热,甚至出现故障,这就是能量在从有序状态向无序状态转化。
这两个定律有什么用呢?简单来说,它们就像是我们生活中的指南针,告诉我们能量是怎么流动的,以及物质是如何变化的。
比如,你知道夏天为什么热吗?那是因为太阳把热量传给了地球。
而冬天冷是因为地球把热量传给了太空。
这就是能量的传递和转化。
这些定律并不是一成不变的。
科学家们通过实验和观察,不断深化对热力学定律的理解。
比如,科学家们发现了一些有趣的现象,比如气体的扩散、液体的凝固等等,这些都与热力学定律有关。
热力学定律就像是我们生活中的指南针,帮助我们理解能量的流动和物质的变化。
虽然听起来有点复杂,但只要我们用心去理解,就会发现它们其实很有趣也很有用。
下次当你看到太阳、火焰或者冰箱工作时,不妨想想这些定律,说不定你会发现更多的乐趣呢!。
第二章热力学第一定律
一、选择题
1.(A)2.(C)3.(D)4.(D)
5.(B)6.(D)7.(D)8.(B)
9.(B)10.(A)11.(B)12.(D)
13.(B)14.(A)15.( D ) 16.( C )
17.(D)18.(B)19.( B ) 20.( D )
21.(C)22.(B)23.( A ) 24.( C )
25.(A, C)26.(B, C, E)27.( A ) 28.( B )
二.填空题
1.上升,上升2.任一,恒容
3.封闭系统,理想气体,可逆绝热过程,W’=0,单纯PVT变化,C p,m/C v,m为常数。
4.减小,零。
5.△C HӨm(CO(g))
6.△H=0,下降7.上升,>,下降。
8.(1)△H=0,(2)△H<0
9.<,<,<,<
10.恒温,节流,恒压绝热
三.判断题
1.×,2.√,3.×,4.√,5.×,6.×,7.√
四.计算题
1.1mol理想气体由100kPa、10dm3恒压压缩到1dm3,再恒容升压到1000kPa。
试计算整个过程的W、Q、∆U、∆H。
解:变化过程如下:
根据理想气体状态方程,
p1V1/T1 = p3V3/T3
可得: T 3=T 1( p 3V 3/ p 1V 1)= T 1(1000kPa×1dm 3)/(100kPa×10dm 3) =T 1 即终态与始态的温度相同,根据理想气体的内能U 和焓H 仅与温度有关,因此 ∆U = ∆H =0
过程的功
W =W (恒压)+W (恒容)= - p 1 (V 2 - V 1) + 0 = -100 000Pa×(1-10) ×0.001m 3 = 900J Q=∆U - W = 0 - 900J = - 900 J
2.在298K 时,有2molN 2(g),始态体积为15dm 3,保持温度不变,经下列三个过程膨胀到终态体积为50dm 3,计算各过程的U ∆,H ∆,W 和Q 的值。
设气体为理想气体。
(1) 自由膨胀;
(2) 反抗恒定外压100kPa 膨胀;
(3) 可逆膨胀。
解: 始态:,,mol n 2=3115dm V =K T 2981=
终态:
3250dm V =(1) 自由膨胀:0=∆-=V p W 外,0)(==∆=∆T f H U ,0=-∆=W U Q
(2) 反抗恒定外压100kPa 膨胀:
J m Pa V p W 350010)1550(10100333-=⨯-⨯⨯-=∆-=-外
0)(==∆=∆T f H U ,J W U Q 3500=-∆=
(3) 可逆膨胀:
J
dm
dm K V V nRT W 86.5965 1550ln 298K mol 8.314J -2mol ln 33
1-1-1
2
-=⨯⨯⋅⋅⨯=-= 0)(==∆=∆T f H U ,J W U Q 86.5965=-∆=
3.0.1kg C 6H 6(l)在p Ө,沸点353.35K 下蒸发,已知(C 6H 6) =30.80 kJ mol -1。
试计算此过程Q ,W ,ΔU 和ΔH 值。
m g
l H ∆解:等温等压相变 。
n (C 6H 6) =100/78 mol , ΔH = Q = n = 39.5 kJ , m g l H ∆ W = - nRT = -3.77 kJ , ΔU =Q +W=35.7 kJ
4.设一礼堂的体积是1000m 3,室温是290K ,气压为O
p ,今欲将温度升至300K ,
需吸收热量多少?(若将空气视为理想气体,并已知其C p ,m 为29.29 J K -1 ·mol -1。
)
解:理想气体等压升温(n 变)。
T nC Q p d m ,=δ,
⎰=300290m ,d RT T pV C Q p =1.2×107 J 5.1mol 单原子分子理想气体,从298K,2p Ө经(1)等温可逆; (2)绝热可逆; (3)沿p=10132.5V+b 的路径可逆膨胀至体积加倍, 求各过程的Q,W,∆U 和∆H? 解: (1)理想气体等温过程 ∆U=0; ∆H=0
Q=-W=nRTln(V 2/V 1)=1717.3 J
(2) 绝热过程: Q
=0 γ=5/3 有绝热过程方程式: p 1V 1γ=p 2V 2γ p 1=2p 0 V 1=12.226 dm 3 V 2=24.452 dm 3
p 2=p 1V 1γ/V 2γ=0.63p 0 T 2=p 2V 2/nR=187.7 K
∆U=Cv (T 2-T 1)=3/2R(187.7-298)=-1375 J
W=∆U=-1375 J ∆H=C p (T 2-T 1)=-2292 J
(3) 求b: b=p 1-10132.5V 1=78770
p 2=10132.5×V 2+78770=326530Pa=3.223p Ө
T 2=p 2V 2/R=960.3K ∆U=C v ∆T=8260 J
∆H=C p ∆T=13767 J W=-∫pdV=-∫(10132.5V+78770)dV=-3240 J
Q=∆U-W=11500 J
6.2 mol 单原子理想气体,由600K ,1.0MPa 对抗恒外压p Ө绝热膨胀到p Ө。
计算该过程的Q 、W 、ΔU 和ΔH 。
(C p ,m =2.5 R)
解:理想气体绝热不可逆膨胀Q =0 。
ΔU =W ,即 nC V ,m (T 2-T 1)= - p 2 (V 2-V 1), 因V 2= nRT 2/ p 2 , V 1= nRT 1/ p 1 ,求出T 2=384K 。
ΔU =W =nC V ,m (T 2-T 1)=-5.39kJ ,ΔH =nC p ,m (T 2-T 1)=-8.98 kJ
7.2mol,101.33 kPa,373K 的液态水放入一小球中,小球放入373K 恒温真空箱中。
打破小球,刚好使H 2O(l)蒸发为101.33kPa,373K 的H 2O(g)(视H 2O(g)为理想气体)求此过程的Q ,W ,ΔU ,ΔH ; 若此蒸发过程在常压下进行,则Q ,W ,ΔU ,ΔH 的值各为多少? 已知水的蒸发热在373K, 101.33kPa 时为40.66kJ·mol -1。
. 解:101.33kPa , 373K H 2O(l)→H 2O(g)
(1)等温等压可逆相变, ΔH =Q =n H m = 81.3 kJ ,
g l ∆W = -nR T =-6.2 kJ, ,ΔU =Q +W =75.1 kJ
(2)向真空蒸发W =0, 初、终态相同ΔH =81.3 kJ,ΔU =75.1 kJ,Q =ΔU =75.1 kJ。