湖北省黄冈市罗田县第一中学2020届高三化学上学期阶段性检测试题
- 格式:doc
- 大小:337.81 KB
- 文档页数:9

高三化学试题答案和给分标准1-15.(每题3分,共45分)1.D2.A3.D4.B5.C6.A7.C8.D9.B 10.C11.C 12.B 13.D 14.A 15.C16.(共14分)(1)3d 74s 2(1分)第四周期VIII 族(2分,周期和族各1分,不互相牵连)+3(1分)(2)abc (2分,选对两个得1分,有错或只选对1个0分)(3)[]4+22242222LiCoO +H C O +8Cl 6H 22CO +4H O Co +2Li Cl -+-+=+↑(2分,要么0分要么2分)(4)9.44×10-3(2分,没有用科学计数法或者没有保留3位有效数字者不得分)(5)1:4(2分)降低反应温度或带走过多热量,反应速率减慢(2分,合理即得分)17.(共14分)(1)CH 4(g)+CO 2(g)2CO(g)+2H 2(g)ΔH =+247.4kJ·mol -1(2分,ΔH 的值没有标明正号者不扣分,无单位或者没配平、没写状态者无分)(2)①0.025(2分)②AC (2分,只写对一个得1分,有错者无分)(3)①<(2分)②(2分)(4)①<(2分)②1324k k k k ⨯⨯(2分)湖北省新高考联考协作体2024-2025学年上学期开学测试18.(共13分)(1)222Cu H O Cu(OH)=+↓(2分,没有沉淀符号者得1分);2Cu 2e Cu -+-=(1分)(2)222442Cu H O H SO CuSO 2H O ++=+(2分,若写成离子方程式,写对了,得1分);产生的铜离子催化了过氧化氢分解(1分)(3)对于2Cu 2e Cu -+-=,加入氨水,氨水与2Cu +形成()234Cu NH +⎡⎤⎣⎦,使()2c Cu +减小,提高了Cu 的还原性(2分,合理即得2分);向U 型管右侧溶液中滴加硫酸(1分,没说清楚是右侧者不得分)(4)在还原反应或氧化反应(半反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强。

黄冈市2024年高三年级9月调研考试化学本试卷共8页,19题。
全卷满分100分。
考试用时75分钟。
★祝考试顺利★注意事项:1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。
写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将答题卡上交。
相对原子质量:H-1 C-12 N-14 O-16一、选择题。
本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.劳动才能创造价值。
下列职业的工作内容以及工作实例描述不恰当的是()A.A B.B C.C D.D2.2024年6月2日,嫦娥六号首次在月球背面成功实施样品采集任务。
深层采样要求钻头具备高硬度岩石的钻进能力,下列物质中不能做钻头主体材料的是()C C.超级钢D.氧化铝A.碳化硅B.603.下列实验仪器的选择和使用,错误的是()甲乙丙丁A.甲使用前需将电极插入已知准确pH的标准缓冲液中校准B .乙既能盛装酸性溶液,又能盛装碱性溶液C .丙使用前需用已知浓度的标准溶液润洗2~3次D .使用丁进行萃取实验时,振荡后需要放气4.化学用语可以表达化学过程,下列化学用语错误的是( ) A .野外生氢:+-22NaH+H O=Na +OH +H ↑B .泳池消毒:2223Ca(ClO)+CO +H O=CaCO +2HClO ↓C .管道疏通:[]--2422Al+6H O+2OH =2Al(OH)+3H ↑D .火箭升空:-1242222N H (l)+2NO (l)=3N (g)+4H O(g)ΔH=+1134.4kJ mol ⋅5.下列化学学科学习方法的运用或相关描述存在错误的是( )A .AB .BC .CD .D6.下列物质的有关用途及对应性质的描述存在错误的是( )A .22Na O ——供氧剂——氧化性B .()243Al SO ——混凝剂——水解C .Na ——强除水剂——还原性D .34Fe O ——打印机墨粉——磁性 7.下列叙述与对应的哲学观点不相符的是( )A .AB .BC .CD .D 8.下列描述与电子能级跃迁无关的是( )A .太阳光谱里的夫琅禾费线B .清晨树林里的丁达尔效应C .氢原子的线状光谱D .光刻机的极深紫外光短周期主族元素X 、Y 、Z 原子序数依次增大,X 和Y 位于同一周期,X 和Z 位于同一主族。

湖北省2020届高三化学上学期第一次月考(9月)精编仿真金卷(A卷)注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 K 39 Fe 56 Mn 55 Ba 137一、选择题(每小题3分,共48分)1.化学与生活、社会发展息息相关,下列有关说法不正确的是A.“雾霾积聚,难见路人”,雾霾所形成的气溶胶有丁达尔效应B.我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛C.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不相同D.碳素钢和光导纤维都属于新型的无机非金属材料2.设N A表示阿伏加德罗常数的值,下列叙述中一定正确的是A.在1mol NaHSO4晶体中,含阳离子数为2N AB.1mol C4H10分子中共价键总数为13N AC.0.5mol·L-1 Ba(NO3)2溶液中,NO−3的数目为N AD.任何条件下,20L N2含有的分子数都不可能为N A3.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2②向NaAlO2溶液中逐滴加入过量的稀盐酸③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液④向硅酸钠溶液中逐滴加入过量的盐酸A.①② B.①③ C.①④ D.②③4.下列离子方程式的书写及评价均合理的是5.下列除去杂质的方法不正确的是A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤6.某溶液可能含有Na+、Fe2+、Br-、CO2−3、I-、SO2−3六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是A.Fe2+、CO2−3、Br- B.Na+、SO2−3、I-C.Fe2+、I-、SO2−3 D.Na+、Br-、CO2−37.把铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3mol NO2和0.2mol NO,下列说法正确的是A.反应后生成的盐只为Fe(NO3)3B.反应后生成的盐只为Fe(NO3)2C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶18.宁夏的硒砂瓜现今已享誉区内外,西瓜富含硒元素,有延年益寿、抗衰老、抗癌作用,因之得名“硒砂瓜”。

湖北省高中名校联盟2025届高三第一次联合测评化学试卷注意事项:1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑。
写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。
写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Al-27 Fe-56一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1. ★祝考试顺利★湖北有众多非物质文化遗产,其主要成分是金属材料的是 A. 武汉铜锣 B. 天门糖塑C. 大冶石雕D. 阳新布贴【答案】A 【解析】【详解】A .铜锣主要成分属于金属材料,A 正确; B .天门糖塑主要成分为麦芽糖,属于有机物,B 错误; C .大冶石雕主要成分是碳酸钙,属于盐类,C 错误; D .阳新布贴主要成分为纤维,D 错误; 故答案为:A 。
2. 在现代食品工业中,食品添加剂的使用满足人们对食品多样化的需求,保证了市场供应。
下列食品添加剂与其功能不对应的是 A. 柠檬黄—着色剂 B. 苯甲酸钠—防腐剂 C. 谷氨酸钠—增味剂 D. 碳酸氢钠—凝固剂【答案】D 【解析】【详解】A .柠檬黄作着色剂,A 正确; B .苯甲酸钠作防腐剂,B 正确; C .谷氨酸钠作增味剂,C 正确; D .碳酸氢钠作膨松剂,D 错误; 故选D 。
3. 设A N 为阿伏加德罗常数的值。
下列说法正确的是 A. 标准状况下44.8L 3SO 的分子数为2A N B.5.6g Fe 与足量稀硝酸反应转移电子数为0.2A N C. 4.6g 33CH OCH 中含有的极性共价键数目为0.8A N D. 1L 0.11mol L −⋅ 23Na CO 溶液中阴离子数为0.1A N 【答案】C 【解析】【详解】A .标准状况下3SO 不是气体,44.8L 3SO 的物质的量不是2mol ,故A 错误;B .5.6gFe 的物质的量为0.1mol ,与足量稀硝酸全部转化为Fe 3+,转移电子的数目为0.3N A ,故B 错误;C .4.6g 33CH OCH 物质的量为0.1mol ,33CH OCH 的结构式为,其含有的极性共价键数目为0.8A N ,故C 正确;D .1L 0.11mol L −⋅ 23Na CO 溶液,由于碳酸根会水解,2323CO H O HCO OH −−−++ ,则溶液中阴离子数大于0.1A N ,故D 错误; 故选C 。

湖北省黄冈市罗田县第一中学2019届高三语文调研考试试题(扫描版)黄冈市2018年高三年级9月质量检测语文参考答案及评分标准1.B(A项,无中生有。
文中只是说“通过对儒学的吸收、转化、融和,唐诗逐渐开拓着自身新的发展道路”,并没有讲到“唐诗促进了儒学的吸收、转化、融合”;C项,夸大其词。
原文的表述是“有些诗作在艺术表达上还比较生硬”,很明显“使他们的诗作全面走向成熟”夸大了儒学的作用;D项,关系倒置。
原文只是说“不同的诗人在对儒学的坚守与汲取中形成了自己的创作个性”,而不是说“因创作个性不同而对儒学的坚守与汲取有别”。
)2.D(“运用对比论证的方法”错,作者在论证“应制诗和宦游诗在宣扬儒学思想方面的不同立场和态度”时,运用的应该是类比论证。
)3.C(强加因果。
从原文看,“安史之乱给唐朝带来沉重打击”与“中唐的士人将自己的治世理想以儒者的姿态写入唐诗”之间不存在因果关系。
)4.B(话语中有对年老的感慨,但并没有无奈的伤感。
他们不是对“对未来生活的迷茫”,是对人生的思考与感悟:生命像雪花一样脆弱;人生虽短暂和艰难,但要脚踏实地地去面对、经历。
)5.①描写海浪风雪之大,能表现天气的寒冷、恶劣,营造出紧张、凶险的氛围,突出了人物活动的典型环境。
②因海浪风雪越大,落水者和迷路者才找不到方向,才需要大火指引方向,由此才能推动情节的发展。
③描写海浪风雪之大,能从侧面烘托两位老人舍弃个人利益,点燃铺子救人的品质。
④因海浪风雪之大,点燃铺子救人的举措也无意救了他们儿子的命,凸显“帮助别人就是帮助自己”的温暖主题。
(环境、情节、人物、主题等四个方面能答出其中三点即给满分6分。
每点2分,大意正确即可。
)6.①与前文情节互为照应,使这个故事紧凑,结构浑然一体。
②情节跌宕起伏,出人意料又在情理之中,增强了情节发展的张力。
③使主题得到了升华,不仅仅是对舍己救人的歌颂,凸显“帮助别人就是帮助自己”的温暖主题。
④引发读者不尽的思考,能起到言有尽意无穷的作用。

绝密★启用前人教版高三化学一轮复习《第二章物质及其变化》过关检测卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分第Ⅰ卷一、单选题(共20小题,每小题3.0分,共60分)1.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是()2.下列鉴别方法可行的是( )A.用氨水鉴别Al3+,Mg2+和Ag+B.用Ba(NO3)2溶液鉴别Cl-,SO42-和CO32-C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO3.根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是()①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S↓+2HIA. H2S>I2>Fe3+>Cl2B. Cl2>Fe3+>I2>SC. Fe3+>Cl2>H2S>I2D. Cl2>I2>Fe3+>H2S4.下列有关化学用语使用正确的是( )A.硫原子的原子结构示意图:B. NH4Cl的电子式:C.原子核内有10个中子的氧原子:D.对氯甲苯的结构简式:5.下列物质的转化在给定条件下能实现的是( )A.①③⑤B.②③④C.②④⑤D.①④⑤6.一定质量的某铁的氧化物Fe x O y,与足量4 mol·L-1稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。
则该铁的氧化物的化学式为()A. FeOB. Fe2O3C. Fe3O4D. Fe8O107.下列解释事实的化学方程式或离子方程式不正确的是()A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2OB.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO+PbS===CuS+PbSO4C.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3===CaCO3+Na2SO4D.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2===2CaSO3+2CO28.钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为CO+PdCl2+H2O====CO2+Pd↓+2HCl。

黄冈市2024年高三年级9月调研考试化学参考答案1.B 【解析】14C 断代法主要适用于生物体遗骸(如动物骨骼、植物纤维等)的断代。
青铜不含碳元素。
2.B 【解析】钻头需要硬度大的合金或者共价晶体,C 3.C 【解析】润洗会带入溶质,会造成浓度偏高。
4.D 【解析】60是分子晶体。
火箭燃料燃烧应该是放热反应。
5.C 【解析】高温下,C 与SiO反应生成气态CO 2非常稳定,能够脱离反应体系,使反应顺利进行。
不能说明C 的还原性强于Si 。
6.A 【解析】Na2O 作供氧剂利用的是其2与水和二氧化碳反应放出氧气7.C 【解析】稀硫酸到浓硫酸,浓度的量变引起化学性质的质变,A 对;生产成本的降低和平衡转化率的提升是一对矛盾的关系,选择此压强主要考虑经济成本,B 对;孤立体系中,3-自发过程朝ΔS >0的方向进行,没有体现对立性,C 错;Al 3+与HCO 现了相互影响,D 对水解相互促进,体。
8.B 【解析】丁达尔效应是直径与可见光波长相近的粒子对可见光的散射作用。
9.C 【解析】X 是N ,Y 是F ,Z 是P 。
N 未成对电子是2p 电子,电子云轮廓图为哑铃形,A 对;F 是电负性最强的元素,B 对;P 2O是酸性氧化物,不能干燥碱性的5NH ,C 错;3N 的非金属性强于P ,故其最高价氧化物的水化物酸性更强,D 对。
10.D 【解析】M 的阴阳离子半径大、电荷低,典型的室温离子液体特点,A 对;阴离子 与SF 的结构相似,后者的空间结构模型是正八面体,B 对;阳离子有类似苯环的大π6键结构,则环必须为平面结构,故N 都为sp 2杂化,C 对;阳离子环上π电子数为6个,D 错。
11.A 【解析】恒压滴液漏斗的支管连接了活塞上下,故无需关闭活塞,A 正确;浓硫酸会将HBr 氧化,故应用浓磷酸代替,B 错;加热温度为110℃,故应用油浴,C 错;三颈烧瓶中发生的是取代反应,会有HCl 生成,故沉淀是AgCl 和AgBr 的混合物,D 错。
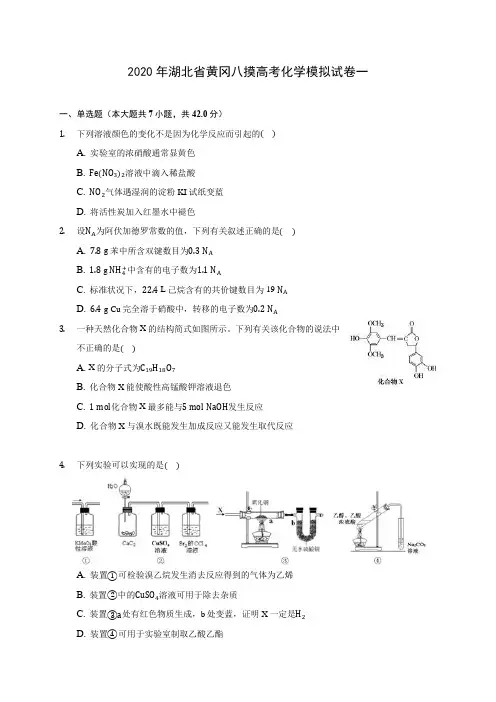
2020年湖北省黄冈八摸高考化学模拟试卷一一、单选题(本大题共7小题,共42.0分)1.下列溶液颜色的变化不是因为化学反应而引起的()A. 实验室的浓硝酸通常显黄色B. Fe(NO3)2溶液中滴入稀盐酸C. NO2气体遇湿润的淀粉KI试纸变蓝D. 将活性炭加入红墨水中褪色2.设N A为阿伏加德罗常数的值,下列有关叙述正确的是()A. 7.8 g苯中所含双键数目为0.3N AB. 1.8 g NH4+中含有的电子数为1.1N AC. 标准状况下,22.4 L己烷含有的共价键数目为19 N AD. 6.4 g Cu完全溶于硝酸中,转移的电子数为0.2N A3.一种天然化合物X的结构简式如图所示。
下列有关该化合物的说法中不正确的是()A. X的分子式为C19H18O7B. 化合物X能使酸性高锰酸钾溶液退色C. 1mol化合物X最多能与5mol NaOH发生反应D. 化合物X与溴水既能发生加成反应又能发生取代反应4.下列实验可以实现的是()A. 装置①可检验溴乙烷发生消去反应得到的气体为乙烯B. 装置②中的CuSO4溶液可用于除去杂质C. 装置③a处有红色物质生成,b处变蓝,证明X一定是H2D. 装置④可用于实验室制取乙酸乙酯5.室温下,向10mL0.10mol·L−1YOH溶液中逐渐滴加0.20mol·L−1HX溶液,混合溶液的pH变化如图所示(温度和体积变化忽硌不计)。
下列结论错误的是()A. HX为一元弱酸,YOH为一元强碱B. M点对应溶液中水的电离程度大于N点溶液中水的电离程度C. 室温时,pH=a的YX溶液中水电离出的c(OH−)=1.0×10−(14−a)mol·L−1D. N点对应溶液中粒子浓度:c(HX)>c(X−)>c(Y+)>c(H+)>c(OH−)6.某种新型热激活电池的结构如图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI)。

2019-2020年高三一轮复习测试化学试卷含答案可能用到的相对原子质量:H:1 , O:16, C:12, N:14, Fe:56 , S:32, Cl:35.5, V:51选择题:本题共13小题,每题6分。
在每小题给出的四个选项只有一项是符合题目要求7.信息、材料、能源被称为新科技革命的“三大支柱”。
下列观点或做法错误的是A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机8. 有一无色溶液,仅含有K+、Al3+、Mg2+、NH+4、Cl-、SO2-4、HCO-3、MnO-4中的几种。
为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。
下列推断正确的是A.肯定有Al3+、Mg2+、Cl-,可能有NH+4B.肯定有Al3+、Mg2+、HCO-3,肯定没有MnO-4C.肯定有Al3+、Mg2+、Cl-,可能有K+D.肯定有K+、Al3+、MnO-4,可能有HCO-39.有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用丙醛制取1,2一丙二醇,按正确的合成路线依次发生的反应所属类型应是A.⑤①④③B.⑥④③①C.①②③⑤D.⑤③④①10..短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。
则下列说法正确的是A.B与A只能组成BA3化合物B.C、D、E形成的化合物与稀硫酸可能发生氧化还原反应C.A、B、C形成的化合物一定不能发生水解反应D.E的氧化物对应的水化物一定有强的氧化性11.下列实验过程中产生的现象与图中曲线变化相对应的是12.下列离子方程式书写正确的是A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32-B.向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-=3Br2+2NO↑+4H2O C.Na2S溶液中滴加NaClO溶液:S2-+ClO–+H2O=S↓+Cl-+2OH-D.双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O13. 在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。

湖北省高三12月联考化学本试卷满分100分,考试用时75分钟。
注意事项:1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:高考全部内容。
5.可能用到的相对原子质量:H1 C12 O16 S32 Fe56 Co59 Zn65一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.清华团队研制出新款忆阻器存算一体芯片,相关成果发表于《科学》。
下列不可用作芯片的材料的是( ) A.硅单质B.碳化硅C.二氧化硅D.砷化镓2.下列化学事实不符合“量变引起质变”的哲学观点的是( ) A.碳单质与氧气的反应 B.铁单质与硝酸的反应 C.氯化铝与氢氧化钠溶液的反应D.铜单质与氯气的反应3.氨催化氧化法制硝酸的过程为2222OOO323Pt Rh/H ONH M NO HNO − → → →△,下列叙述正确的是( )A.2NO 的吸收在吸收塔中进行,在吸收塔中充入空气的目的是提高2NO 的原子利用率B.标准状况下,32.24LNH 含孤电子对数目约为230.4 6.0210×× C.M 与足量2O 混合生成的2NO 分子数与参加反应的M 分子数相等 D.制备M 的化学方程式为2322Pt Rh 4NH 32H O N 6O −++△4.“青,取之于蓝,而青于蓝”出自《劝学》,其中“青”是指靛蓝(靛青);“蓝”是指制取靛蓝的蓝草。
靛蓝与靛白的相互转化如图。
下列叙述正确的是( )A.靛蓝为苯的同系物B.靛白分子中含有2个手性碳原子C.靛蓝分子中苯环上的一溴代物有5种D.1mol 靛白最多消耗21molH5.化学用语可以表达化学过程,下列化学用语表达正确的是( ) A.用电子云轮廓图表示H-Cl 的s-p σ键的形成示意图:B.将氢硫酸滴加到硫酸铁溶液中:322H S 2Fe 2H 2Fe S ++++++↓C.23Na CO 溶液显碱性的原因:23223CO 2H O H CO 2OH −−++D.用电子式表示2H S 的形成过程:6.X 、Y 、Z 、W 为原子序数依次增大的同一短周期的主族元素,基态Z 原子s 轨道的电子总数与其p 轨道的电子总数相等,基态Y 原子L 层电子总数是内层电子总数的2倍,上述四种元素形成的阴离子的结构如图。

黄冈市2022年1月调研考试化学试题可能用到的相对原子质量:H-1C-12N-14O-16 Na-23 Mg-24 S-32 Fe-56Cu-647.下列说法正确的是A.凡含有食品添加剂的食物对人体健康均有害,不宜食用B.不慎误服BaCl2溶液时,除大量吞服鸡蛋清解毒外,还应加服肯定量的解毒剂碳酸钠,以便将BaCl2转化成碳酸钡C.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是由于水中溶解了较多的CO2D.食盐可作调味剂,也可作食品防腐剂8.设N A表示阿伏加德罗常数的数值,下列说法正确的是A.在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2N AB.标准状况下,20g D2O分子中所含中子数为10N AC.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2N AD.50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3N A9.青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是A.分子式是C15H23O5B.易溶于水,乙醇和乙醚C.含有─O─O─ 键,具有较强的氧化性D.1mol青蒿素可以和1mol H2发生加成反应10.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍,下列说法不正确的是A.X与Y可形成的化合物在5种以上B.工业上经常通过电解Z的熔融氧化物的方法来获得Z的单质C.这五种元素形成的简洁离子的半径由大到小为:W>Q>X>Y>ZD.W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构11.下列有关试验装置进行的相应试验,能达到试验目的的是A.用图①所示装置制取少量纯洁的CO2气体B.用图②所示装置验证镁和盐酸反应的热效应C.用图③所示装置制取并收集干燥纯洁的NH3D.用图④装置制备Fe(OH)2并能保证较长时间观看到白色12.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污弱酸HCOOH HCN H2CO3电离平衡常数( 25℃)K a=1.77×10-4K a=5.0×10-10K a1=4.3×10-7K a2=5.6×10-11A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO22HCN+CO32-题号7 8 9 10 11 12 13答案 D B C D B A C题号内容要求教材7 化学与生活的关系能够将化学与生活紧密联系综合8 化学常用计量理解常用计量与阿伏加德罗常数的关系必修一9 有机物的结构与性质学会依据给定有机物的结构去分析分子式,依据官能团分析物理性质和化学性质必修二10物质结构元素周期律综合应用元素周期律与元素周期表(元素的“位—构—性”关系);理解金属活动性挨次表的应用(金属冶炼方法);了解对原子或离子关系的考查(质子数、电子数、微粒半径)必修二11 化学试验基础理解典型化学试验中仪器的选择及特殊使用必修一12电解质溶液能依据弱酸的平衡常数分析酸性的强弱;理解溶液酸碱性;理解盐类水解的实质与规律及应用;理解溶液中粒子浓度大小的推断选修四13 电化学原理理解原电池和电解池的工作原理;理解原电池正、负极与电解池阴、阳极的推断;原电池电极反应式的书写;了解电化学原理的应用。
湖北省黄冈市2020届高三化学模拟测试试题(四)本试卷分第I卷(选择题)和第I卷(非选择题)两部分,共300分。
考试用时150分钟。
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Zn:65第I卷(选择题,共126分)一、选择题:本题共13小题;每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目的要求的。
7.N A代表阿伏加德罗常数的值。
下列说法正确的是A.2.3 g Na与O2完全反应,反应中转移的电子数介于0.1N A和0.2N A之间B.500 mL 0.5 mol·L-1的NaCl溶液中微粒数大于0.5N AC.标准状况下,22.4L二氯甲烷中含有4N A极性共价键D.12 g金刚石中含有化学键的数目为4N A8.纯净的砒霜是一种剧毒物,但在医学中却有着重要的作用。
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针”,文中涉及的操作方法也可用于下列哪组混合物的分离A.酒精和水B.氯化铵和氯化钠C.氯化铵和碘单质D.氯化钾和二氧化锰.9.短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。
上述物质的转化关系如图所示。
下列说法正确的是A.阴离子的还原性:Y>WB.W.Y、Z元素的简单离子半径由大到小顺序为Z>Y>WC.W2Y2中含有非极性键D.Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的10.H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是A.由图可知,草酸的K a2=10-4.2B.pH=7的溶液中:c(Na+)=2c(C2O24-)C.c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等D.根据图中数据计算可得c点溶液pH为2.711.碳、硫的含量影响钢铁性能。
C. 向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2(s) + 2FeCl3(aq)==2Fe(OH)3(s) +3MgCl2(aq)D. 向甲醛中加入足量的银氨溶液并加热:HCHO + 2[Ag(NH3)2]OH HCOONH4 + 2Ag↓+3NH3 +H2O9. 碲元素(Te)位于周期表中第五周期ⅥA族,含碲有机物在医学、材料科学等领域发挥着独特的作用。
某含碲有机物结构简式如下图所示,下列说法错误的是A.基态碲原子未成对电子数为2B.其中含氧官能团有2种C.苯环上的一氯代物有5种D.其中手性碳原子个数为210.一种可用于头孢菌素改性剂的结构如下图所示,其中X、Y、Z、W是原子序数递增的短周期主族元素。
下列说法正确的是A.原子半径:Z>WB.第一电离能:Z<YC.沸点:X2Z<X2WD.键角:YZ2>WZ211.根据实验操作及现象,下列结论中正确的是选项实验操作和现象结论A. 向蔗糖溶液滴加稀硫酸,水浴加热,再加入新制Cu(OH)2悬浊液,无砖红色沉淀蔗糖未发生水解B. 将补铁剂溶于盐酸,过滤,将滤液加人KMnO4溶液中,溶液紫色褪去补铁剂中含有二价铁C. 向盛有2mL鸡蛋清溶液的试管中加入5滴浓硝酸,加热,先有白色沉淀,加热后沉淀变黄蛋白质能发生变性和显色反应D. 石蜡油加强热,将生成的气体通人溴水中,溴水褪色气体中含有乙烯12.我国科技工作者设计了一种CO2转化的多功能光电化学平台,实现了CO生产与塑料到化学品的协同转化,其原理如下图所示。
下列说法错误的是△A.光催化电极的电势:a>bB.电池工作时,负极区溶液的pH 减小C.正极区的电极反应为CO 2 + 2e ˉ+2HCO -3== CO +2CO2-3+H 2OD.当电路中转移1mol 电子时,正极区溶液质量增大39g13.为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。
2024-2025学年湖北省黄冈市化学高二上学期期中模拟试卷(答案在后面)一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列物质中,属于有机高分子化合物的是:A、NaClB、H2OC、C6H12O6D、CO22、下列物质中,属于有机高分子化合物的是()A、CO2B、NaOHC、CH2=CH2D、C6H12O63、下列物质中,不属于同位素的是()A.(H)和(D)B.(C)和(C14)C.(Na)和(Na+)D.(O)和(O2−)4、下列物质中,不属于有机化合物的是()A、CH4(甲烷)B、CO(一氧化碳)C、C2H5OH(乙醇)D、CH3COOH(乙酸)5、下列关于同分异构体的说法中,正确的是:A. 同分异构体是分子式相同,结构不同的化合物B. 同分异构体的分子式一定相同,但分子量可能不同C. 同分异构体的分子式不同,但结构可能相同D. 同分异构体指的是分子式相同,原子个数相同的化合物6、下列关于化学键的说法中,正确的是:A、所有金属元素都能形成金属键B、共价键只存在于非金属元素之间C、离子键是由阴阳离子通过静电作用形成的D、所有化合物都含有共价键7、下列关于化学键类型的说法中,正确的是:A、所有金属元素形成的化合物都是离子化合物。
B、所有非金属元素形成的化合物都是共价化合物。
C、由不同非金属元素组成的化合物,其化学键一定是共价键。
D、离子化合物中可能含有共价键。
8、在下列反应中,哪一个反应体现了SO2的还原性?A. SO2 + H2O → H2SO3B. SO2 + 2H2S → 3S↓ + 2H2OC. SO2 + 2KOH → K2SO3 + H2OD. 2SO2 + O2 → 2SO3 (催化剂,高温)9、下列关于化学反应速率的描述中,正确的是:A、反应速率与反应物的浓度无关,只与温度有关。
B、反应速率越大,说明反应进行得越快。
C、固体反应物的表面积越大,反应速率越快,但与温度无关。
湖北省黄冈市罗田县第一中学2020届高三化学上学期阶段性检测试题本试卷分第Ⅰ卷和第Ⅱ卷两部分,共8页,满分为100分,考试用时90分钟。
注意事项:1.答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、准考证号、考试科目填写在规定的位置上。
2.第Ⅰ卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.第Ⅱ卷必须用0.5毫米黑色签字笔作答,答案必须写在答题纸各题目指定区域内相应的位置;如需改动,先划掉原来的答案,然后再写上新的答案,不得使用涂改液,胶带纸、修正带和其他笔。
相对原子质量 H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Fe:56 Zn:65 第Ⅰ卷选择题(共42分)一、选择题(本题包括14小题,每小题3分,共42分。
每题只有一个选项符合题意)1.下列有关表述中,正确的是模型为) B.聚丙烯的结构简式为.甲烷分子的比例(A填充 10 8O 的电子式为10个中子的氧原子:.HClO D.含有C2.明代李时珍的《本草纲目?谷四?烧酒》中记载:“……惟以糯米或粳米或黍或秫或大麦蒸熟,和麴酿瓮中七日,以甑蒸取”。
下列说法错误的是A.糯米、粳米、大麦等谷物中均含有淀粉B.古法酿酒工艺中有多种酶参与催化反应C.酒化酶将葡萄糖转化为乙醇时,温度越高反应速率一定越快D.该过程中涉及蒸馏操作N表示阿伏加德罗常数的值。
下列说法正确的是 3.A N 2.常温下,15 g甲醛中含有的共用电子对总数为A A-1-N0.5COONa溶液中含有CHCOO的数目少于B.0.5 mol·LCH A33N水解形成的Fe(OH)胶体粒子数为0.1.C16.25 g FeCl A33混合气体时,转移电子数H.足量的锌与一定量的浓硫酸充分反应,放出2.24 L SO和D22为0.2N A.科学研究发现,具有高度对称的有机分子具有致密性高,稳定性强,张力能大等特点,因4正四面此这些分子成为化学界关注的热点。
立体烷烃中有一系列对称结构的烃,如:(立方烷、CH等,下列有关说法正确的是))H棱晶烷)HC体烷、(C848664A.立体烷烃的C原子都形成4个单键,因此它们都属于烷烃- 1 -B.上述一系列物质互为同系物,它们的通式为CH(n≥2) 2n2n C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物的种数不同()与棱晶烷属于同分异构体D.苯、盆烯5.以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下,下列说法正确的是A.粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜B.电解时用粗银作阴极,硝酸银溶液为电解质溶液C.用稀硫酸处理渣料时主要发生了氧化还原反应D.从滤液 B 中可以提取绿矾(FeSO?7HO) 246.从下列事实所列出的相应结论正确的是( )A.②⑤ B.④⑤ C.①② D.全部7.下列离子方程式不正确的是+2Al(OH)↓.泡沫灭火器的工作原理:3CO+2Al+3HO=3COA3232+2+2++2HS+HgHS去除废水中的Hg:2-3+↑H=HgS↓.用B22+--O +IO反应生成KIOC.酸性溶液中与KII:+5I6H=3I3H+233222++O+CO+2HBaCOD.碳酸钡不能用作钡餐的原因:=Ba↑+H232、硝酸、硫酸化学性质的实验,实验过程如图所示。
下列Cu.某化学兴趣小组进行了有关8 有关说法正确的是- 2 -还原为NOA.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu2B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强O 4HSO = 4CuSO+2NO↑++.实验③发生反应的化学方程式为:3Cu+Cu(NO)4HC242432在常温下既可以与稀硝酸反应,也可以与稀硫酸反应D.由上述实验可得出结论:Cu .如表实验操作、现象与结论对应关系正确的是9、Z、Y、为原子序数依次增大的短周期主族元素,分布在三个不同周期。
、C、D、EX、10.AB的水溶液呈碱性,物质的转化WX为二元化合物且为强电解质,为这些元素形成的化合物,W 关系如图所示。
下列说法中正确的是C>D>BA.对应的简单离子半径: E形成的化合物为含有极性共价键的共价化合物B.D、 E对应的单质CC.电解、E形成的化合物水溶液,可生成、C 形成的化合物都含有共价键,溶液都呈强酸性、、.由DABE- 3 -I11.在含Fe的(aq)I(aq)(aq)?2I?(aq)?2SOSOOS282482机理及反3+-?2?2??2的分解的混合溶液中,反应和应进程中的能量变化如下:(aq)+2Fe(aq2I步骤①:2Fe(aq)+(aq)=I22?2?2?3?步骤②:(aq)2Fe2SO(aq)(aq)?SO?(aq)?2Fe428 3+-2+)下列有关该反应的说法正确的是B.Fe是该反应的催化剂FeA.反应速率与2?-3+OS vvv,则正反应的活化能3+2+浓度有关比逆反应的大.若不加Fe(.CI() D)=(I)=282铜空气燃料电池容量高、成本低,具有广阔的发展前景。
该电池通过一种复杂的铜腐-12.锂-+)( O+H蚀“现象”产生电力,其中放电过程为2Li+CuO═2Cu+2Li+2OH,下列说法不正确的是22.放电时,正极的电极反应式为ACu22.放电时,电子透过固体电解质向Li -- O+HO+2e=2Cu+2OH极移动BO C.通空气时,铜被腐蚀,表面产生Cu2.整个反应过程中,氧化剂为OD2 +-+-15 NH+NHNH,+NH NH1×10的平衡浓度为.已知液氨的性质与水相似。
13T ℃时,42334-1( ) mol,则下列说法中正确的是·L-14 A.在此温度下液氨的离子积为1×10 NaNH.在液氨中放入金属钠,可生成B2,可使液氨的离子积减小Cl NHC.恒温下,在液氨中加入4-+c c ).降温,可使液氨电离平衡逆向移动,且D)<(NH(NH24的关系如图所示。
14pH,得到部分含氯微粒的物质的量分数与pH.常温时,改变饱和氯水的下列叙述不正确的是- 4 --+KK7.54的对值的电离常数lg A.该温度下,HClO=-H+ClO aa- KI发生反应、、ClOHClO均能与 B.氯水中的Cl2?-cccc Cl)>(HClO)(>)>(ClO. CpH=1的氯水中,)(Cl23?-KK Cl减小的增大时,=0.191,当.已知常温下反应DCl(aq)+Cl(aq)pH(aq)23分)(58第Ⅱ卷非选择题)是大气污染物之一。
工业上在一定的温度和催化剂条件下,可用氮氧化物(NOx.15(10分) NO 的污染,生成两种对环境无害的物质。
NH来消除x3。
NO反应的化学方程式)请写出(1NH与23;)①写出实验室中由固体物质制取氨气的化学方程式(2②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示))电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。
实验室模3(气体进行模拟电解法吸若用NO的装置如图所示拟电解法吸收NO(图中电极均为石墨电极)。
x2收实验。
发生反应的电极反应式:NO①写出电解时2- 5 -。
为②若有标准状况下2.24 LNO被吸收,通过阳离子交换膜(只允许阳离子通过)+ H的2 mol。
) H是一种重要的清洁能源。
16.(12分 2-1H = -49.0kJ?molOH(g)+H1)已知: CO(g)+3H(g)CHO(g) Δ(22232H-1 ) Δ= -41.1 COCO(g)+HO(g)(g)+H(gmolkJ ?3222 OH(g) CO(g)+2H(g) CHO H还原 C反应合成甲醇的热化学方程式为:HΔ1223H-1,该反应自发进行的条件为=则Δ molkJ?1低温高温 BA .任何温度条件下C..,发生反应1mol CO和(2)恒温恒压下,在容积可变的密闭容器中加入2.2 mol H2则压强的变化如图所示。
实验测得平衡时CO的转化率随温度、CO(g)+2H(g)CHOH(g),32,判断的理由是PP 21。
(g)CO(g)+2H的密闭容器中发生,1LOH(g)3)若反应在温度不变且体积恒定为CH (32反应过程中各物质的物质的量随时间变化如表所示:15 5 10 0 /min时间 2 4 H2 H1 2 COCO OH(g)CH 0.7(填字母)①下列各项能作为判断该反应达到平衡标志的是3;vv )2(CH(H)=OHBA.容器内压强保持不变.32逆正 D.混合气体的密度保持不变C.混合气体的相对分子质量保持不变-2K p= P kPa,则在该温度下反应的平衡常数 (kPa)②若起始压强为=(用平衡分压代替平衡浓度计算,分压总压×物质的量分数)v)= H的反应速0。
率(H③反应速率若用单位时间内分压的变化表示,则10min内22-1。
min kPa?属于同主族元素,它们都能形成多种含氧酸。
中国自古就有“信口雌黄”As分)和P.17(9早期都曾用作绘画颜料,又都因有抗病毒疗效S)(AsS和雄黄(As)“雄黄入药”之说。
雌黄4423而用来入药。
在一定条件下,雌黄和雄黄的转化关系如图所示。
- 6 -HPO。
NaOH溶液反应生成NaPO) 是一种精细化工产品。
亚磷酸(HPO)与足量(1)亚磷酸(H333332)元酸。
_______(填“一”“二”或“三”①则亚磷酸为-7-2KK PO)的=2.5×10=5×10,,25②查阅资料知℃时,亚磷酸(H a23a13K溶液中加HPOHPO水解反应的Na=____________,若向NaHPO可使碘水褪色,25℃时,Na3332h22??POHc33)、“减小”或“不变”,则溶液中入少量的I将 ______ (填“增大”2?POcH32____(填化学式)mol电子,则物质a为II中,若0.5 mol AsS参加反应,转移14 (2)反应44常其在溶液中存在多种微粒形态。
HAsO可以用于治疗白血病,(3)反应Ⅲ中的产物亚砷酸33的变化如图所示。
AsO时,各种微粒的物质的量分数随pH温下,用NaOH溶液滴定H33当溶液由无色变为红色时停止滴加。
溶液中,HAsO将以酚酞为指示剂,NaOH溶液逐滴加入到33。
该过程中主要反应的离子方程式为族元素,单质有红硒、黑硒和灰硒,灰硒是良好周期ⅥA分)硒元素(Se)是第41618.(的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。
请回答下列问题:。
)基态Se原子价电子的轨道表示式为(1大,原因是。