3.电解:
电流通过电解质溶液而在阴阳两极上发生氧化还 原反应的过程。
电解池 把电能转化为化学能的装置。
形成条件: (1)有直流电源 (2)与电源相连的两个电极 (3)电解质溶液(或熔融的电解质) (4)形成闭合回路
电极判断
①由电解池中的电极与电源的(+)(-) 极的连接情况直接判断。与负极连接的为电 解池的阴极,与正极连接的为电解池的阳极。
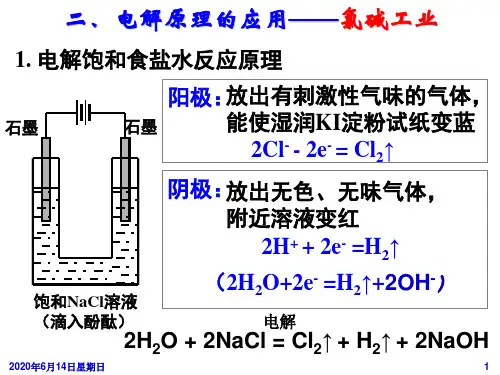
阴极:2H+ + 2e- = H2↑
总反应:2HCl
电解
===
H2↑+Cl2↑
电解CuCl2
阳极:2Cl-- 2e- = Cl2 ↑ 阴极:Cu2++2e- = Cu
电解总过反程应中:溶Cu液C的l2 =浓电=解度= C和uP+HC值l2↑如何变化?
无氧酸-----增大 溶液浓度减小,PH值 CuCl2-----减小
> Al3+>Mg2+>Na+>Ca+>K+
(2)阳极: 还原性越强,越易放电 (阳极本身或溶液中阴离 子失电子) ----与电极材料有关.若阳极为活性电极,则阳 极本身失电子溶解.若阳极为惰性电极,则溶液中阴离子 失电子.
活性电极>S 2->I ->Br ->Cl ->OH ->含氧酸根
人教版化学选修四第四章第三节--电 解池(共 22张PP T)
人教版化学选修四第四章第三节--电 解池(共 22张PP T)
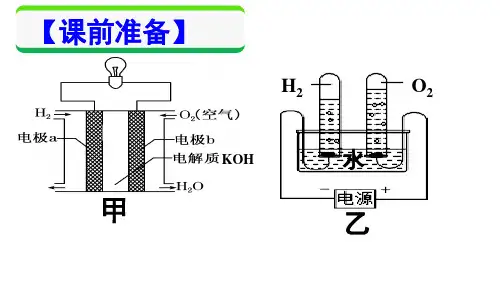
1、电解含氧酸(如:H2SO4﹑HNO3﹑H3PO4等) 活泼金属含氧酸盐(如:Na2SO4﹑KNO3等) ﹑强 碱(如:NaOH﹑KOH﹑Ca(OH)2﹑Ba(OH)2等) 实 质上是电解水.阳极产生O2,阴极产生H2