基因克隆的一般流程
- 格式:ppt
- 大小:1.57 MB
- 文档页数:20

以猪APOA2基因为例一.提取总RNATRIzol法提取RNATRIZOL试剂是直接从细胞或组织中提取总RNA的试剂。
它在破碎和溶解细胞时能保持RNA的完整性。
加入氯仿后离心,样品分成水样层和有机层。
RNA存在于水样层中。
收集上面的的水样层后,RNA可以通过异丙醇沉淀来还原。
在除去水样层后,样品中的DNA和总蛋白也能相继以沉淀的方式还原。
乙醇沉淀能析出中间层的DNA,在有机层中加入异丙醇能沉淀出蛋白。
共纯化DNA对于样品间标准化RNA的产量十分有用Trizol试剂可以快速提取人、动物、植物、细菌不同组织的总RNA,该方法对少量的组织(50-100 mg)和细胞(5×106)以及大量的组织(≥1 g)和细胞(>107)均有较好的分离效果。
TRIZOL试剂操作上的简单性允许同时处理多个的样品。
所有的操作可以在一小时内完成。
TRIZOL抽提的总RNA能够避免DNA和蛋白的污染。
故而能够作RNA 印迹分析、斑点杂交、poly(A)+ 选择、体外翻译、RNA酶保护分析和分子克隆。
如果是用于PCR,当两条引物位于单一外显子内时,建议用级联扩大的DNase I(Cat. No. 18068)来处理抽提的总RNA。
并且利用DNA、RNA和蛋白质在不同溶液中的溶解性质,可以通过分层分别将不同层中的RNA(上层)、DNA(中层)、蛋白质(下层)分离纯化出来,效率极好。
Trizol试剂能促进不同种属不同分子量大小的多种RNA的析出。
例如,从大鼠肝脏抽提的RNA琼脂糖凝胶电泳并用溴化乙啶染色,可见许多介于7 kb和15 kb之间不连续的高分子量条带,(mRNA和hnRNA成分)两条优势核糖体RNA条带位于~5 kb (28S)和~2 kb (18S),低分子量RNA介于0.1 和 0.3 kb之间 (tRNA, 5S)。
当抽提的RNA用TE稀释时其A260/A280比值≥1.8使用TRIzol注意事项TRIzol对人体有害,使用时应戴一次性手套,注意防止溅出。

基因克隆的一般程序
基因克隆通常包括以下步骤:
1.选择一个目标基因,并设计引物:在开始之前选择要克隆的
基因,并设计引物。
引物通常包括两个寡核苷酸序列,它们与目标基因的两端相匹配,并且在引物的末端含有限制性内切酶识别位点。
2.将目标基因PCR扩增:使用引物进行PCR扩增,从而扩增
目标基因。
PCR扩增过程中,添加限制性内切酶识别位点的
引物,则可以获得含有限制酶切割位点的PCR产物。
3.剪切PCR产物:将PCR产物用限制性内切酶进行切割,因
为PCR产物含有限制性酶切割位点,因此可以选择正确的限
制性内切酶来切割。
4.连接载体:将PCR产物和质粒(或其他载体)用T4 DNA
连接酶连接在一起。
质粒通常被用作载体,因为它们可以在细胞内稳定复制。
5.转化:将连接好的质粒导入大肠杆菌等推动器中,并将其生
长在培养基上,以让它们自我复制。
6.筛选克隆:使用蓝白斑筛选法确定哪些细菌含有转化的基因。
该方法利用质粒上的LacZ基因,这可以使含有原核素三硝基
甲酸的菌落变成蓝色,而不含此基因的细菌则是白色的。
7.确定序列:将可能的克隆 DNA 提取出来,然后将其进行测序,从而确定克隆基因的精确序列。
8.表达蛋白质:克隆基因的表达,可以用来表达蛋白质。
这可以通过让此基因插入到一个表达载体中来完成,然后将其转化至宿主细胞中,也可对其进行人工表达分析。

基因克隆的顺序
基因克隆的顺序通常包括以下步骤:
1. 选择目标基因:确定需要克隆的基因,可以是某个特定的基因,也可以是一段DNA序列。
2. 提取DNA:从源生物体中提取目标基因的DNA,通常使用DNA提取试剂盒来提取。
3. 制备质粒:选择一个适当的质粒,将其准备好作为目标基因的载体。
质粒通常是一段环状的DNA分子,可以自复制并在细胞中稳定存在。
4. 执行DNA切割:使用限制性内切酶将目标基因和质粒切割成相应的DNA片段。
内切酶是能够识别特定DNA序列并在其特定的位置进行切割的酶。
5. 连接DNA片段:将目标基因的DNA片段与质粒的DNA片段连接起来。
这可以通过DNA连接酶来实现,DNA连接酶能够催化两个DNA片段的连接。
6. 转化宿主细胞:将连接好的质粒转化到宿主细胞中,通常使用细菌作为宿主细胞。
转化可以通过电穿孔、化学方法或热激转化等方式进行。
7. 筛选重组细胞:利用筛选性培养基或标记基因等方法筛选出含有重组质粒的
细胞。
8. 纯化重组质粒:从筛选出的重组细胞中提取重组质粒。
9. 分析重组质粒:对提取出的重组质粒进行测序、限制性酶切等分析,确认克隆基因的准确性。
10. 表达目标基因:如果希望表达克隆的基因,可以将重组质粒转化到表达宿主细胞中,例如真核细胞或类似细胞。
需要注意的是,基因克隆的具体步骤可能会因实验目的、实验方法和克隆体的复杂性而有所不同。

一、CDNA基因克隆的基本原理CDNAplementary DNA)是DNA的互补序列,通过反转录酶将mRNA作为模板合成的一种DNA。
CDNA基因克隆是利用逆转录酶将mRNA逆转录合成cDNA,并通过PCR或其他方法将cDNA插入到质粒载体中,实现对目标基因的克隆。
二、CDNA基因克隆的流程1. RNA提取:首先需要从细胞中提取出总RNA,可以使用TRIzol等试剂进行RNA的提取纯化工作。
2. 反转录合成cDNA:将提取得到的RNA作为模版,利用逆转录酶进行cDNA的合成。
反转录反应通常包括RNA模版、随机引物、dNTPs、逆转录酶和缓冲液,并经过一系列温度循环反应,将mRNA 逆转录成cDNA。
3. cDNA纯化:为了避免反转录反应中产生的非特异性产物和杂质,需要对反转录反应产物进行纯化。
4. cDNA扩增:对cDNA进行PCR扩增,以获得目标基因的cDNA 片段。
PCR反应体系包括cDNA模板、引物、dNTPs、Taq聚合酶和缓冲液,通过一系列温度循环反应,扩增目标基因cDNA片段。
5. 酶切与连接:将PCR扩增得到的cDNA片段与质粒载体进行酶切,并在两者的黏端上连接。
6. 转化:将连接得到的质粒转化入大肠杆菌等细菌中,使其进行复制。
7. 筛选与鉴定:通过筛选和鉴定,选出携带目标基因cDNA片段的质粒,进行测序和分析,最终确定目标基因序列。
三、CDNA基因克隆的应用CDNA基因克隆技术已广泛应用于基因克隆、基因表达等多个领域。
在科研领域中,通过CDNA基因克隆技术可以方便快捷地获得目标基因的cDNA,实现对目标基因的研究和功能分析;在医药领域,CDNA基因克隆技术也被应用于基因治疗、蛋白表达等方面。
总结:CDNA基因克隆是一种重要的基因工程技术,通过反转录酶合成cDNA并将其插入到质粒中,可以方便地获取目标基因序列,具有广泛的应用前景。
掌握CDNA基因克隆的基本原理和流程对于开展相关实验研究具有重要意义。

简述外源基因原核系统克隆表达的基本流程外源基因在原核系统中的克隆表达是通过一系列步骤来实现的。
以下是基本的流程:1. 选择质粒载体(Plasmid Vector):-选择一个合适的质粒,通常是圆形DNA 分子,具有自主复制的能力。
质粒通常包含选择标记(例如抗生素抗性基因)和表达调控元件(例如启动子、终止子等)。
2. 准备目标基因:-获取外源基因,这可以是从其他生物中克隆得到的DNA 片段。
这个基因应该编码所需的蛋白质或RNA。
3. 限制性内切酶切割:-使用限制性内切酶切割质粒载体和目标基因。
选择适当的酶,以确保两者切口相互兼容。
4. 连接(Ligation):-将切割后的质粒和目标基因连接在一起,形成重组质粒。
这一步通常涉及DNA 连接酶。
5. 转化(Transformation):-将重组质粒导入宿主细菌中。
这可以通过热激冲击、电穿孔或其他方法实现。
质粒包含抗生素抗性基因,使得只有带有重组质粒的细菌能够在含有抗生素的培养基中生长。
6. 筛选(Screening):-鉴定带有正确重组质粒的细菌。
这可以通过PCR、酶切鉴定等技术来进行。
7. 培养:-将筛选出的正常克隆株培养起来,以增大其数量。
8. 表达:-利用宿主细菌的生物机制,使得外源基因在细菌中表达。
这通常涉及到适当的启动子和终止子,以及其他调控元件。
9. 纯化:-如有必要,对表达的蛋白质进行纯化。
这可以通过各种方法,如层析、电泳等来实现。
整个流程的成功依赖于实验室技术的熟练操作和对基因工程原理的深刻理解。
这些步骤的每一步都需要谨慎操作,以确保最终得到具有期望表达产物的克隆。

一:提质粒1:提取ml的菌液放到EP管中,12000r/s 30s离心,去除菌液,加入100微升的TE 振荡混匀后加入200微升裂解液二,轻轻混匀,是使细胞破碎,同时使蛋白变性和保持其高碱性,再加入150裂解液三轻轻混匀是鞋包裂解开(最佳的效果是上层是蛋白,下层是透明的液体),离心10min,将液体转移到另一个EP管中,加入等体积的异丙醇,静置10min或更长(一般以析出的DNA为主蛋白次之),离心10min 12000rpm/s ,除去上清液,加入400微升的70%的乙醇洗(去除里面的有机溶剂,同时使DNA 沉淀),去除乙醇,室温下开口放置5-10min或放到烘箱中使乙醇挥发干,再加入20微升的水,跑胶看浓度溶液I:Tris-Cl控制PH;葡萄糖后最大的好处只是悬浮后的大肠杆菌不会快速沉积到管子的底部;EDTA,无非就是要把大肠杆菌细胞中的所有二价金属离子都螯合掉,抑制DNase的活性,和抑制微生物生长。
溶液II:NaOH裂解细胞的作用;SDS主要是变性蛋白,也有溶解细胞的作用。
溶液III:3 M 醋酸钾钾离子置换了SDS中的钠离子形成了不溶性的PDS,而高浓度的盐,使得沉淀更完全。
SDS专门喜欢和蛋白质结合,平均两个氨基酸上结合一个SDS分子,钾钠离子置换所产生的大量沉淀自然就将绝大部分蛋白质沉淀了,同时大肠杆菌的基因组DNA也一起被共沉淀了;2 M 醋酸中和NaOH,因为长时间的碱性条件会打断DNA,所以要中和之。
25/50酚+24/50氯仿+1/50异戊醇的作用:酚抽提蛋白的作用;氯仿后可以增加比重,使得酚/氯仿始终在下层,方便水相的回收;异戊醇的添加,其作用主要是为了让离心后上下层的界面更加清晰,也方便了水相的回收。
乙醇---100%沉淀质粒的作用;70%洗质粒去离子的作用;RNase水:消化所提质粒中的RNA。
2:消化补到50微升体系,再加入5微升的RNase 放入37℃ 2-3个小时3:抽提加入150微升的TE补到200微升体系加入100微升的氯仿 100微升的苯酚充分混匀 12000rpm/s 10min 离心将上层液体转到新EP管中再像其中加入200微升的氯仿充分混匀,12000rpm/s 离心,取上层液体到新EP管中,加入1/4体积的5mol/L的NaCl 两倍体积的无水乙醇,放入-20℃ 3小时沉降后离心 12000rpm/s 10min ,70%的乙醇洗干,再晾干或烘干加20微升的水跑胶检测补充:酚氯仿法提取DNA的原理用酚抽提细胞DNA时,有什么作用?使蛋白质变性,同时抑制了DNase的降解作用。

转基因克隆动物的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!1. 目的基因的获取:确定需要转入的目的基因,例如特定的蛋白质编码基因或调控基因。

基因克隆的步骤一、RNA的提取1. 提取RNA前将洗净干燥的瓷研钵放入-70℃预冷10 min;2. 从液氮罐中取出样品组织放入预冷的研钵中,加液氮淹没后立即研磨,边研磨边加液氮,整个过程都不要使液氮挥干;3. 趁冷,将样品粉末50-80 mg加入1.5 mL离心管后再加入1 mL Trizol,样品体积应不超过所使用Trizol体积的10%,然后按照Trizol试剂盒说明操作;4. 室温静止5-15 min。
对于某些蛋白、多糖或脂含量很高的细胞或组织Trizol裂解后可能会有不溶物或油脂状漂浮物,需12000g、4℃离心10 min,然后吸取澄清的Trizol裂解产物至一新的离心管中;5. 每mL Trizol中加0.2 mL氯仿。
小心盖上离心管,剧烈地涡旋振荡15 sec,室温(24℃)静置3-5 min;(必需步骤)6. 12000 g、4℃离心15 min,此时混合物分成三部分:底层为苯酚-氯仿层,中间层,上层水相层,RNA完全存在水相中;7. 把小于80%的水相层(每mL Trizol约可吸0.5-0.55 mL)转移至一新的离心管中,并弃去下面的有机相(小心避免吸到中间层)。
往水相中加入异丙醇来沉淀RNA,每使用1 mL Trizol,便加500 uL的异丙醇,颠倒混匀,室温下孵育样品10 min;8. 4℃、12000 g离心样本10 min弃去上清,每mL Trizol加入1 mL 75%乙醇,涡旋混匀,室温沉淀10 min后,7500 g、4℃离心5 min,弃上清。
再用离心机甩一下(5000rpm,离心1 s);9. 小心吸走乙醇,短暂地在室温下置2-5 min,让RNA团风干,不要用离心干燥装置或真空干燥装置,因为过度干燥会导致很难用水重新溶解RNA,然后在55-60℃温浴10 min,然后-70℃保存。
[RNA](ng/uL)=A260×40×稀释倍数[DNA](ng/uL)=A260×50×稀释倍数纯DNA:OD260/OD280≈1.8(>1.9,表明有RNA污染;<1.6,表明有蛋白质、酚等污染)纯RNA:1.7<OD260/OD280<2.0(<1.7时表明有蛋白质或酚污染;>2.0时表明可能有异硫氰酸残存)二、M-MLV RT反转录1. oligo dT 1 uL + dNTP(2.5 mM)4 uL + 1-5 ug total RNA + 水= 12 uLHeat mixture to 65℃ for 5 min and quick chill on ice;2. 上述12 uL液体+ 5×Buffer 4 uL + 0.1 M DTT 2 uL + RNase OUT 1 uLMix contents of the tube,incubate at 37℃for 2 min3. 上述19 uL液体加M-MLV RT 1 uLIncubate tube at 25℃for 10 min;Incubate 50 min at 37℃;70℃for 15 min。

PCR技术克隆目的基因全过程PCR(聚合酶链式反应)是一种体外的DNA合成技术,可以通过放大目的基因序列来克隆和检测DNA。
以下是PCR技术克隆目的基因全过程的详细解释。
1.设计引物:引物是用于扩增目的基因的短DNA片段。
引物分为前向引物和反向引物,其序列分别与目的基因的5’和3’末端相互匹配。
引物的设计应该尽量避免互相形成二聚体或发生引物间杂交。
一般情况下,前向引物和反向引物的长度约为18-30个碱基。
2.DNA模板的准备:DNA模板是PCR反应中的起始材料,可以是从细胞中提取的基因组DNA、cDNA或合成的DNA片段等。
DNA模板需要经过特定的处理步骤,如酶切或热变性,以解开DNA双链结构,使得引物能够与目的基因序列起始材料结合。
3.PCR反应体系的制备:PCR反应体系通常包含DNA模板、引物、dNTPs(脱氧核苷酸三磷酸盐)、聚合酶、缓冲液和稀释的镁离子。
这些成分需要以特定的量和浓度配制在一起。
在反应体系中加入适量的聚合酶,可以保证PCR反应能够进行。
4.PCR扩增条件设定:PCR反应需要经历一系列的温度变化,这些温度的设定旨在创造一个适宜扩增引物的环境。
PCR反应通常包含三个主要的步骤:变性、退火和延伸。
变性步骤中,DNA模板的双链结构被加热到95°C,使其变性为两条单链DNA。
退火步骤中,反应体系温度降至碱基互补序列的温度,使引物能够与DNA模板结合。
延伸步骤中,反应体系温度升至适合聚合酶的工作温度,引物被复制形成两条新的双链DNA。
这三个步骤的温度和时间根据目的基因的特性和引物的设计来设定。
5.PCR扩增循环:PCR反应通常包含20-40个循环,每个循环包括变性、退火和延伸三个步骤。
每个循环都会使目的DNA序列扩增一倍。
PCR反应的循环数取决于目的基因的起始材料的丰度和所需扩增的DNA数量。
6.PCR产物检测:PCR扩增产物可以通过凝胶电泳等方法进行检测。
凝胶电泳可以将PCR扩增产物按照大小分离。

简述基因工程的操作流程
基因工程操作流程一般包括以下几个步骤:
1. 确定目标基因:首先,科学家需要确定要操作的目标基因。
这可以通过已有的科研成果、文献研究和实验验证来确定。
2. 基因克隆:科学家需要将目标基因从生物细胞中提取出来,这个过程称为基因克隆。
基因克隆方法可以有多种,常用的方法包括PCR(聚合酶链式反应)、限制酶切和连接、DNA合成等。
3. 基因修饰:一旦提取到目标基因,科学家可以进行基因修饰。
这可能包括删除、插入或修改特定的基因片段。
4. 载体构建:科学家需要选择合适的载体,将目标基因插入其中,以便将其转移到目标细胞中。
这可能涉及到构建表达载体,以确保目标基因在细胞中得到高效表达。
5. 转染:将构建好的表达载体或重组质粒引入目标细胞。
转染方法可以包括化学转染、电穿孔、冷冻激发等多种技术。
6. 选择与鉴定:为了筛选出成功转染的细胞,科学家需要进行适当的选择和鉴定步骤。
常见的选择方法包括利用抗生素抑制未转染的细胞,而含有目标基因的细胞则能够生存下来。
鉴定成功转染的细胞可以通过PCR、南方杂交、蛋白质表达检测等方法。
7. 过程优化:在基因工程中,科学家可以对上述步骤进行优化,以提高基因转移的效率和目标基因的表达效果。
这可能包括改进载体构建、优化转染条件、研究目标基因的调控机制等。
基因工程操作流程可以根据实际需求和目标的不同而有所差异,但以上步骤是常见的基本流程。
整个过程需要科学家具备扎实的基因工程技术知识和实验操作能力。
基因克隆实验流程基因克隆技术,又称重组 DNA 技术,是将目的基因与具有自主复制能力的载体DNA 进行体外重组,获得新的重组DNA后导入受体细胞中表达相应蛋白,以研究蛋白结构与功能及其与其他分子的相互作用。
一、获取目的基因目的基因就是需要研究的特定基因或DNA片段。
获取目的基因的主要方法: 1、用限制性内切酶解染色体DNA,构建基因组文库,再从基因组文库中筛选目的基因。
该法的优点是获得的目的基因的组织结构与天然基因完全相同,在结构基因中也含有内含子序列,但是也正因为这一点构成了该法最大缺点,即含有内含子的基因在原核细胞中不能表达。
原因是原核细胞不能识别并剪切插入顺序(内含子),因而也不能表达出正确的基因产物。
2、分离纯化细胞中的mRNA,以mRNA为模板,在反转录酶作用下生成cDNA第一链,再以cDNA第一链为模板在DNA聚合酶作用下生成双链cDNA,构建cDNA文库,从中筛选所需的目的基因。
此法仅用于筛选为蛋白质编码的结构基因。
因成熟的mRNA分子中已经切除了内含子序列,具有完整的阅读框架,可在原核细胞中正确表达。
3、人工体外合成基因:由于当前人工体外合成DNA的长度有限,此法仅用于制备小分子生物活性多肽基因和小分子量蛋白基因。
在基因较大情况下,常需先合成多个DNA片段,然后拼接成完整的基因,此法还要求目的基因的全部碱基顺序已被阐明。
4、PCR法扩增基因:PCR(聚合酶链式反应)技术的出现和发展,为目的基因的寻找提供了有力技术工具。
用PCR法可选择性扩增基因组中所要研究的个别基因或DNA片段,或用反向PCR技术,先将特定mRNA反转录为cDNA第一链,然后再进行扩增。
用PCR法筛选基因,需要对目的基因的DNA序列至少有部分了解。
二、选择适当的载体按上述方法制备的目的基因如果没有合适的载体协助,很难进入受体细胞,即使能进入,往往也不能进行复制和表达,因为这些外源性DNA一般不带有复制调控系统。
为了保证目的基因或外源DNA片段能在细胞内克隆,必须将它们与适当的载体连接。
1总RNA提取(1) 液氮研磨或冰上匀浆实验材料;先将1ml Trizol加到离心(7) 弃上清,加1 mL75%乙醇,漂浮洗涤沉淀,振荡充分;再用100%乙醇清洗(8) 4o C,7,500g,离心5 min;(9) 弃上清,离心,用枪吸取多余液体,放在超净台里干燥后,加50 μL DEPC水,-80o C保存。
此操作中所用到的器皿均需经过DEPC灭活RNA酶处理。
提取的2反转录/cDNA第一链的合成RNA纯化后,即可进行反转录。
其体系为:5×PrimeScript Buffer 2(for Real Time) 4μLPrimeScript RT enzyme mix Ⅰ1μL RT Primer Mix 1μL上一步的反应液10μLO 补齐至20μL RNase Free dH2 Array模板5μL 引物1 (10 μM) 1 μL引物2 (10 μM) 1 μLddHO 18μL2PCR反应条件为:94°C预变性5min;94°C变性30s,53°C退火30s,72°C延伸30s,循环36次;72°C延伸10min。
(3) 将样品倒入一个吸附柱CB2中(吸附柱放入收集管中),室温下13,400×g离心1 min,倒掉收集管中的废液,吸附柱CB2重新套回收集管中;(4)向吸附柱CB2中加入600μL漂洗液PW(加乙醇),室温下13,400×g离心1 min,倒掉收集管中的废液,吸附柱CB2重新套回收集管中;(5) 重复上一步骤;(6) 将吸附柱CB2放入收集管中,室温下13,400×g离心2 min,尽量除去漂洗液,将吸附柱置于室温放置数分钟,彻底晾干;(2) 16o C反应30分钟,所得产物保存于-4o C冰箱备用。
4.3连接产物转化E.coli DH5α(1) 将5 µL连接产物加入到100µL E.coli DH5α感受态细胞中,轻轻旋转离心管混匀内容物,冰上静置30 min;(2) 42o C水浴热激转化90 sec,立即放回冰上,放置3 min;(3) 每管加入500 µL LB培养基(室温放置),37o C 160-180 rpm振荡培养45-60 min,使菌体复苏并表达抗性基因;(4) 在含有Amp(100 µg/m L)的选择性平板上加入60-100 µL 菌液,用无菌涂布棒轻轻涂布均匀后,用Parafilm膜封好;。
纤维素酶基因的克隆表达过程
纤维素酶基因克隆表达过程一般包括以下几个步骤:筛选物种、
提取DNA-研究和分析基因结构->筛选目的基因->克隆基因->检测和转
化载体->重组DNA复制->表达研究->纯化蛋白。
1. 筛选物种:对物种进行筛选以发现合适的蛋白质结构,以纤维
素酶为例,通常采用PCR技术,并将克隆的片段进行分析,以确定物
种的真实存在。
同时,筛选物种时,也要注意基因间的变异性。
2. 提取DNA-研究和分析基因结构:从筛选的物种中提取DNA样本,然后进行研究和分析,以确定纤维素酶的基因结构。
3. 筛选目的基因:通常使用PCR技术来筛选出含有纤维素酶基因
的碱基序列,以确定基因片段的位置。
4. 克隆基因:使用PCR将基因片段复制到目标载体上,以确保纤
维素酶基因的克隆表达。
5. 检测和转化载体:通过检测和转化载体,确定基因片段在载体
上是否形成可表达的二次构型。
6. 重组DNA复制:使用特定的启动子串以及适当的编码区,将克
隆的DNA片段复制到可以表达的DNA构型中。
7. 表达研究:在表达研究中,可以进行载体的优化,这样可以更
高效地利用DNA片段进行表达,在重要的步骤中可以做出更高的表达
水平。
8. 纯化蛋白:在实验室中使用某些蛋白纯化技术,如激活离子,
晶体结构等,来精确地纯化纤维素酶蛋白。
这也是表达纤维素酶基因
的重要步骤,因为它决定了纤维素酶的最终形态和功能。
基因克隆主要过程一、基因克隆概述基因克隆是指将一个细胞中的某个基因序列复制并转移到另一个细胞中,从而使目标基因得以表达。
基因克隆的过程包括:选择适当的宿主细胞、构建载体、将目标基因插入载体中、转化宿主细胞、筛选转化成功的细胞并培养、分离纯化目标基因等步骤。
本文将对这些过程进行详细的介绍。
二、选择适当的宿主细胞选择适当的宿主细胞是基因克隆的第一步。
通常情况下,常用的宿主细胞包括大肠杆菌、酵母等。
选择宿主细胞的标准主要包括以下几个方面:1.易于培养:宿主细胞应具备简单、廉价、高效的培养条件,以便进行大规模的培养和筛选。
2.安全性:宿主细胞不应具备对人体有害的特性,以免对生物安全造成威胁。
3.生长速度:宿主细胞应具备较快的生长速度,以便加快基因克隆的进程。
三、构建载体在基因克隆中,常用的载体有质粒、病毒和人工染色体等。
构建载体的主要目的是将目标基因插入到载体中,并确保其能够被宿主细胞所识别和复制。
构建载体的步骤如下:1.获取载体:从自然界或者实验室中获取合适的载体,并通过酶切和连接等技术进行改造。
2.插入目标基因:将目标基因与载体进行连接,一般通过限制性酶切和连接酶的作用,将目标基因与载体的开放的端部连接。
3.反选:通过选择适当的标记(如抗生素耐药性基因)进行反选,以筛选出成功插入目标基因的载体。
四、将目标基因插入载体中将目标基因插入载体中是基因克隆的核心步骤,常用的方法有PCR扩增插入法、限制性内切酶法和电泳法等。
1. PCR扩增插入法PCR扩增插入法是目前常用的一种方法。
具体步骤如下:1.PCR扩增:使用PCR技术将目标基因的DNA序列扩增得到线性DNA片段。
2.载体切割:使用限制性内切酶将载体切割成开放的线性片段。
3.连接:将扩增得到的目标基因片段与载体线性片段进行连接,需注意连接时选择合适的限制性内切酶。
2. 限制性内切酶法限制性内切酶法是较为传统的方法,也是基因克隆中常用的一种方法。
具体步骤如下:1.载体切割:使用限制性内切酶将载体切割为开放的线性片段。
克隆的技术流程
1.收集细胞根据所要克隆的生物不同,收集其体细胞、胚胎细胞等成熟细胞。
2.剪接基因将收集的细胞进行基因剪接,选择需要的基因片段。
3.根据选择的基因片段放入载体中将选择的基因片段放入一个载体,大多数情况下选择细胞质内或细胞质外的载体.
4.转染将载体和治疗细胞放在一起,用电穿孔法,微注、冷冻水浴方法将载体中的DNA 转入人类细胞,并与其内的DNA 融合。
5.筛选克隆经转染后,将被转染治疗的细胞进行分化,筛选同质多次基因和先天性异常筛选。
6.培养克隆过筛的正品克隆被写透明拓扑表达式,成为完美的DNA基因库,这些克隆被培养,以备日后的应用。
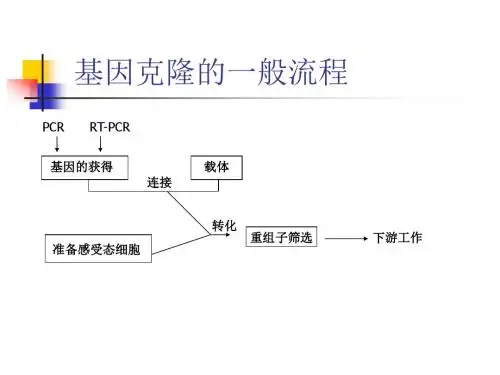
基因克隆的一般流程
基因克隆的一般流程包括以下步骤:
1. 获取目的基因片段:可以从目的生物的基因组DNA或mRNA逆转录合成的双链cDNA分子中获得目的基因。
这一步也可以通过人工化学合成来完成,特别是对于已知序列且较小的基因。
2. 选择克隆载体:载体应具有一些基本的性质,如能在宿主细胞中独立复制和表达,分子量小,易于结合更大的外源DNA片段,并具有易于检测的遗传标记,如抗药性标记基因。
3. 限制性酶切:载体分子最好具有多个限制酶单一切点,这样可以为避开外源DNA片段中限制酶位点的干扰提供更大的选择范围。
4. 连接:将目的基因片段与载体分子通过DNA连接酶连接起来。
5. 转化:将连接产物导入宿主细胞中,使目的基因在细胞内复制和表达。
6. 筛选阳性重组子:通过特定的筛选方法,如抗药性筛选或基于遗传标记的筛选,从众多的细胞中找出含有目的基因的阳性重组子。
以上步骤完成后,就可以进行后续的基因表达、功能分析等研究。
希望以上内容对您有帮助。