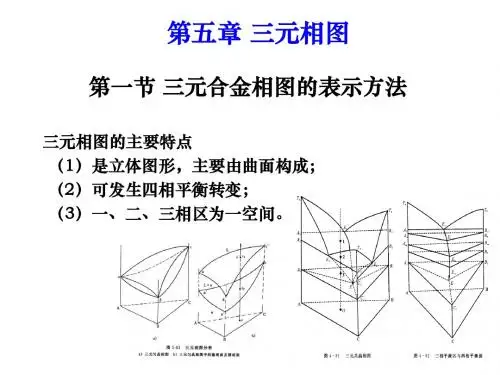
三元相图的绘制详解
- 格式:doc
- 大小:707.50 KB
- 文档页数:5




三元相图的绘制详解在材料科学、化学等领域,三元相图是一种非常重要的工具,它能够直观地展示三种组分在不同条件下的相态变化和平衡关系。
三元相图的绘制并非易事,需要对相关的理论知识有深入的理解,并掌握一定的实验技巧和数据处理方法。
下面,就让我们一起来详细了解三元相图的绘制过程。
要绘制三元相图,首先得明确什么是三元相图。
简单来说,三元相图是表示在恒压和恒温下,由三种组分构成的系统中,各相的状态与成分之间关系的图形。
它通常由等边三角形组成,三角形的三个顶点分别代表三种纯组分。
绘制三元相图的第一步是确定研究的体系和实验条件。
这包括选择要研究的三种物质,设定温度、压力等参数。
在确定了体系和实验条件后,接下来就是进行实验获取数据。
实验方法多种多样,常见的有热分析法、金相法、X 射线衍射法等。
以热分析法为例,我们将不同成分的样品加热或冷却,通过测量样品的温度随时间的变化,来确定相变点。
在实验过程中,需要精确控制温度变化的速率,以确保测量结果的准确性。
同时,要对多个不同成分的样品进行测试,以获得足够的数据来绘制相图。
当我们获得了大量的实验数据后,就可以开始着手绘制相图了。
绘制的过程中,需要将实验得到的相变温度和成分数据标注在等边三角形的坐标上。
在标注数据时,要注意坐标的转换和计算。
因为在三元相图中,成分通常用质量分数或摩尔分数来表示,而不是直接用实验中测量得到的数值。
比如说,如果我们知道了三种组分 A、B、C 的质量分数分别为 wA、wB、wC,那么在等边三角形坐标中,对应的坐标点可以通过以下公式计算:对于 A 组分,横坐标 xA = wA /(wA + wB + wC) ×边长对于 B 组分,纵坐标 yB = wB /(wA + wB + wC) ×边长通过这样的计算,我们就可以将实验数据准确地标注在相图上。
标注完数据点后,接下来就是连接这些点,形成相区的边界线。
这需要根据相律和热力学原理来判断。


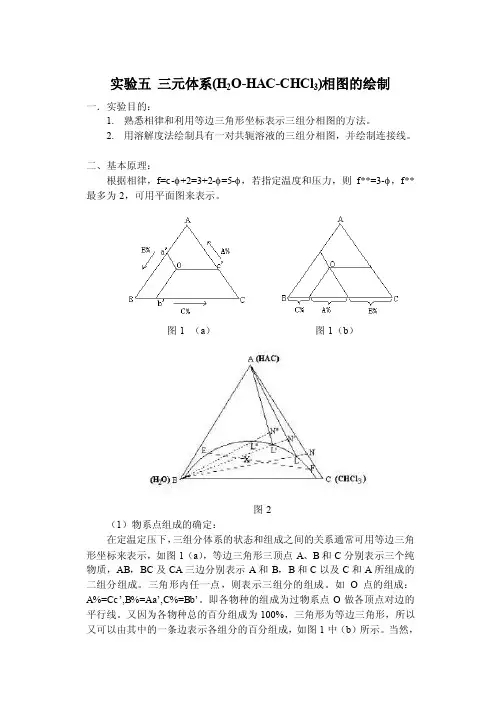
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。



三元相图的绘制
本实验是综合性实验。
其综合性体现在以下几个方面:
1.实验内容以及相关知识的综合
本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合
本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的
1. 掌握相律,掌握用三角形坐标表示三组分体系相图。
2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理
三组分体系K = 3,根据相律:
f = K–φ+2 = 5–ф
式中ф为相数。
恒定温度和压力时:
f = 3–φ
当φ= 1,则f = 2
因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:
图1 图2
等边三角形三顶点分别表示三个纯物质A,B,C。
AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如点P 的组成为:A%=Cb B%=Ac C%=Ba
具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。
曲线DEFHIJKL为溶解度曲线。
EI和DJ是连接线。
溶解度曲线内(ABDEFHIJKLCA)为单相区,曲线外为两相区。
物系点落在两相区内,即分为两相。
图3(A醋,B水,C氯仿)绘制溶解度曲线的方法有许多种,本实验采用的方法是:将将完全互溶的两组分(如氯仿和醋酸)按照一定的比例配制成均相溶液(图中N点),再向清亮溶液中滴加另一组分(如水),则系统点沿BN线移动,到K点时系统由清变浑。
再往体系里加入醋酸,系统点则沿AK上升至N’点而变清亮。
再加入水,系统点又沿BN’由N’点移至J点而再次变浑,再滴加醋酸使之变清……如此往复,最后连接K、J、I……即可得到互溶度曲线,如图3所示。
三. 实验准备
1. 仪器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。
2. 药品:冰醋酸,氯仿,NaOH溶液(0.2mol·mol–3),酚酞指示剂。
四.操作要点(各实验步骤中的操作关键点)
1. 因所测的体系中含有水的成分,所以玻璃器皿均需干燥。
2. 在实验过程中要注意防止或尽可能减少氯仿和乙酸的挥发,测定连接线时取样要迅速。
3. 当体系中乙酸含量少时,滴加水要逐滴加入,注意判断终点。
在滴加水的过程中须一滴滴地加入,且需不停地振摇锥形瓶,待出现浑浊并在2-3分钟内不消失,即为终点。
特别是在接近终点时要多加振摇,这时溶液接近饱和,溶解平衡需较长时间。
1.在洁净的酸式滴定管内装水,移取6ml氯仿及1ml醋酸于干燥洁净的100ml磨口锥形瓶中,然后慢慢滴入水,且不停地振摇,至溶液由清变浊,即为终点,记下水的体积。
再向此瓶中加入2ml醋酸。
体系又成均相,继续用水滴至终点。
同法再依次加入3.5ml,6.5ml 醋酸,并分别再用水滴定,记录各次各组分的用量。
最后加入40ml的水,盖紧瓶塞,每隔5min振摇一次,约30min后将此溶液作测量连接线使用(溶液1)。
2.另取一干燥洁净的100ml磨口锥形瓶,用移液管移入1ml氯仿和3ml醋酸。
用水滴定至终点,以后依次再添加2ml,5ml,6ml醋酸。
分别用水滴定至终点。
记录各次各组分的用量。
最后加入9ml氯仿和5ml醋酸,混合均匀,每隔5min振摇一次,约30min后作为测量另一根连接线使用(溶液2)。
3.将2只25ml磨口锥形瓶称重,待用。
将溶液1和溶液2静置,待溶液分层后,用干燥洁净的移液管吸取溶液1上层2ml,下层2ml,分别放入已经称重的25ml磨口锥形瓶中,再称其重量。
然后以酚酞为指示剂,用0.5M的NaOH溶液滴定至终点。
根据两相中乙酸的含量确定溶解度曲线上的两个点,两个点连接即为连接线。
4.同步骤3,移取溶液2上层液2ml和下层液2ml,称重并滴定。
五.本实验的成败关键
1. 酸式滴定管和碱式滴定管的操作正确和规范。
2. 测定溶解度曲线时滴定终点“由清变浑”的准确判断。
六.思考题及解答
(一)判断题
1. 本实验每一次往体系中加入氯仿或者醋酸时,其体积都必须精确到0.01ml。
2. 本实验所用的具塞磨口锥形瓶在临用前,一定要清洁且干燥。
3. 连结两个成平衡的相点的线段称为连结线。
(二)单选题
1. 关于本实验所用的三角形坐标的特点,不正确的说法是:
A. 在过三角形某一顶点的任一直线上所代表的体系中,另外两组分的浓度都相同
B. 任意两点代表的体系组成新体系时,新体系的物系点必在原来两点的连接线上
C. 任意三个点代表的体系组成新体系时,新体系的物系点必在原来三点连成的三角形内
D. 在平行于三角形一边的直线上所有的点代表的体系中,某个组分的浓度是固定不变的
2. 本实验中用水滴定醋酸-氯仿体系时终点的现象是:
A. 体系由无色变为浅红色
B. 体系由清变浑
C. 体系由浅红色变为无色
D. 体系由浑变清
3. 在本实验所绘制的相图5-2中,区域Ⅰ和Ⅱ的相数分别为:
A. 1、2
B. 2、1
C. 1、1
D. 2、 2
图5-2
答案:判断题:1(对) 2(对) 3 (对)
单选题:1 A 2 B 3 B
七.问题讨论:
1.若滴定过程中不小心超过终点,是否需要重做?
答:滴定过程中若不小心超过终点,可以再滴加几滴醋酸(记录加入量),至刚由浑变清作为终点,记录实际各组分的用量。
无需返工。
2.不同温度时各物质的密度:
32639
()10()10()10273.2T s s s s s d d T T T T T T T K αβγ---=+-⨯+-⨯+-⨯=
3.为什么说具有一对共轭溶液的三组分体系的相图对确对各区的萃取条件极为重要?
答:(如下图)将组成为N 的混合溶液加入B 后,体系沿NB 线向B 方向变化,当总组成为O 点时,此时体系为两相x 1,y 1。
如果把这两层溶液分开,分别除去B ,得由S 、F 点代表的两个溶液(S 在Bx 的反向延长线上,F 在By 的反向延长线上)。
这就是说经过一次萃取除去溶剂后,能把原来组成为N 的原溶液分成S 和F 两个溶液,其中S 含C 较多、F 含A 较多。
如果对浓度为x 的溶液再加入溶剂B 进行第二次萃取,此时物系点将沿xS 向x 方向
变化,设达到O’点时,体系为两相,组成为x’和y’点。
除去x’和y’点中的溶剂B,到S’和F’点,其中S’中C的含量比S高、F’中A的含量比F的高。
如此反复多次,最终可以得到纯A和C。
萃取过程示意图
很麻烦!。